Chronisches Koronarsyndrom – Diagnostik und Therapie
Einleitung/Definition
Das chronische Koronarsyndrom (CCS) beinhaltet eine Bandbreite an klinischen Erscheinungen oder Syndromen, hervorgehend aus strukturellen und/oder funktionellen Veränderungen, die mit einer chronischen Erkrankung der Koronararterien und/oder der Mikrozirkulation vergesellschaftet sind (ESC Leitlinie 2024). Neu deckt der Begriff somit auch die mögliche mikrovaskuläre Komponente eines CCS mit ab (ANOCA/INOCA).
Symptome und klinische Befunde
Die typische Angina pectoris ist definiert als die Summe der 3 Charakteristika:
- Retrosternaler Thoraxschmerz (druckartig, Enge) und Dauer (≤ 10 min), evtl. mit Ausstrahlung linker Arm/Schulter, Hals/Kiefer
- Hervorgerufen durch körperliche Anstrengung oder emotionale Belastung, verstärkt bei Kälte
- Besserung durch Ruhe und/oder Nitrate innerhalb von Minuten
Gemäss den ESC-Leitlinien Chronisches Koronarsyndrom (CCS) 2024 wird die (Belastungs-)Dyspnoe wie bereits 2019 als Angina-Äquivalent berücksichtigt. Da die Symptome jedoch stark variieren können, wird eine strenge Einteilung nach typisch/atypisch/extrakardialen Beschwerden nicht mehr empfohlen. Stattdessen sollten die Beschwerden möglichst genau beschrieben und nach Qualität, Lokalisation, Dauer und Auslöser/Trigger eingeordnet werden, um die klinische Wahrscheinlichkeit eines CCS zu senken oder zu erhöhen.
Diagnostik
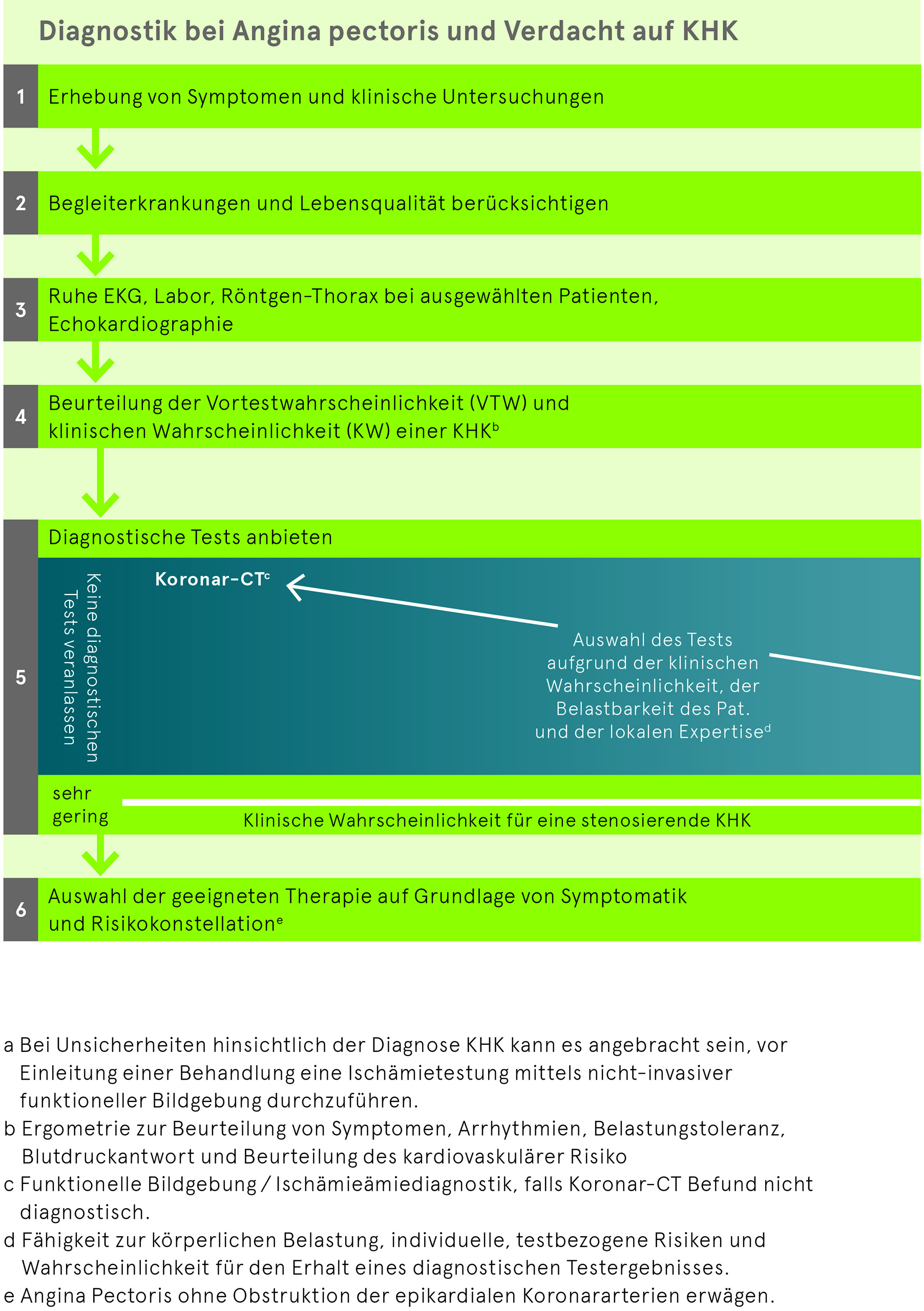
Abklärungsstrategie
Bei symptomatischen Patientinnen und Patienten mit vermutetem CCS erfolgt die Abklärung schrittweise und anhand der Vortestwahrscheinlichkeit.
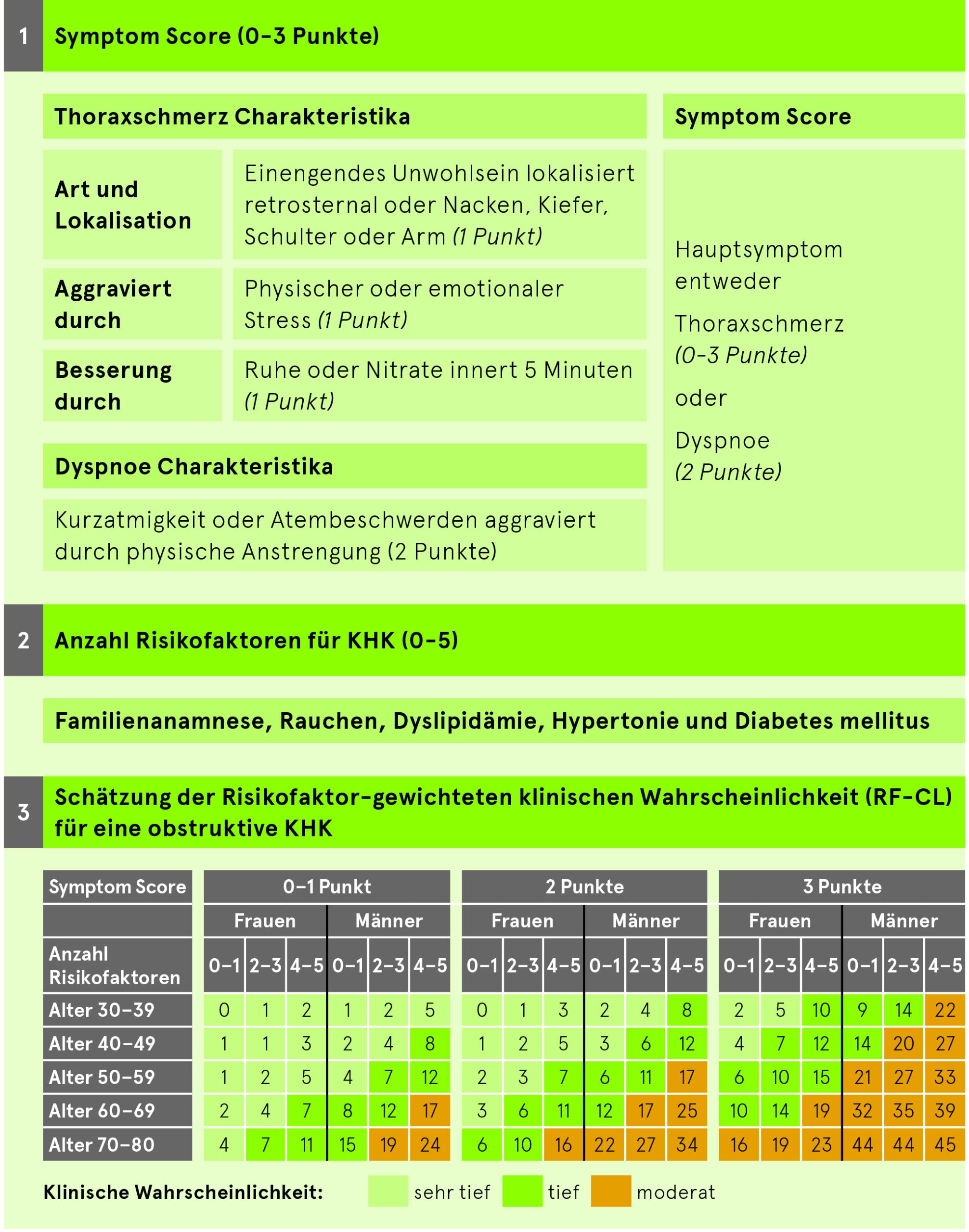
Die Einschätzung der Vortestwahrscheinlichkeit für eine stenosierende KHK erfolgt anhand einfacher klinischer Charakteristika wie Art des Brustschmerzes, Alter und Geschlecht sowie Anzahl an kardiovaskulären Risikofaktoren (Positive Familienanamnese [Verwandte I° mit manifester KHK < 60J ♂, < 65J ♀], Nikotin, Dyslipidämie, Arterielle Hypertonie, Diabetes mellitus). Als modifizierende Faktoren der Vortestwahrscheinlichkeit werden zusätzlich berücksichtigt: EKG-Veränderungen, LV-Dysfunktion, Koronarkalk im CT (Ca-Score), Laborwerte (Lipidprofil, Kreatinin, HbA1c, ggf. inkl. hs-CRP und/oder Fibrinogen). Ab einer niedrigen (> 5-15%) bis zu einer moderaten (> 15-50%) Vortestwahrscheinlichkeit wird eine weitere funktionelle Diagnostik empfohlen (siehe Abb. 2).
Vortestwahrscheinlichkeit (VTW) einer obstruktiven Koronaren Herzerkrankung – Risk-Factor Clinical likelihood Score (RF-CL)
Nicht-invasive Risikostratifizierung bei Koronarer Herzerkrankung
| Hohes Risiko (> 3% jährliches Mortalitätsrisiko) |
|
| Intermediäres Risiko (1–3% jährliches Mortalitätsrisiko) |
|
| Niedriges Risiko (< 1% jährliches Mortalitätsrisiko) |
|
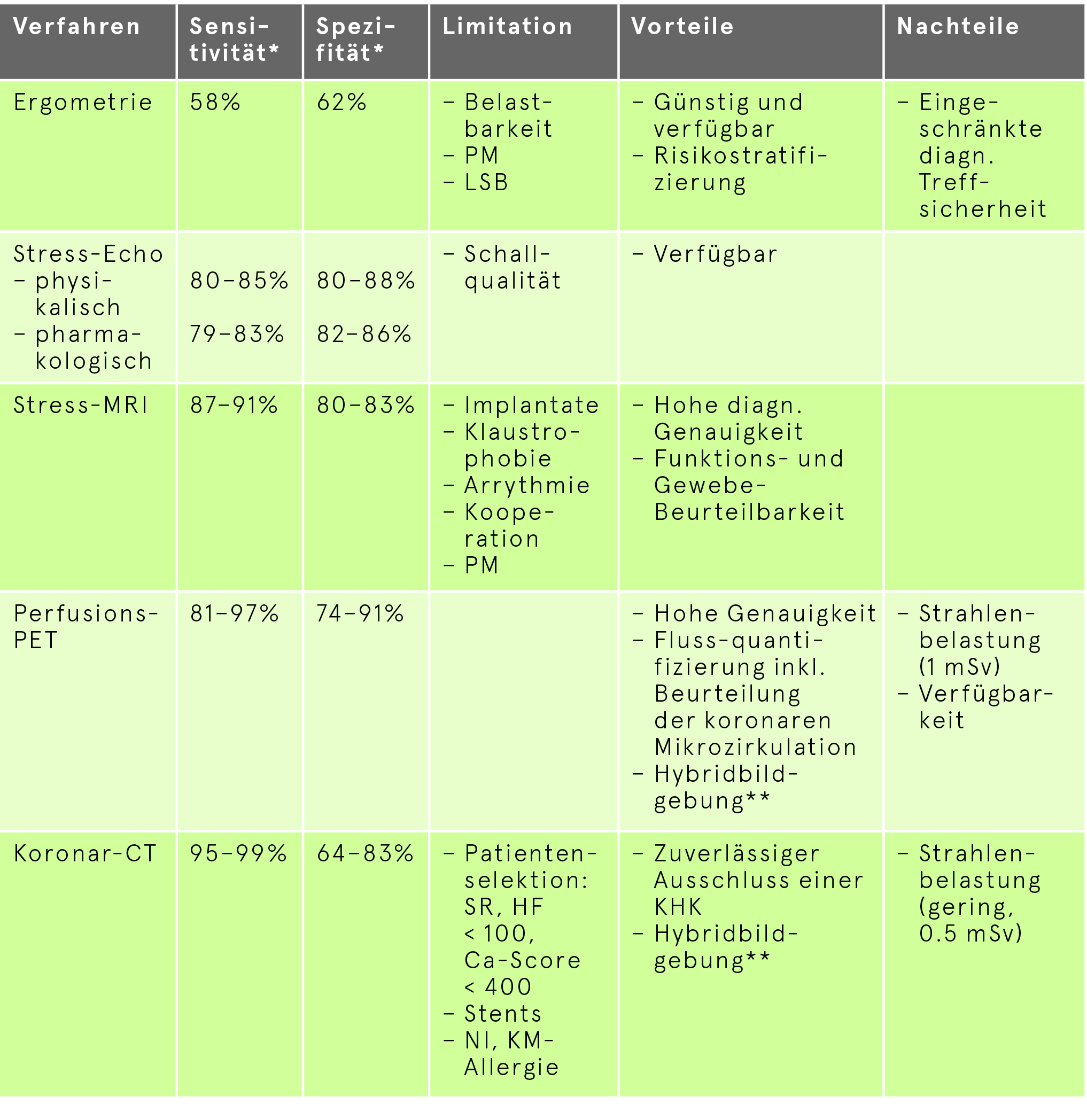
Vergleich der nicht-invasiven Untersuchungen: Diagnostische Genauigkeit, Limitationen, Vor- und Nachteile
Fahrrad-Ergometrie
Indikationen
- Wird nicht mehr zur Primärdiagnostik bei Verdacht auf eine stenosierende KHK empfohlen: stattdessen sind nicht-invasive bildgebende Tests indiziert
- Kann jedoch bei initial bereits niedriger Vortestwahrscheinlichkeit (< 15%) eingesetzt werden, um bei einem negativen Test und normaler Leistungsfähigkeit eine KHK praktisch auszuschliessen (gute Ausbelastung: bei Doppelprodukt > 25’000 (HFmax × BDsystmax)/ HF > 85 % der berechneten HFmax )
- Im Management der KHK empfohlen zur Beurteilung von Leistungsfähigkeit, Symptomen, Arrhythmien, Blutdruckverhalten und Risikoabschätzung
- Als Objektivierung der körperlichen Leistungsfähigkeit wertvoll (z.B. im Rahmen einer präoperativen Abklärung)
Limitationen respektive fehlende Aussagekraft
- Vorbestehende ST-Streckensenkung (1 mm) in Ruhe
- WPW, Linksschenkelblock (LSB), Schrittmacher-Rhythmus
- Digoxin-Therapie
Stress-Echokardiografie
Technik
Beurteilung der Kontraktilität des linken Ventrikels in Ruhe und unter Belastung (medikamentös mit Dobutamin und ggf. Atropin oder dynamisch mit einem Liegeergometer). Grosszügige Anwendung eines US-Kontrastmittels (z.B. SonoVue) bei unzureichender Darstellung von ≥ 2 LV-Segmente. Nimmt die Kontraktilität unter der (ergometrischen oder pharmakologischen) Belastung lokal ab, entspricht dies einem indirekten Ischämienachweis und erlaubt Rückschlüsse auf die Lokalisation und das Ausmass der Ischämie.
Indikationen
- Ischämiediagnostik: ab einer moderaten (> 15%) bis hohen (> 50%) Vortestwahrscheinlichkeit sinnvoll
- Präoperative Risikostratifizierung
- Spezifische Fragestellungen bei Klappenvitien (z.B. kontraktile Reserve mittels low-dose Dobutamin)
Limitationen
- Ungenügende Echoqualität
- Relevante Herzrhythmusstörungen, unkontrollierte art. Hypertonie
Kardiale Magnetresonanztomografie mit Belastung (Stress-MRI)
Technik
Die kardiale Magnetresonanztomografie eignet sich besonders zur Darstellung von Struktur und Funktion des Herzens und erlaubt nach intravenöser Kontrastmittelapplikation sowohl die Beurteilung der Koronarperfusion (Ruhe/Belastung mit Dobutamin/Regadenoson) als auch die Identifizierung und Quantifizierung von infarziertem Myokard.
Indikationen
- Identifikation des Ausmasses von infarziertem Myokard durch Anreicherung des Kontrastmittels Gadolinium in der Spätphase (Late Gadolinium Enhancement – LGE; Viabilitätsnachweis)
- Ischämiediagnostik: ab einer moderaten (> 15%) bis hohen (> 50%) Vortestwahrscheinlichkeit sinnvoll
- Vitalitätsdiagnostik vor allfälliger Intervention/Bypass-Operation
- Komplexe kongenitale Vitien
- Entzündliche oder metabolische Herzmuskelerkrankungen
- Tumore
- Darstellung von Klappenfunktion und -morphologie (Flussmessungen)
- Gefässdarstellung (z.B. vor Pulmonalvenenisolation)
- Perikarddiagnostik
Limitationen
- Herzschrittmacher- und ICD-Träger (abhängig vom Modell)
- Mechanische Herzklappen, die vor 1980 implantiert wurden
- Herzrhythmusstörungen (Triggerprobleme)
- Klaustrophobie, Hypervolämie (Atemmanöver)
Nuklearmedizinische Myokardperfusionsbildgebung: PET und SPECT
Technik
Die nuklearmedizinische Myokardperfusionsbildgebung erlaubt die Beurteilung der funktionellen Perfusion in Ruhe und unter Belastung und somit die Diagnose von Ischämien und Mykardnarben. Die Perfusionsdefekte werden semiquantitativ ausgewertet (gescored) und der Summed Difference Score (SDS) berechnet, was eine Risikostratifizierung erlaubt. Mit der Perfusions-PET (z.B. mit Rubidium-82) erfolgt zusätzlich eine Quantifizierung des myokardialen Blutflusses und der myokardialen Flussreserve (CFR), was zusätzlich eine Aussage über die Mikrozirkulation erlaubt (hinsichtlich einer mikrovaskulären Dysfunktion ANOCA/INOCA). Ergänzt wird die Untersuchung durch die Bestimmung der koronaren Kalklast (Agatston-Score), was eine weitere Risikostratifizierung erlaubt. Die Untersuchung wird als Hybridbildgebung mit einem CT durchgeführt, so dass anatomische/morphologische und funktionelle Bildgebung kombiniert werden. Das PET weist im Vergleich zum SPECT bei geringerer Strahlenbelastung eine höhere Sensitivität und Spezifität für den Nachweis einer myokardialen Ischämie auf.
Indikationen
- Ischämiediagnostik und -quantifizierung: ab einer moderaten (> 15%) bis hohen (> 50%) Vortestwahrscheinlichkeit sinnvoll
- Risikostratifizierung (z.B. präoperativ)
- Calcium-Scoring zur Bestimmung der koronaren Kalklast
Koronar-CT-Angiografie (Herz-CT)
Technik
Mit EKG-gesteuerter Zeitauflösung erreichen moderne Multislice-Computertomografen eine hohe örtliche Auflösung. Die Strahlenbelastung der Koronar-CT-Angiografie beträgt mit der modernen Technik ca. 0.5–5 mSv. Die Bestimmung der koronaren Kalklast erfolgt in einer nativen Niedrigdosis-CT von 0.2 mSv entsprechend dem Calcium-Score (Agatston-Score). Mit einmaliger Kontrastmittelgabe werden anschliessend der Koronarbaum und die intra-/extrakardiale Morphologie dargestellt sowie die linksventrikuläre Funktion berechnet. Die Untersuchungsdauer beträgt etwa 15 Min.
Indikation
- Ischämiediagnostik: effizientester Test, um eine stenosierende KHK bei tiefem (bis moderatem) Risiko auszuschliessen, Einsatz daher vor allem ab einer niedrigen (> 5%) bis moderaten (< 50%) Vortestwahrscheinlichkeit
- Zur Risikostratifizierung (Beurteilung der Koronarkalklast bzw. des Ca-Score)
- Bei einem selektionierten Patientengut (entsprechend Tab. 2)
- Präoperative Bildgebung der Koronarien vor valvulärer oder vitien-korrigierender Herzoperation
- Beurteilung von Bypässen (Patency)
- Beurteilung von Koronaranomalien
- Komplexe, angeborene Fehlbildungen
Nicht indiziert
- Bei Hochrisikopatientinnen und -patienten gemäss AGLA-Score und/oder hoher Vortestwahrscheinlichkeit gemäss Abb. 1
- Bei bestehenden komplexen Herzrhythmusstörungen
- Bei sehr hoher Kalklast im nativen CT ist eine CT-Angiographie aufgrund der niedrigen Aussagekraft nicht sinnvoll
Koronarangiografie
Die Koronarangiografie ist in der Diagnostik der Koronaren Herzkrankheit (KHK) der Gold-Standard. Eine invasive Abklärung ist bei hochgradigem V. a. KHK und unbekanntem Koronarstatus in den meisten Fällen sinnvoll (siehe auch Abb. 2: Diagnostik bei AP und V.a. KHK). Indikationen für eine Koronarangiografie bzw. PCI oder Bypass-Operation (falls Koronarstatus schon bekannt) können mit der Dienstärztin bzw. dem Dienstarzt Kardiologie und den interventionell tätigen Kaderärztinnen und -ärzten intern besprochen werden. Anmeldungen für elektive Untersuchungen von extern sind an die ärztliche Leitung der Klinik für Kardiologie zu richten.
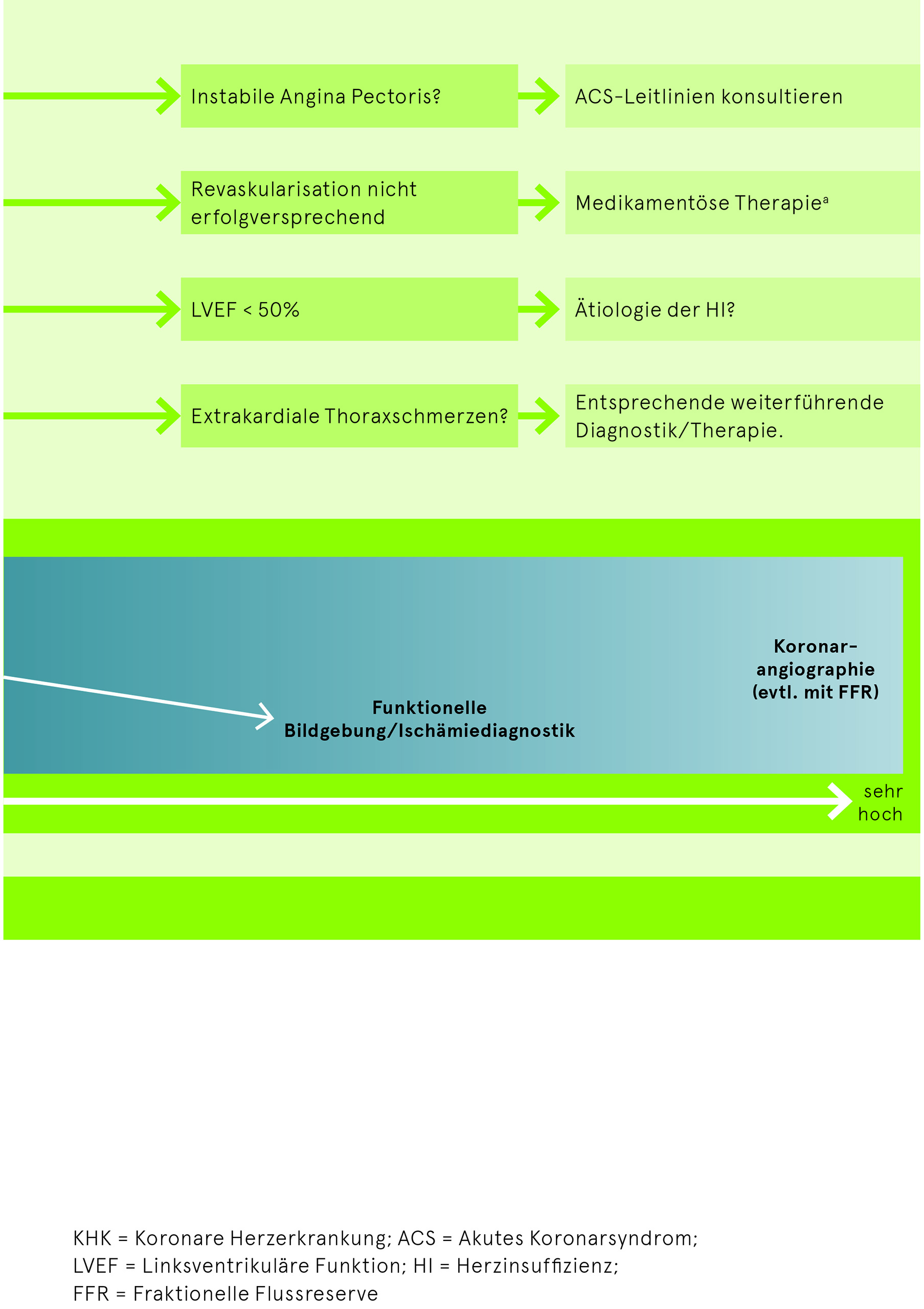
Direkter Einsatz der Koronarangiographie ab einer sehr hohen (> 85%) Vortestwahrscheinlichkeit/klinischen Wahrscheinlichkeit für eine KHK oder bei Hochrisikokonstellationen wie folgt:
- Instabile, rasch progrediente Symptomatik (inkl. Vorstellung im ACS, kardiogenem Schock)
- Eingeschränkte LVEF < 35% (mit regionalen Kinetikstörungen)
- Nachweis einer relevanten Ischämie in der Funktionsdiagnostik (> 10% Ischämie LV-Myokard, ≥3 von 16 Segmente mit belastungsinduzierter Hypo-/Akinesie im Stressecho und ≥ 2 von 16 im Stress-MRI)
- Nachweis einer ≥ 50% Hauptstammstenose, einer Dreigefässerkrankung mit ≥70% Stenose oder einer Zweigefässerkrankung inkl. ≥ 70% Stenose im Koronar-CT
Sonstige Indikationen:
- Vor herzchirurgischen Eingriffen (bei bekannter KHK/V.a. Ischämie/eingeschränkter LVEF/>1 kvRF oder bei Männer > 40j bzw. postmenopausalen Frauen)
- Frage nach mikrovaskulärer Dysfunktion (ANOCA/INOCA)
Therapie
Es werden zwei Ziele verfolgt:
- Verbesserung der Prognose durch Prävention von Myokardinfarkt, Herzinsuffizienz und Tod
- Reduktion der Symptome bzw. Verbesserung der Lebensqualität (auch bei mikrovaskulärer Dysfunktion ANOCA/INOCA)
Diese Ziele werden erreicht durch allgemeine nicht-medikamentöse Massnahmen, eine individualisierte medikamentöse Therapie sowie Revaskularisationseingriffe bei selektionierten Patientinnen und Patienten. Voraussetzungen für eine angemessene Therapie sind eine adäquate Diagnostik und Risikostratifizierung mittels nicht-invasiver Methoden und meist Koronarangiografie.
Die interventionelle (percutaneous coronary intervention; PCI) oder chirurgische (aortokoronarer Bypass) Revaskularisation stellt eine rein mechanische Therapie dar und benötigt ergänzend immer Lebensstilanpassungen (regelmässige körperliche Aktivität, Gewichtsreduktion, gesunde Ernährung, Nikotinabstinenz usw.) und eine medikamentöse, sekundärpräventive Behandlung. Revaskularisationseingriffe sind sehr effektiv zur Linderung der Symptomatik, haben aber nur in bestimmten Konstellationen einen prognostischen Effekt.
Eine Revaskularisation sollte bei Hinweisen auf eine mittelgrosse oder grosse myokardiale Ischämie (Revaskularisation aus prognostischen Gründen), bei fehlendem Ansprechen der Symptomatik auf eine medikamentöse antiischämische Therapie oder bei Symptomatik und entsprechendem Patientenwunsch (symptomatische Indikation) angeboten werden. Die Revaskularisation von visuell intermediären Stenosen sollte durch Nachweis einer entsprechenden Ischämie in der bildgebenden Funktionsdiagnostik oder durch Nachweis einer hämodynamischen Relevanz mittels Druckdrahtmessung (u.a. FFR/iFR/RFR/dPR) gesteuert erfolgen. Für komplexe Läsionen (Hauptstamminterventionen, lange und/oder verkalkte Läsionen) wird eine intravaskuläre Bildgebung empfohlen (IVUS oder OCT). In komplexen Fällen oder bei zusätzlich relevanten Klappenvitien erfolgt der Entscheid zur Modalität der Revaskularisation (PCI vs. CABG) im Heart Team d.h. gemeinsam mit der Herzchirurgie.
Medikamentöse Therapien, welche die Koronaratherosklerose beeinflussen
Die Angriffspunkte der medikamentösen Therapie betreffen:
- Koronaratherosklerose: Verhinderung einer Progression bzw. eine Regression der Plaquelast und eine Plaque-Stabilisierung
- «Umbauprozesse» des linken Ventrikels nach Infarkt (Remodeling): Verhinderung einer Progression einer linksventrikulären Dysfunktion und die Entwicklung einer Herzinsuffizienz
- Myokardiale Ischämie: Reduktion von ischämischen Symptomen
Substanzen, die auf Ebene der Koronaratherosklerose und des Remodelings wirken und somit die Biologie des Krankheitsprozesses direkt beeinflussen, haben in der Regel einen prognostischen Nutzen, während dies für die antiischämisch wirksamen Medikamente nicht gilt (Ausnahme: Betablocker nach Infarkt sowohl mit antiischämischer als auch Anti-Remodeling-Wirkung).
Thrombozytenaggregationshemmer und orale Antikoagulation
- Aspirin 100 mg/Tag (oder Clopidogrel 75 mg/Tag als gleichwertige Alternative) für alle Patientinnen und Patienten mit KHK, bei Aspirin-Allergie Desensibilisierung in Erwägung ziehen
- Nach PCI zusätzlich Clopidogrel 75 mg/Tag (oder Aspirin 100mg/Tag als Alternative) für 6 Monate bei Drug Eluting Stents (DES) bzw. für 1 Monat bei Drug Coated Balloons (DCB) – Dauer in bestimmten Fällen weniger lang, muss in jedem Fall vom Interventionalisten genau festgelegt sein – und eventuell nach aortokoronarer Bypass-Operation.
- Bei erhöhtem gastrointestinalem Blutungsrisiko Einsatz eines PPI, in erster Linie Pantoprazol (20 mg/d sind zur Prävention ausreichend) empfohlen
- Bei hohem Ischämierisiko (und tiefem/vertretbarem Blutungsrisiko) alternativ duale Thrombozytenaggregationshemmung (DAPT) mit Aspirin 100 mg/Tag und Prasugrel 10 mg/Tag oder Ticagrelor 2×90 mg/Tag
- Evaluation einer Weiterführung mit Ticagrelor 2× 60 mg/Tag bzw. Rivaroxaban 2.5 mg/2x tgl zusätzlich zu ASS nach 12 Monaten DAPT: bei hohem Ischämierisiko unter Abwägung von Ischämie- und Blutungsrisiko (PRECISE-DAPT Score)
- Orale Antikoagulation (OAK): bei Indikation für eine OAK (Vorhofflimmern, mechanische Klappenprothese, St. n. Lungenembolie u.a.), Festlegung der weiteren Therapieregimes in Abwägung Ischämie/Blutungsrisiko (siehe Kapitel ACS Seite), grundsätzlich ist eine Triple Therapie (orale Antikoagulation kombiniert mit Aspirin und Clopidogrel) > 7 Tage nur in Ausnahmefällen indiziert
- Direkte orale Antikoagulantien (DOAKs) sind vor Vitamin K-Antagonisten zu bevorzugen
Lipid-modifizierende Therapie
- Grundsätzlich immer bei KHK, auch bei Cholesterinwerten im Ziel-Bereich (→ tiefe Dosis eines gut verträglichen Präparats)
- Primär Statine mit Ziel-LDL-Cholesterin < 1.4 mmol/l bzw. Halbierung des Ausgangswertes
- Zusätzlich Ezetimibe 10 mg möglich, senkt das LDL-Cholesterin zusätzlich und bringt zusätzlichen prognostischen Nutzen
- Bempedoinsäure, PCSK9-Hemmer oder Inclisiran in ausgewählten Situationen → Siehe «Hyperlipidämien – Medikamentöse Therapie» Seite
SGLT2-Hemmer/GLP-1-Rezeptor Agonisten
- Bei Diabetes zusätzlich SGLT2-Hemmer und/oder GLP-1-Rezeptor Agonisten → Siehe «Diabetes» Seite
- Bei KHK ohne Diabetes aber mit Übergewicht (BMI > 27 kg/m2) ebenfalls Einsatz eines GLP-1-Rezeptor Agonisten erwägen
Substanzen, die das linksventrikuläre Remodeling beeinflussen
- Nach durchgemachtem Herzinfarkt und eingeschränkter linksventrikulärer Auswurffraktion (left ventricular ejection fraction; LVEF < 40%): Betablocker und ACE-Hemmer; bei ACE-Hemmer Unverträglichkeit: Angiotensin-Rezeptor-Blocker (ARB). Als Alternative zu ACE-Hemmer/ARB insbesondere bei schwerer Herzinsuffizienz: Sacubitril/Valsartan (Cave: ACE-Hemmer und ARB bis auf Valsartan 36 Stunden Stop vor Beginn mit Sacubitril/Valsartan).
- ACE-Hemmer auch ohne früheren Infarkt, falls nicht low risk (siehe Tab. 3), insbesondere bei arterieller Hypertonie, aber nur lipophile ACE-Hemmer (Perindopril, Ramipril), da nur bei diesen Substanzen primär ein Effekt auf die Atherosklerose vermutet wird.
- Zusätzlich Spironolacton oder Eplerenon 3–14 Tage nach Myokardinfarkt bei LVEF < 40% und guter Background-Therapie (ACE-Hemmer und Betablocker); später nach Infarkt: LVEF < 35% und NYHA II → Eplerenon, LVEF < 35% und NYHA ≥ III → Spironolacton (für weitere Details → Siehe Kapitel «Herzinsuffizienz» Seite)
- Zusätzlich SGLT2-Hemmer bei einer LVEF < 40% (Dapagliflozin oder Empagliflozin) oder bei symptomatischer HFpEF
Medikamente mit günstigem Einfluss auf das LV-Remodelling
| Medikament und Dosis | Indikation | Kommentar |
ACE-Hemmer
|
|
|
ARB
|
Alternative zu ACE-Hemmer bei ACE-Hemmer-Intoleranz |
|
| Sacubitril/Valsartan: 50-200mg 2x täglich |
Alternative zu ACE-Hemmer/ARB bei schwerer HFrEF |
|
| Eplerenon: 25–50 mg | Früh (3-14 Tage) nach Myokardinfarkt und bei Vorliegen all der folgenden Bedingungen:
|
|
| Spironolacton: 25-50mg | Wie Eplerenon |
|
Betablocker
|
|
|
SGLT2-Inhibitoren
|
|
|
Antiischämische Therapie
Prinzip
Das Auftreten einer myokardialen Ischämie hängt von der Balance zwischen Sauerstoffzufuhr und -bedarf ab. Im Falle einer signifikanten Stenose ist die Zufuhr bzw. die Zufuhrreserve reduziert, sodass es bei einem Anstieg des Bedarfs im Rahmen körperlicher Belastung zu einer Ischämie kommt. Folgende Faktoren bestimmen den Sauerstoffbedarf des linken Ventrikels:
- Kontraktilität
- Herzfrequenz
- Wandspannung
Grundsätze der Behandlung
- Individualisierte Therapie
- Verschiedene Kombinationen möglich; Auswahl gemäss Wirkung und Nebenwirkungsprofil (siehe Tab. 4)
- Die primäre sinnvolle Basistherapie besteht meistens aus Betablocker und/oder Kalziumkanalblocker, wobei sich die Auswahl des Kalziumkanalblockers nach der Herzfrequenz richtet.
- Die Dosierung der einzelnen antianginösen Substanz sollte vor Ergänzung durch ein zweites Medikament zuerst nach oben titriert werden.
- Persistierende Beschwerden trotz antianginöser Zweiertherapie können in der Regel durch den Zusatz einer dritten antianginösen Substanz nur noch wenig beeinflusst werden. Diese Patientinnen und Patienten profitieren in der Regel von einer kathetertechnischen oder chirurgischen Revaskularisation, falls eine solche möglich ist.
Antiischämische Medikamente
| Medikament und Dosis | Indikation | Kommentar |
Betablocker
|
Auch bei mikrovaskulärer Dysfunktion |
|
Kalziumkanalblocker
|
|
|
Kurz wirksame Nitrate
Lang wirksame Nitrate
|
Behandlung des akuten Anfalls
Dauertherapie, Kombination mit anderen Antianginosa |
|
| Molsidomin: Retardierte Form, 2–3× 4 mg bis 2× 8 mg |
|
|
| Ranolazin: 2× 375–750 mg |
Add-on-Therapie zu Betablocker (Cave: Sotalol wegen Interaktion), Amlodipin (Cave: Diltiazem, Verapamil wegen Interaktion), Nitraten |
|
| Nicorandil: 2× 10–20 mg |
Als mögliche Add-on-Therapie erwägen, kann mit Nitraten und Molsidomin kombiniert werden |
|
Device-Therapie der therapierefraktären Angina bei fehlenden Revaskularisationsoptionen
Bei refraktärer Angina und manifester stenosierender KHK ohne Revaskularisationsoptionen kann die Implantation eines Koronarsinus-Reducers zur Linderung der Symptomatik erwogen werden.
ANOCA/INOCA
Bei refraktärer Angina ohne stenosierende KHK wird eine Funktionsdiagnostik hinsichtlich einer mikrovaskulären Dysfunktion (ANOCA/INOCA) inkl. verschiedener Subtypen empfohlen, da eine relevante Anzahl der von Angina pectoris Betroffenen angiographisch keine stenosierende KHK aufweisen (ANOCA, Angina with Non-Obstructive Coronary Arteries). In dieser Population liess sich in Studien je nach verwendetem Stresstest bei 10-30% eine Ischämie nachweisen (INOCA, Ischemia with Non-Obstructive Coronary Arteries). ANOCA/INOCA betrifft Frauen häufiger als Männer. Oft besteht bei therapierefraktärer Symptomatik ein sehr hoher Leidensdruck, vergesellschaftet mit einer entsprechend schlechten Lebensqualität und mit vermehrt auftretenden kardiovaskulären Ereignissen.
Bei ANOCA/INOCA lassen sich auf folgende Pathomechanismen/Endotypen unterteilen:
- Endotheliale Dysfunktion
- Gestörte Vasodilatation (verminderte koronare Flussreserve invasiv CFR < 2.0 und/oder hoher mikrovaskulärer Widerstand invasiv IMR > 25)
- Epikardiale oder mikrovaskuläre vasospastische Angina
Diagnostik
Bei entsprechender Symptomatik sollte initial stets eine stenosierende KHK gesucht werden (Koro-CT, bildgebende Ischämiediagnostik).
Hinweise auf eine ANOCA/ INOCA können auch nicht-invasiv gewonnen werden (koronare Flussreserve CFR mittels Herz-PET messbar). Eine genauere Klassifizierung auf die oben genannten Endotypen gelingt jedoch nur invasiv.
Bei klinischem Verdacht auf eine ANOCA/INOCA kann zunächst ein Therapieversuch gemäss den unter Therapie aufgeführten Prinzipien eingeleitet werden. Bei anhaltenden Beschwerden und/oder hohem Leidensdruck empfiehlt sich jedoch eine invasive Testung:
- Testung einer mikrovaskulären Dysfunktion durch Druckdrahtmessung in Ruhe und unter Belastung (meist mit Regadenoson i.v.) durch Bestimmung von fractional flow reserve (FFR), koronarer Flussreserve (CFR), Index des mikrozirkulären Widerstands (IMR)
- Testung der Vasoreaktivität mit Acetylcholin intrakoronar in ausgewählten Situationen
Therapie
- Lifestyle-Modifikation: Ernährung, Sport, Stressmanagement usw.
- Optimierung der kardiovaskulären Risikofaktoren: Nikotinverzicht, Optimierung Blutdruck/Cholesterin/Blutzucker/Gewicht
- Medikamentöse Therapie abhängig vom Endotyp:
- Endotheliale Dysfunktion und Atherosklerose: Statine, ACE-Hemmer
- Gestörte Vasodilatation (Mikrovaskulär): Betablocker, Kalziumkanalblocker, Ranolazin, Trimetazidin, Ivabradin
- Gestörte Vasokonstriktion (Mikrovaskulär und Epikardial): Kalziumkanalblocker, Nitrate; nur Epikardial: Nicorandil
Quellen/Links
- www.agla.ch
- Vrints C et al. 2024 ESC Guidelines for the management of chronic coronary syndromes. European Heart Journal, Volume 45, Issue 36, 21 September 2024, Pages 3415–3537. https://doi.org/10.1093/eurheartj/ehae177
- Vahanian A et al. 2021 ESC Guidelines for the management of valvular heart disease: Developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS), European Heart Journal, Volume 43, Issue 7, 14 February 2022, Pages 561–632. https://doi.org/10.1093/eurheartj/ehab395
- Knuuti J et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41 (3):407–477. https://doi.org/10.1093/eurheartj/ehz425
Dr. Johannes Rigger
Dr. Marco Cederqvist
Prof. Dr. Dr. Flavio Forrer
Dr. Olaf Chan-Hi Kim
Prof. Dr. Sebastian Leschka
Prof. Dr. Micha Maeder