Herzinsuffizienz
Klassifikationen der Herzinsuffizienz
- Stadien A–D: sind klinisch von beschränkter Relevanz. A: mit Herzinsuffizienz assoziierte Risikofaktoren (z.B. Diabetes, Hypertonie). B: strukturelle Herzkrankheit ohne Symptome (z.B. asymptomatische linksventrikuläre systolische Dysfunktion nach Infarkt). C: strukturelle Herzkrankheit mit Symptomen (eigentliche Herzinsuffizienz). D: therapierefraktäres Stadium
- Akut vs. chronisch: Unterscheidung ist wichtig aufgrund des therapeutischen Ansatzes in der Akutphase. Die meisten Patienten mit akuter Herzinsuffizienz haben aber eine akute Dekompensation einer chronischen Herzinsuffizienz, deren Mechanismus die langfristige Therapie determiniert.
- Herzinsuffizienz mit eingeschränkter vs. erhaltener Auswurffraktion: ist aus therapeutischen Gründen essenziell. Dazwischen gibt es die intermediäre Klasse der Herzinsuffizienz mit leicht eingeschränkter («mildy reduced») Auswurffraktion.
Klassifikation der Herzinsuffizienz (heart failure, HF) nach linksventrikulärer Auswurffraktion (left ventricular ejection fraction, LVEF)
| HF with reduced LVEF (HFrEF) | HF with mildly reduced LVEF (HFmrEF) | HF with preserved LVEF (HFpEF) | |
| LVEF ≤ 40% | LVEF 41–49% | LVEF ≥ 50% | |
| Demografie | jünger | intermediär | älter |
| Ätiologie | v.a. Koronare Herzkrankheit (grosser Infarkt), Kardiomyopathien | Koronare Herzkrankheit (kleinerer Infarkt) und andere | v.a. hypertensive Herzkrankheit |
| Mechanismus | Primär systolische LV-Dysfunktion | Variabel | Primär diastolische LV-Dysfunktion |
| Diagnose | Symptome ± klinische Zeichen plus Echokardiografie: LVEF < 40% ausreichend | Symptome ± klinische Zeichen plus Echokardiografie: LVEF 41-49% | Symptome ± klinische Zeichen plus Echokardiografie: LVEF ≥ 50% + zusätzliche Parameter + erhöhtes BNP/NT-proBNP |
| Therapie | Gut definiert, verbessert Prognose (Ueberleben) | Weitgehend wie HFrEF | Weiterhin schlecht definiert; keine Therapie, die das Überleben verlängert (SGLT2-Hemmer reduzieren das Risiko einer Hospitalisation wegen Herzinsuffizienz) |
| BNP/NT-proBNP erhöht, ohne dass eine primäre Linksherzinsuffizienz vorliegt (BNP/NT-proBNP kann kardialen «Stress» durch extrakardiale Erkrankungen reflektieren) |
|
Generelle Diagnostik der Herzinsuffizienz
Diagnose der Herzinsuffizienz beruht auf folgenden Kriterien:
- Typische Symptome (Dyspnoe unter Belastung oder in Ruhe, Leistungsintoleranz, Orthopnoe, paroxysmale nächtliche Dyspnoe, Ödeme)
- Fakultativ (im chronischen Zustand nicht immer vorhanden): klinische Zeichen, die entweder die Stauung (3. Herzton, pulmonale Rasselgeräusche, Halsvenenstauung, Ödeme) oder das verminderte Herzminutenvolumen (kühle Extremitäten) reflektieren
- Obligat objektiver Nachweis einer kardialen Dysfunktion (z.B. linksventrikuläre Dysfunktion, Klappenvitium), was obligat mittels Echokardiografie erfolgt
Das klinische Ansprechen auf eine Therapie unterstützt die Diagnose, ist aber allein nicht ausreichend für die Diagnose.

Der Algorithmus in Abb. 1 (gemäss 2021 ESC Leitlinien Herzinsuffizienz) gilt grundsätzlich für das akute wie das nicht-akute bzw. chronische Setting. Die hier dargestellte Version gilt für Patienten mit chronischen Symptomen. Die Unterscheidung ist wichtig, da unterschiedliche Cut-offs für B-type natriuretic peptide (BNP) und N-terminal-proBNP (NT-proBNP) zum Ausschluss einer Herzinsuffizienz gelten. Im akuten Setting betragen die Cut-offs für BNP und NT-proBNP 100 bzw. 300 ng/l. Zu beachten ist im Weiteren, dass BNP und NT-proBNP unspezifische, quantitative Marker eines kardialen (vor allem linksventrikulären) Stresses sind und keine Aussage über den Mechanismus machen können. Eine Echokardiografie ist daher zur Diagnosesicherung und zur Darstellung des Mechanismus der Herzinsuffizienz immer notwendig.
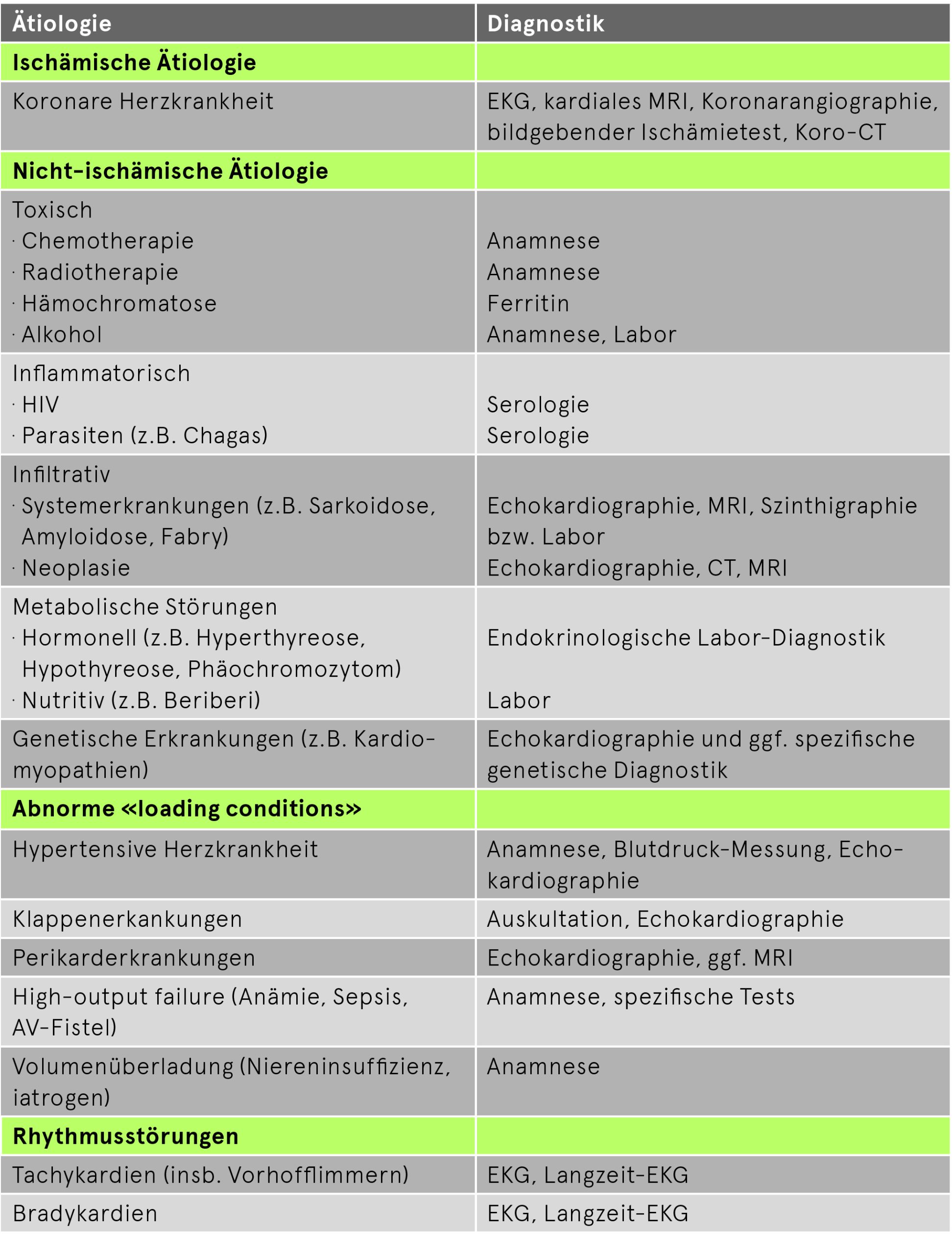
Ätiologie-Suche
Nach der Diagnosestellung einer Herzinsuffizienz ist es essentiell sowohl primär kardiale als auch primär nicht-kardiale Ursachen zu suchen und diese wenn möglich zu therapieren. Tab. 3 fasst die wichtigsten Ursachen und deren Abklärungen zusammen.
Akute Herzinsuffizienz
- Meist akute Dekompensation eines chronischen Prozesses
- Dekompensation einer chronischen Herzinsuffizienz mit eingeschränkter Auswurffraktion aufgrund eines Triggers (siehe «Ursachen/Trigger für akute Dekompensation» Seite)
- Dekompensation bei Herzinsuffizienz mit erhaltener Auswurffraktion, i. d. R. infolge hypertensiver Entgleisung und/oder Volumenüberladung («akute kardiovaskuläre Insuffizienz»)
- Seltener akuter Prozess (Myokardinfarkt, Rhythmusstörung, Myokarditis, akute Klappeninsuffizienz usw.)
Diagnose
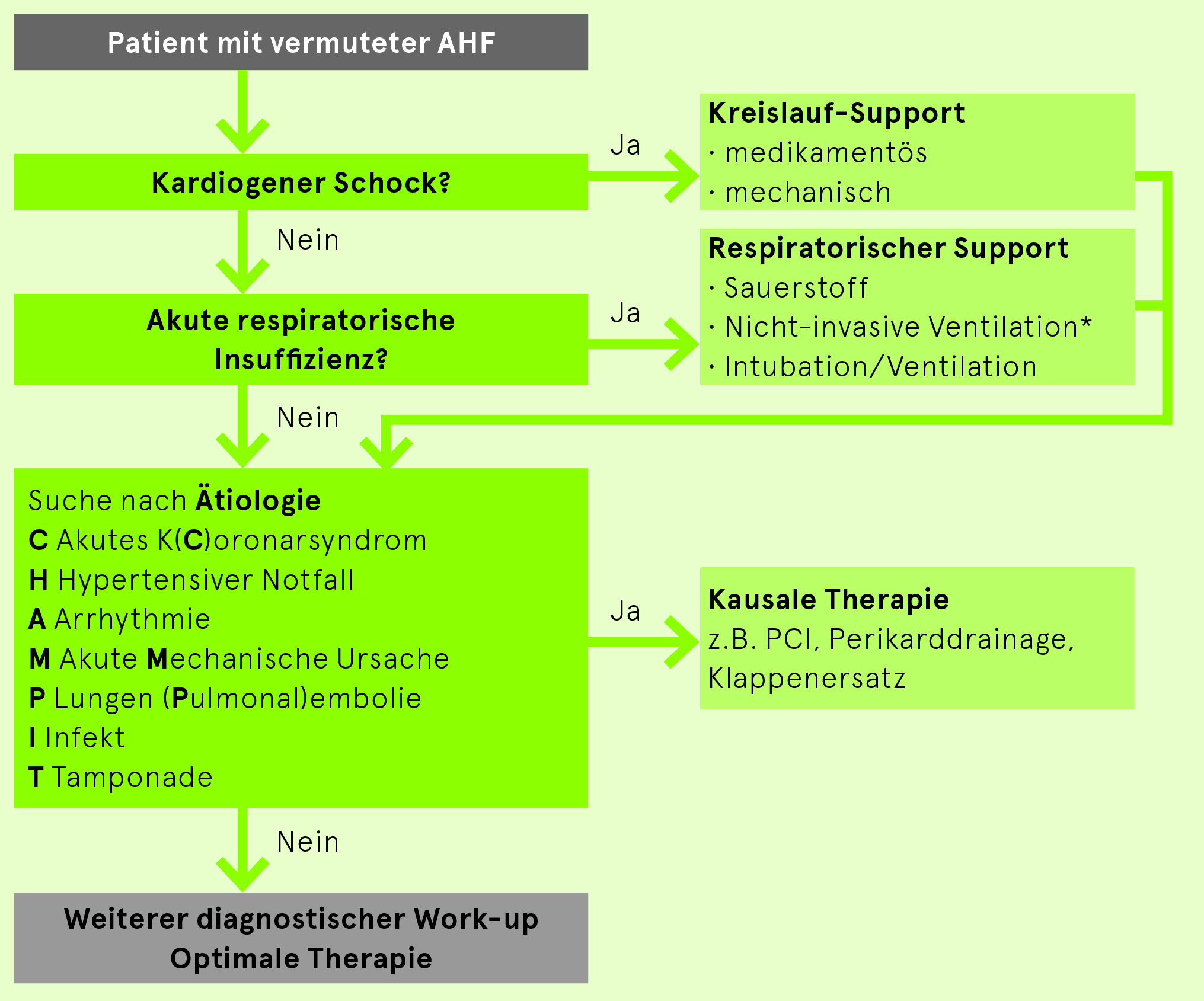
Akute Herzinsuffizienz (acute heart failure, AHF) = potenziell lebensbedrohlicher Zustand, der ein schnelles und systematisches Vorgehen erfordert. Diagnostischer und therapeutischer Ansatz gemäss Abb. 2. Die Idee dieses Ansatzes ist es, differentialdiagnostisch vorzugehen und lebensrettende Massnahmen parallel sofort einzuleiten.
Kardiogener Schock = Hypotonie (systolischer Blutdruck < 90 mmHg) plus Zeichen der Hypoperfusion (klinisch: kalte Extremitäten, Oligurie, abnormer mentaler Zustand; laborchemisch: erhöhtes Laktat, metabolische Azidose, erhöhtes Kreatinin bzw. Transaminasen) trotz adäquater Füllung. Diese Zeichen des Schocks können auch bei normo- bis hypertonen Patienten auftreten (HFpEF); sie sind oft kombiniert mit einem kardialen Lungenödem. Die grosse Mehrheit der Patienten mit akuter Herzinsuffizienz ist aber normotensiv oder sogar hypertensiv.
Für alle Patienten mit vermuteter akuter Herzinsuffizienz empfohlene Tests:
- BNP oder NT-proBNP: Ausschluss Herzinsuffizienz bei Werten < 100 ng/l bzw. 300 ng/l (vgl. oben) bzw. Quantifizierung des «kardialen Stress» (prognostische Aussage).
- 12-Ableitungs-EKG: ein völlig normales EKG macht eine akute Herzinsuffizienz unwahrscheinlich. Das EKG kann andererseits Hinweise auf den Mechanismus der Herzinsuffizienz geben (akuter Infarkt, Bradykardie, Tachykardie)
- Thorax-Röntgen-Bild: Hinweise auf eine pulmonalvenöse Hypertonie einerseits und Suche nach Differentialdiagnosen andererseits
- Lungensonografie: B-Lines als Stauungszeichen
- Laborparameter zur Suche nach Mechanismen/Co-Faktoren (Hämoglobin, TSH, CRP) und Effekten (Kreatinin, Transaminasen) der akuten Herzinsuffizienz. Dazu gehört auch das kardiale Troponin, welches als quantitativer unspezifischer Marker der myokardialen Schädigung und nicht immer als Ausdruck eines akuten Infarkts betrachtet werden muss.
- Echokardiografie: für alle Patienten innert 48 Std., wenn die kardiale Pathologie nicht oder nicht ausreichend bekannt ist. Patienten im kardiogenen Schock benötigen sofort eine Echokardiografie oder einen fokussierten Herzultraschall durch einen diesbezüglich erfahrenen Notfallmediziner/Intensivmediziner unter anderem mit der Frage nach mechanischen, akut zu behandelnden Problemen (mechanische Infarktkomplikationen, Perikardtamponade, akutes Klappenvitium).
Ursachen/Trigger für akute Dekompensation
- Myokardiale Ischämie/Infarkt
- Inadäquate Therapie/Malcompliance
- Begleitmedikation (NSAR inkl. COX-2-Inhibitoren, Steroide, trizyklische Antidepressiva, Lithium, Kalziumkanalblocker)
- Niereninsuffizienz
- Inadäquate Wasser-/Salzzufuhr
- Arrhythmien (v.a. tachykardes Vorhofflimmern)
- Progression eines Klappenvitiums
- Infektion
- Lungenembolie
- Hyperthyreose, Anämie
- Toxine, kardiodepressive Substanzen
*Bei Patienten mit akuter respiratorischer Insuffizienz im Rahmen eines akuten Koronarsyndroms: keine nicht-invasive Ventilation, sondern Intubation.
Therapie
Kausale Therapie, wenn immer möglich und so früh als möglich (vgl. Abb. 2 ESC Leitlinien 2021), ansonsten/zusätzlich allgemeine supportive Therapie gemäss dem klinischen und hämodynamischen Profil. Diese Therapie ist im Wesentlichen empirisch (prognostischer Effekt dieser Massnahmen nicht bewiesen). Ziel ist eine rasche Verbesserung der Symptomatik und eine klinische Stabilisierung, sodass die Therapie der chronischen Herzinsuffizienz etabliert werden kann. Da die optimale Therapiestrategie bei akuter Herzinsuffizienz unbekannt ist, ist es wichtig, dass trotz Notfallsituation möglichst viele Patienten in entsprechende Studien eingeschlossen werden. Je nach Schweregrad erfolgt die Behandlung auf Notfallstation/Normalstation oder Notfallstation/MIPS, ggf. mit invasivem Monitoring. Mit den 2021 Leitlinien wurde die frühere Kategorisierung gemäss «wet/dry» and «warm/ cold» verlassen. Neu werden grundsätzlich vier klinische Syndrome unterschieden. Die Therapie wird hier nur prinzipiell besprochen, ist individualisiert und bei kranken Patienten auf der Intensivstation komplex und kann hier nicht detailliert abgebildet werden.
- Akut dekompensierte Herzinsuffzienz: Volumenakkumulation, Entwicklung oft über Tage, meist normoton. Therapie mit Diuretika und Optimierung der Therapie der chronischen Herzinsuffizienz, selten Inotropika, mechanischer Support.
- Akutes Lungenödem: In der Regel «Volumenumverteilung», schnelle Entwicklung, typischerweise bei hohem Afterload (Hypertonie, Aortenklappenstenose) und diastolischer LV-Dysfunktion, typischer Trigger: Vorhofflimmern. Therapie: Diuretika (kurzfristig), nicht-invasive Ventilation, wenn nötig Intubation, Vasodilatatoren, Rhythmusmanagement.
- Isolierte Rechtsherzinsuffizienz: relativ selten. Entweder primäre rechtsventrikuläre Dysfunktion (Kardiomyopathie, RV-Infarkt) oder gestörtes «rechtsventrikuläres-pulmonales Coupling», typischerweise bei prä-kapillärer pulmonaler Hypertonie; Therapie in Abhängigkeit vom Grundproblem sehr variabel.
- Kardiogener Schock: schwere LV-Dysfunktion mit reduziertem Cardiac Output, Hypotonie und Gewebehypoperfusion; Therapie mit Inotropika, mechanischem Support, ggf. nicht-invasive/invasive Ventilation
Allgemeine Massnahmen
- Ruhigstellung/Sitzbett («Herzbett» im Notfallzentrum)
- Sauerstoff, falls Hypoxämie (SpO2 < 90%)
Medikamentöse Therapie
- Bei Schmerzen → Morphin titriert bis 0.05-0.1 mg/kg Körpergewicht (nicht als routinemässige Therapie der akuten Herzinsuffizienz, nur bei Schmerzen)
- Bei Agitation → Lorazepam 1 mg sublingual oder iv
Nitrate
- Der Effekt von Nitraten in der akuten Herzinsuffizienz ist nicht bewiesen. Allerdings ist eine Nitrat-Therapie bei Patienten mit normalem oder erhöhtem Blutdruck (BD systolisch >110mmHg) zu empfehlen. Spray: 2 Hübe à 0.4 mg, 1 Kapsel à 0.8 mg, kann nach 5–10 Min. wiederholt werden, ggf. mehrfach, dabei Blutdruckkontrolle; ggf. iv-Verabreichung, später Nitropflaster.
- Cave: Toleranzentwicklung
- Ggf. Nitroprussid (MIPS)
Schleifendiuretika
Die aktuellen Leitlinien empfehlen das Diuretikum als primäres Medikament der Behandlung der akuten Herzinsuff. mit Volumenüberladung.
- Bei hyper- oder normotensiven Patienten allenfalls primäre Nitrat-Therapie (siehe oben)
- Furosemid (Lasix) bei Schleifendiuretikum-naiven Patienten als intravenöser Bolus von 20–40 mg (in den ersten 6 Std. Totaldosis < 100 mg), ansonsten ein- bis zweifache zuletzt eingenommene orale Dosis als iv Bolus. Danach kurzfristige Reevaluation des Therapieansprechens (Urinmenge >100-150 ml/h) und je nach Schweregrad resp. Ansprechen Dosis wiederholen oder Dosissteigerung , je nach Verlauf Umstellung auf orale Therapie
- Die bolusweise Verabreichung (2–3×/Tag) und die kontinuierliche Infusion sind gleichwertig.
Inotropika/Vasopressoren (gem. Notfall-/Intensivmediziner)
- Bei ungenügender Gewebeperfusion trotz adäquatem Füllungszustand
- Manchmal unverzichtbar, generell aber sehr zurückhaltender Einsatz (erhöhtes Arrhythmie-Risiko, Provokation von Ischämie), ggf. Levosimendan anstelle von Inotropika (MIPS).
Betablocker
- Im Akutstadium nur in Ausnahmefällen indiziert (z.B. intraventrikuläre dynamische Obstruktion)
- Cave: Gabe eines Betablockers zur Kontrolle der Herzfrequenz (v.a. iv) ohne Kenntnis der LV-Funktion kann kardiogenen Schock präzipitieren
- Vorbestehende Betablocker-Therapie, wenn immer möglich nicht vollständig absetzen, evtl. temporäre Dosisreduktion
Kardioversion/Antiarrhythmika (siehe spezifische Kapitel)
- Elektrische Kardioversion bei Patienten mit atrialen oder ventrikulären Rhythmusstörungen, die als ursächlich für die akute Herzinsuffizienz angesehen werden
- Antiarrhythmika: neben Betablocker nur Amiodaron (Cordarone)
- Klasse-IB/C-Antiarrhythmika bei LV-Dysfunktion kontraindiziert
Antikoagulation/Thrombozytenaggregationshemmung
- Akutes Koronarsyndrom: gemäss Standard (siehe Kapitel «Akutes Koronarsyndrom» Seite)
- Vorhofflimmern/-flattern: orale Antikoagulation, Heparin (siehe Kapitel «Vorhofflimmern» Seite)
Mechanische Therapieoptionen
- Koronarangiografie/PCI: bei vermuteter ursächlicher grosser myokardialer Ischämie
- Notfallmässige ACBP-Operation (selten)
- Notfallmässige Operation von mechanischen Infarktkomplikationen (Papillarmuskelruptur, Ventrikelseptumdefekt, Ruptur der freien Wand)
- Notfallmässige Operation bei Endokarditis-Komplikationen
- IABP (kontraindiziert bei Aortendissektion, signifikanter Aorteninsuffizienz): kommt typischerweise im Herzkatheterlabor vor/nach PCI bei selektionierten Patienten zum Einsatz
- Perkutanes linksventrikuläres Assist Device (LVAD): Impella, kommt typischerweise im Herzkatheterlabor vor/nach PCI bei selektionierten Patienten zum Einsatz
- VA-ECMO: für Patienten im kardiogenen Schock, auch nach Reanimation mit relativ kurzer «no-flow-time». Indikationsstellung primär durch MIPS-Team, frühzeitige Diskussion der Indikation anstreben (vgl. «Indikationen für ECMO» Seite)
- Chirurgisches linksventrikuläres Assist Device: Diskussion mit Herzchirurgie
Chronische Herzinsuffizienz mit eingeschränkter Pumpfunktion (HFrEF)
Diagnose
- Diagnose-Prinzip und -Algorithmus sowie Abklärung der Ursache siehe «Generelle Diagnostik der Herzinsuffizienz» Seite.
- Echokardiografie ist das primäre Imaging-Tool; kardiales MRI bei Erstdiagnostik oft auch sinnvoll (ätiologische Abklärung Kardiomyopathie, Bestimmung Viabilität bei chronischer KHK)
- Koronarangiografie: nicht zwingend indiziert bei jeder neu diagnostizierten Herzinsuffizienz; bei unklarer Ätiologie im Verlauf (nicht akut) aber meist sinnvoll. Alternativ bei tiefem kardiovaskulären Risiko Koronar-CT zum Ausschluss einer relevanten KHK.
Nicht-medikamentöse Massnahmen (nach Möglichkeit Schulung durch heart failure nurses)
- Allgemeine Massnahmen (Aufklärung von Patient und Angehörigen, Arzneimittelberatung, Diät, Bewegung und soziale Gewohnheiten)[1]
- Gewichtsnormalisierung
- Begrenzte Kochsalzzufuhr
- Höchstens begrenzter Alkoholkonsum (Mann max. 30 g/Tag; Frau max. 20 g/Tag); bei alkoholtoxischer Kardiomyopathie Alkoholkarenz
- Kardiale Rehabilitation
- Regelmässige körperliche Bewegung bei stabiler Herzinsuffizienz
Suche nach optimierbaren kardialen Komorbiditäten/Ursachen und deren Therapie
Zusätzliche kardiale Diagnosen können sowohl die Ursache als auch Co-Faktoren der Herzinsuffizienz sein. Diese müssen gesucht und entsprechend den geltenden Therapierichtlinien behandelt werden (Tab. 3 Seite). Insbesondere gilt dies für Vorhofflimmern, koronare Herzkrankheit und relevante Klappenvitien (sek. Mitralinsuffizienz bei HFrEF s. unten).
Suche nach optimierbaren nicht-kardialen Komorbiditäten/Ursachen und deren Therapie
Nicht-kardiovaskulär: Anämie, Eisenmangel, Lungenerkrankung, renale Dysfunktion, Schilddrüsen-Dysfunktion (Siehe auch Tab. 3 Seite)
Eisenmangel
Intravenöses Eisen (Fe-Carboxymaltose) ist eine Option zur Verbesserung der Symptomatik bei Patienten LVEF < 45%, NYHA II/III, Hb < 15g und Eisenmangel (Ferritin < 100 μg/l oder Ferritin 100–300 μg/l und Transferrin-Sättigung < 20%). Alle hospitalisierten Patienten mit akut dekompensierter Herzinsuffizienz sollten bei einer LVEF < 50% und einem Eisenmangel mit obigen Kriterien zur Verhinderung weiterer Herzinsuffizienz-Hospitalisationen mit Fe-Carboxymaltose behandelt werden.
Medikamentöse Therapie der HFrEF
Die Therapie der chronischen HFrEF besteht neu aus vier Basis-Medikamenten, die bei allen HFrEF-Patienten (LVEF ≤ 40% und NYHA ≥ II) etabliert werden sollen (Klasse I-Indikationen): ACE-I/ARNI, Betablocker, SGLT2-I, MRA. Diese sollen zunächst möglichst rasch in niedriger Dosis parallel etabliert und dann erst auftitriert werden. Der traditionelle sequentielle Einsatz bleibt möglich, wird aber von Experten nicht empfohlen. Danach müssen die Indikationen für einen ICD und/oder CRT geprüft und auch weitere von zusätzlichen Patientenfaktoren abhängige individualisierte Therapieoptionen angewendet werden. Anschliessend bestehen noch spezialisierte Optionen für therapierefraktäre Situationen.
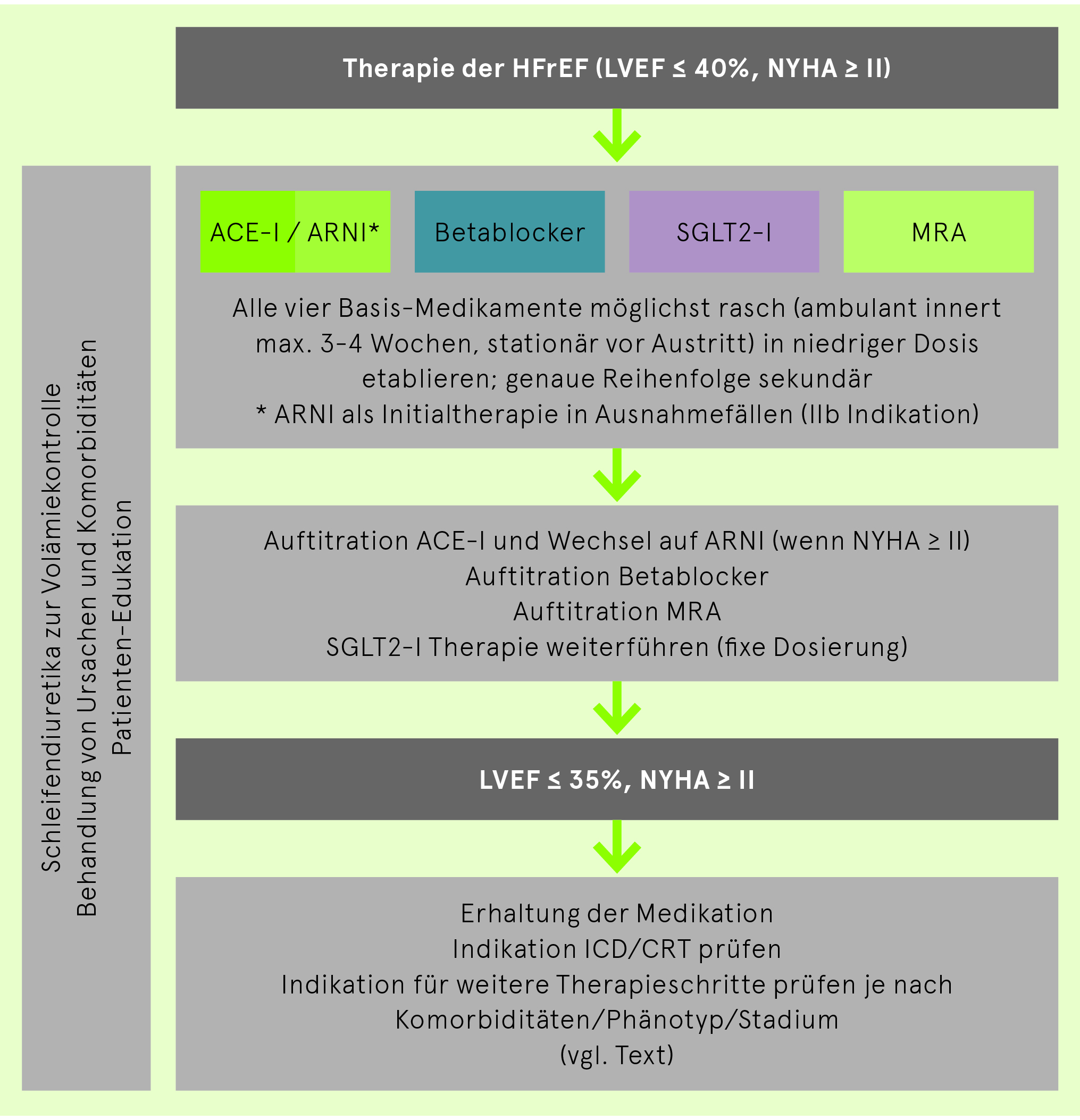
Therapie der HFrEF adaptiert nach ESC Leitlinien Herzinsuffizienz 2021
ACE-I: ACE-Inhibitor, ARNI: Angiotensin-Rezeptor-Neprilysin-Inhibitor, MRA: Mineralokortikoid-Rezeptor-Antagonist, SGLT2-I: Sodium-Glukose Kotransporter-2 Inhibitor
Diuretika
Primär Schleifendiuretika (Furosemid, Torasemid)
- Effektiv als symptomatische Therapie bei Flüssigkeitsretention
- Optimierung der Dosis durch Festlegung und Kontrolle des «Trockengewichts», d.h. individuelle Dosierung
- Wichtigste unerwünschte Nebenwirkungen: Hypokaliämie, Hypomagnesiämie, Hyponatriämie, Störungen des Säure-Basen-Haushaltes, Hyperurikämie
- Nach Erreichen der Euvolämie Reduktion der Diuretika zugunsten der prognostisch wichtigen Medikamente (ACE-I/ARB/ARNI, Betablocker, SGLT2-I, MRA) auf die notwendige Minimaldosis (Diuretika verbessern die Prognose nicht). Zu beachten: auch SGLT2-I wirken leicht diuretisch.
- Wenn eGFR < 30 ml/min/1.73 m2, keine Thiaziddiuretika verwenden, ausser wenn synergistisch mit Schleifendiuretika eingesetzt.
- Begrenzte Kochsalzzufuhr
- Ungenügendes Ansprechen: Diuretika-Dosis erhöhen, evtl. mehrfach täglich verordnen, Schleifendiuretika kurzfristig mit Metolazon (2.5 – 5 mg/Tag) kombinieren (sequenzielle Nephronblockade), Intravenöse Schleifendiuretika (Furosemid) bei intestinaler Stauung und verminderter Resorption (siehe akute Herzinsuffizienz).
ACE-Hemmer, ACE-I
Bestandteil der Basistherapie bei allen Patienten mit HFrEF (LVEF ≤ 40%, und NYHA ≥ II) oder asymptomatischer linksventrikulärer Dysfunktion (LVEF ≤ 40%)
- Hypotonie-Risiko minimieren: exzessive Diurese vermeiden, Diuretika-Therapie für 24 Std. reduzieren oder absetzen, ACE-Hemmer-Therapie eventuell am Abend beginnen
- Niedrig dosiert mit den übrigen drei Basis-Medikamenten (Betablocker, SGLT2-I und MRA) beginnen, und erst dann auf die Zieldosis steigern (Verdopplung der Dosis alle 14 Tage unter Kontrolle von Kalium und Kreatinin, Zieldosis gemäss Studien), schnelleres Auftitrieren im Spital möglich
- Niereninsuffizienz: Therapie nicht abbrechen, solange Anstieg des Kreatinins nicht mehr als 50% des Ausgangswertes bzw. eGFR > 25 ml/min/1.73 m2 und Kalium < 5.5mmol/l
- Kontrollen im Verlauf: BD, Nierenfunktion und Elektrolyte 1–2 Wochen nach Therapiebeginn bzw. bei jeder Dosiserhöhung, nach 3 Monaten und dann alle 6 Monate
Angiotensin-Rezeptorblocker, ARB
- Bei Patienten mit HFrEF und Unverträglichkeit/Nebenwirkungen unter ACE-I respektive ARNI
- Eintitrierung wie bei ACE-I
Betablocker
Bestandteil der Basistherapie bei stabiler HFrEF (LVEF ≤ 40% und NYHA ≥ II) unter Beachtung der Kontraindikationen
- Bei Herzinsuffizienz etablierte Betablocker verwenden: Carvedilol, Bisoprolol, Metoprolol-Succinat, Nebivolol
- Behandlung von Patienten mit linksventrikulärer syst. Dysfunktion (LVEF ≤ 40%) nach Myokardinfarkt auch ohne Symptome einer Herzinsuffizienz
- Es gilt das Prinzip «start low, go slow, aim high»: Beginn mit sehr niedriger Dosis zusammen mit den übrigen 3 Basis-Medikamenten (ACE-I, SGLT2-I und MRA), danach Dosissteigerung in Intervallen von 2–4 Wochen, transiente klinische Verschlechterung möglich (Schwäche, Müdigkeit)
- Bei transienter Verschlechterung der Herzinsuffizienz, v.a. in Frühphase: Dosis der Diuretika evtl. erhöhen, Betablocker-Dosis nicht weiter steigern, evtl. temporär reduzieren
- Bei symptomatischer Hypotonie zuerst Dosisreduktion der Vasodilatatoren, die nicht zwingend nötig (Nitrate), und Diuretika
- Kombination mit Amiodaron (Cordarone) oder Digoxin möglich; bei exzessiver Bradykardie zunächst Digoxin und andere bradykardisierende Medikamente stoppen
- Kontraindikationen beachten (Asthma bronchiale, bradykarde Arrhythmien); COPD und PAVK sind keine Kontraindikationen
SGLT2-Inhibitoren, SGLT2-I
Bestandteil der Basistherapie bei allen Patienten mit HFrEF (LVEF ≤ 40%, und NYHA ≥ II) mit und ohne Diabetes mellitus Typ 2
- Fördert Natriurese, Diurese und Glucosurie, zusätzliche wahrscheinlich direkte kardiale Effekte
- Eine fixe Dosierung (Dapagliflozin 10mg/d oder Empagliflozin 10mg/d), keine Auftitration nötig
- Bei Hypotonie zuerst Reduktion der Dosis von Vasodilatatoren, die nicht zwingend notwendig sind (Nitrate), und Diuretika
- Vorsicht bei Diabetes mellitus Typ 1 (Rücksprache mit Endokrinologie-Team)
- Aufklärung der Patienten bzgl. Risiko von Genital- und Harnwegsinfekten (begünstigt durch Glucosurie), Abklärung bei entsprechenden Symptomen
- Kontrolle Kreatinin 2 Wochen nach Beginn der Therapie
Mineralokortikoidrezeptor-Antagonist, MRA
Bestandteil der Basistherapie bei allen Patienten mit HFrEF (LVEF ≤ 40%, NYHA ≥ II)
- Spironolacton: Ziel-Dosis 12.5–25 mg/Tag (in Ausnahmefällen 50 mg/Tag)
- Eplerenon: für Patienten mit NYHA II (sonst Spironolacton). Dosis 25–50 mg. Im Gegensatz zu Spironolacton keine Gynämomastie.
- Erhöhtes Risiko von Hyperkaliämien, daher initial engmaschige Kontrolle von Kreatinin und Kalium (in Abhängigkeit von Ausgangswerten und Nierenfunktion). Kalium bis 5.5mmol/l tolerabel. Zu erwägen ist in ausgewählten Fällen der chronische Einsatz eines Kaliumbinders (Patiromer).
Angiotensin-Rezeptor-Neprilysin-Inhibitoren (ARNI): verfügbar bisher nur Sacubitril/Valsartan
- Kombination eines ARB mit einem Neprilysin-Inhibitor (hemmt Abbau von BNP und erhöht somit die Verfügbarkeit von biologisch wirksamem BNP)
- Umstellung von allen Patienten, die unter ACE-Hemmer, Betablocker, SGLT-I und MRA stehen und weiterhin symptomatisch sind (mindestens NYHA II). ARNI als Initialtherapie in Ausnahmefällen möglich (IIb-Indikation), v.a. bei hospitalisierten, akut dekompensierten Patienten nach Rekompensation und unter Beobachtung im stationären Setting.
- Bei Umstellung von ACE-Hemmer auf ARNI muss ein 36-stündiges, ACE-Hemmer-freies Intervall beachtet werden (Gefahr des Angioödems), gilt nicht für Umstellung von ARB auf ARNI
- Aufgrund des relativ stark blutdrucksenkenden Effekts Beginn mit 2× 50 mg (wenn vorher auf Zieldosis eines ACE-I oder ARB kann mit 2× 100 mg begonnen werden), Ziel-Dosis 2× 200 mg. Kontrolle von Nierenfunktion und Kalium analog ACE-Hemmer/ARB
- Kombination mit MRA erlaubt und erwünscht
- Verlaufskontrolle: NT-proBNP messen (BNP-Werte nicht verwertbar als Mass der Herzinsuffizienz). Verlaufskontrolle mit natriuretischen Peptiden bei chronischer Herzinsuffizienz aber nicht empfohlen.
Weitere Optionen für Patienten, die unter der Basis-Therapie noch symptomatisch sind und eine LVEF ≤ 35% aufweisen
Gemäss ESC Leitlinien 2021 müssen für all diese Patienten (auch wenn «nur» NYHA II) primär untenstehende medikamentöse/Device-/Interventions-Optionen geprüft werden.
ICD/CRT
Die kardiale Resynchronisation (CRT) ist eine wichtige Therapie-Option für HFrEF-Patienten mit LVEF ≤ 35%, NYHA ≥ II und einem Linksschenkelblock (bester Effekt bei QRS- Breite ≥ 150ms, Indikation aber auch gegeben bei QRS-Breite 130-149ms) respektive mit einer QRS-Breite ≥ 150ms ohne Linksschenkelblock.
Ein interner kardialer Defibrillator (ICD) ist indiziert bei nach dreimonatiger medikamentöser Therapie persistierender LVEF ≤ 35%, NYHA ≥ II, insbesondere bei einer ischämischen Ursache der Herzinsuffizienz (Indikation I). Bei einer nicht-ischämischen Genese besteht eine Klasse IIa Indikation, wobei die Indikation v.a. für jüngere Patienten mit weniger schweren Komorbiditäten gut ist. Details zu ICD/CRT s. Kapitel «ICD und CRT» Seite.
Ivabradin
- Senkt Herzfrequenz via selektivem Effekt auf den Sinusknoten, kein Effekt bei Vorhofflimmern.
- Option bei Patienten mit LVEF ≤ 35%, Sinusrhythmus, NYHA ≥ II und Therapie mit ACE-Hemmer, SGLT2-I und MRA, die Betablocker nicht tolerieren (es muss versucht worden sein!) und eine Herzfrequenz ≥ 70/Min. oder trotz maximaler Betablocker-Therapie eine Herzfrequenz ≥ 70/Min. aufweisen (Reduktion des kombinierten Endpunkts kardiovaskulärer Tod und Rehospitalisationen wegen Herzinsuffizienz).
- Dosis 2× 5 mg/Tag, maximal 2× 7.5 mg (in Abhängigkeit von Herzfrequenz), bei Bradykardie Reduktion auf 2× 2.5 mg/Tag
- Unerwünschte Effekte: Bradykardie, Phosphene
Digoxin
- Reservemedikament, keine Daten für Verbesserung der Prognose (zudem in der Schweiz ab 2022 kaum noch erhältlich)
- Frequenzkontrolle bei Patienten mit HFrEF und Vorhofflimmern
- Symptomatische Patienten (NYHA II–IV) mit HFrEF im Sinusrhythmus trotz optimaler Therapie (gemäss Algorithmus)
- Dosierung je nach Alter und Nierenfunktion: 0.125 mg/Tag, manchmal nur 3×/Woche
- Initial Spiegelkontrolle (maximal 0.8 ng/ml, bei höheren Spiegeln nicht wirksamer, aber toxisch)
Vericiguat
- Stimulator der löslichen Guanylatzyklase, vermittelt Vasodilatation und antiinflammatorische Effekte
- Reduziert die Herzinsuffizienz-Re-Hospitalisationsrate nach einer Hospitalisation wegen Herzinsuffizienz (Klasse IIb-Empfehlung)
- Soll erst nach guter Rekompensation eingesetzt werden (bei sehr hohen NT-proBNP – ca. 8000 ng/l und mehr – potentiell kontraproduktiver Effekt)
- Kontraindiziert bei gleichzeitiger Verabreichung von Phosphodiesterase-Inhibitoren und anderen Guanylatzyklase-Stimulatoren (Vorsicht bei Langzeitnitraten)
Therapie der sekundären Mitralinsuffizienz
Bei trotz ausgebauter medikamentöser Herzinsuffizienztherapie (inkl. CRT falls indiziert) persistierender relevanter sekundärer Mitralinsuffizienz mit zusätzlichen Outcome-Echokriterien («COAPT-Kriterien»): Besprechung eines perkutanen Mitraklappeneingriffes im Herzteam. Siehe auch Kapitel «valvuläre Herzerkrankungen».
Pulmonalvenenisolation
Option für selektionieren Patienten mit HFrEF und paroxysmalem oder permanentem Vorhofflimmern, siehe Kapitel «Vorhofflimmern» Seite
Weitere Optionen bei fortgeschrittener HFrEF (advanced heart failure)
Bei jüngeren Patienten mit schwerer Herzinsuffizienz (advanced heart failure, Definition und Kriterien s. ESC Leitlinien Herzinsuffizienz 2021) sollte eine Mitbeurteilung durch das tertiäre Herzinsuffizienz-Zentrum bezgl. Evaluation eines links-ventrikulären Assist-Devices resp. einer Herztransplantation erfolgen.
Nicht empfohlene bzw. kontraindizierte Massnahmen bei HFrEF
- Darbepoetin und andere Erythropoese-stimulierende Substanzen: nicht indiziert
- Statine: nicht indiziert zur Behandlung der Herzinsuffizienz per se; indiziert bei zugrunde liegender Koronarer Herzkrankheit
- Orale Antikoagulation: indiziert bei Vorhofflimmern, Klappenprothese etc., aber nicht wegen Herzinsuffizienz per se
- Renin-Inhibitoren: keine Indikation
- Diltiazem und Verapamil kontraindiziert bei HFrEF (negativ inotrop); Amlodipin kommt infrage, falls Blutdruck mit Standard-Therapie nicht ausreichend behandelt werden kann
- Zentrale Schlafapnoe: BIPAP-Therapie kontraindiziert (gilt nicht für CPAP, weder für die Therapie von obstruktiver noch zentraler Schlafapnoe)
- NSAR und Coxibe kontraindiziert
Herzinsuffizienz mit leicht eingeschränkter Pumpfunktion (HFmrEF)
Pathophysiologie und Diagnose
Siehe Tab. 1 «Klassifikation der Herzinsuffizienz» Seite
Therapie
Es gibt Hinweise, dass Patienten mit HFmrEF positiv auf eine medikamentöse «HFrEF»-Therapie ansprechen. Entsprechend sind folgende Medikamenten-Klassen nun in den ESC Leitlinien Herzinsuffizienz 2021 mit einer Indikations-Klasse IIb versehen worden:
- ACE-I/ARB/ARNI
- Betablocker
- MRA
Nach der Publikation der ESC-Leitlinien 2021 wurden in zwei Studien übereinstimmend positive Effekt von Empagliflozin und Dapagliflozin auf den kombinierten Endpunkt kardiovaskulärer Tod und Herzinsuffizienz-Hospitalisation (getrieben durch Reduktion der Herzinsuffizienz-Hospitalisationen) bei Patienten mit HFmrEF (und HFpEF) nachgewiesen, sowohl für Diabetiker als auch für Nicht-Diabetiker. Dies wird sicher in einer positiven Empfehlung in den nächsten Leitlinien resultieren. Für Diabetiker mit HFmrEF können diese Medikamente entsprechend verordnet werden. Für Nicht-Diabetiker ist die Aufnahme auf die Spezialitätenliste hängig.
Herzinsuffizienz mit erhaltener Pumpfunktion (HFpEF)
Pathophysiologie und Diagnose
Siehe Tab. 1 «Klassifikation der Herzinsuffizienz» Seite (für Details Spezialliteratur)
Therapie
Prinzip
Es gibt keine Therapie, welche das Überleben dieser Patienten verbessert. Die Therapie zielt darauf ab, Symptome zu verbessern und Hospitalisation zu verhindern, dies durch optimale Behandlung der kardiovaskulären Grundkrankheit (Hypertonie, Diabetes, Koronare Herzkrankheit) und von Co-Morbiditäten (Übergewicht, Schlafapnoe, Niereninsuffizienz) sowie Medikamente, die in der klinischen Erfahrung wirksam sind und/oder in Studien gewisse Effekte gezeigt haben. In der Praxis muss ausprobiert werden, von welchen Medikamenten ein Patient symptomatisch am besten profitiert.
- Wichtig:
- Vermeiden/Behandlung von Tachyarrhythmien (Vorhofflimmern)
- Vermeiden von Volumendepletion und Volumenüberladung
Diuretika
Symptomatisch oft wirksam. Cave: schmale therapeutische Breite aufgrund einer steilen enddiastolischen Druck-Volumen-Beziehung des linken Ventrikels bei HFpEF Stauung (Cave: Volumendepletion)
Empagliflozin und Dapagliflozin
Nach der Publikation der ESC-Leitlinien 2021 wurden in zwei Studien übereinstimmend positive Effekt von Empagliflozin und Dapagliflozin auf den kombinierten Endpunkt kardiovaskulärer Tod und Herzinsuffizienz-Hospitalisation (getrieben durch Reduktion der sowie auf die Herzinsuffizienz-Hospitalisationen) bei Patienten mit HFpEF (und HFmrEF) nachgewiesen, sowohl für Diabetiker als auch für Nicht-Diabetiker. Dies wird sicher in einer positiven Empfehlung in den nächsten Leitlinien resultieren. Für Diabetiker mit HFpEF können diese Medikamente entsprechend verordnet werden. Für Nicht-Diabetiker ist die Aufnahme auf die Spezialitätenliste hängig.
Digoxin
Option bei tachykardem Vorhofflimmern zur Frequenzkontrolle, im Sinusrhythmus Nutzen unklar. Keine Empfehlung in den Leitlinien, zudem Medikament in der Schweiz kaum mehr erhältlich.
Spironolacton
Kein Effekt auf Mortalität, aber Reduktion des Risikos von Re-Hospitalisationen, allerdings erhöhtes Risiko von Niereninsuffizienz und Hyperkaliämie. Studiendaten leider nicht schlüssig, keine Empfehlung in den Leitlinien.
Amiodarone
Rhythmuskontrolle bei Episoden von Vorhofflimmern mit konsekutiven Dekompensationen
Prof Dr. Micha Maeder, Dr. Marc Buser,
Dr. Gian-Reto Kleger, Prof. Dr. Hans Rickli, Dr. Jörg Scheler
- Siehe Herzinsuffizienz-Broschüre der schweizerischen Herzstiftung, www.schwachesherz.ch ↵