Hyperlipidämien
Einleitung
- Das LDL-Cholesterin (LDL-C) ist der wichtigste behandelbare kardiovaskuläre Risikofaktor. Das Apolipoprotein B reflektiert die Konzentration aller atherogenen Lipoproteine und gewinnt für die Risikostratifizierung und Therapiesteuerung zunehmend an Bedeutung.
- Eine Senkung des LDL-C ist alters- und geschlechtsunabhängig mit einer Senkung des kardiovaskulären Risikos verbunden und die absolute Risikoreduktion ist umso grösser, je grösser die absolute LDL-C-Reduktion ist.
- Grundlage zur Indikationsstellung für eine LDL-C senkende Therapie ist die Einschätzung des absoluten kardiovaskulären Risikos. Die aktuellen Europäischen Leitlinien sehen 4 Risikokategorien vor (sehr hoch, hoch, intermediär, tief).
- Risikorechner, wie beispielsweise der AGLA-Score oder die ESC-Charts, liefern eine Risikoeinschätzung für die nächsten 10 Jahre anhand der bestehenden Risikofaktorenkonstellation.
- Patienten mit Erkrankungen, die mit einem hohen Lebenszeitrisiko einhergehen, bspw. familiärer Hypercholesterinämie, Diabetes mellitus oder chronischer Niereninsuffizienz werden der Gruppe mit hohem oder sehr hohem kardiovaskulären Risiko zugeteilt.
- Bei klinischer oder ausgeprägter, bildgebend nachweisbarer Atherosklerose erfolgt die Zuordnung zur Risikokatgorie sehr hoch.
Definitionen
- Hypercholesterinämie: Erhöhung des LDL-C und in der Folge des Gesamtcholesterins > 95 Perzentile der betrachteten Population. Es werden hier von Labors aber praktisch ausnahmslos nicht Norm-, sondern Ziel- oder Idealwerte angegeben: LDL-C < 2.6 oder 3.0 mmol/l, Gesamtcholesterin < 5.0 mmol/l
- Hypertriglyzeridämie: Erhöhung der Nüchtern-Triglyzeride (TG) > 2.0 mmol/l
- Schwere Hypertriglyzeridämie: Erhöhung der Nüchtern-TG > 10 mmol/l, hierbei sind immer auch Chylomikronen (CM) nachweisbar (Chylomikronämie)
- Kombinierte (gemischte) Hyperlipidämie: Erhöhung des LDL- und/oder Gesamtcholesterins und der Triglyzeride
- Dyslipidämie: für den DM Typ 2 bzw. das metabolische Syndrom charakteristischer Lipidphänotyp, durch eine Hypertriglyzeridämie, normales LDL-C und tiefes HDL-C (F <1.3, M< 1.0 mmol/l) gekennzeichnet. Wird aber oft auch als Überbegriff für alle Lipidstoffwechselstörungen verwendet
- Trigyzeridreiche Lipoproteine (TRL): VLDL, IDL und CM. TRL und deren Remnants (TRLR) sind ebenso sehr atherogen.
- Non-HDL-Cholesterin: Gesamt-C. – HDL-C. Cholesterin in TRL/TRLR, bei Dyslipidämien/Hypertriglyzeridämien besserer Risikoprädiktor als das LDL-C.
- Apo B: Mass für die Anzahl aller zirkulierenden atherogenen Lipoproteine (TRL, TRLR, LDL). Bei Dyslipidämien/Hypertriglyzeridämien besserer Risikoprädiktor als das LDL-C und v.a. für das Therapiemonitoring geeignet.
- Hyperlipoproteinämie (a): Erhöhung des Lipoprotein (a) > 500 mg/l (120 nmol/l)
- Familiäre Hypercholesterinämie (FH): durch einen klinischen Score diagnostizierte FH; Heterozygote FH (HeFH): molekulargenetisch bestätigt, monogenetisch (LDLR-, APOB- PCSK9-Mutation)
Screening
- Generell ab dem 40. (Männer) bzw. 50. (Frauen) Lebensjahr
- Bei Diagnose weiterer kardiovaskulärer Risikofaktoren unmittelbar
- Bei Diagnose einer primären Hyperlipidämie oder frühzeitigen Atherosklerose bei erstgradig Verwandten
Abklärung
Eine exakte phänotypische und ätiologische Klassifizierung (Tab. 1–5) ist nötig; insbesondere korrekte Diagnose einer Familiären Hypercholesterinämie (FH) oder Familiär kombinierten Hyperlipidämie (FCHL).
Anamnese
- Detaillierte persönliche und Familienanamnese bezüglich Dyslipidämien und (frühzeitiger: Männer < 55 Jahre, Frauen < 60 Jahre) Atherosklerose
- Medikamentenanamnese (Tab. 4) einschliesslich Unverträglichkeiten gegenüber Lipidsenkern
- Ernährungsanamnese, ggf. durch Ernährungsberatung
Klinische Untersuchung
- BMI, Bauchumfang, Fettverteilung (Lipodystrophie?), Blutdruck, Xanthome (Achillessehnen, Strecksehnen der Hände), Arcus lipoides
Labor
- Ausser bei bekannter Hypertriglyzeridämie Nüchtern-Blutentnahme nicht obligat!
- Lipidprofil (Cholesterin, Triglyzeride, LDL-C, HDL-C) in
nasschemischem Labor - Apolipoprotein B (bei kombinierter Hyperlipidämie und Hypertriglyzeridämie)
- Lipoprotein (a) bei initialem Screening
- TSH, Glukose/HbA1c und Urinstatus (Ausschluss sekundäre Hyper-/Dyslipidämien – Tab. 5)
- HsCRP, Kreatinin, eGFR und Albumin/Kreatinin-Quotient im Spoturin zur Risikostratifizierung
Dutch Lipid Clinic Network-Score (DLCNS)
- Bei LDL-C > 5 mmol/l/> 3.5 mmol/l unter Statintherapie und/oder Gesamtcholesterin > 8 mmol/l (Tab. 3)
Molekulargenetische Abklärung
- Nach Rücksprache Lipidsprechstunde Endokrinologie
- Diagnose einer heterozygoten FH: ZLM-FH-Panel (u.a. LDLR-, APOB-, PCSK9-Gen) empfohlen bei LDL-C > 5 mmol/l und DLCN-Score ≥ 5
- ApoE-Genotyp bei V.a. Dysbetalipoproteinämie gem. TC/Apo B – Ratio
- Bei V.a. hereditäre Chylomikronämie: ZLM-Hypertriglyzeridämie-Panel (u.a. LPL, APOC2, LMF-1-, GP1HBP1, etc.) bei V.a. Familiäres Chymomikronensyndrom, wiederholt Nüchtern-Tg > 10 mmol/l
Atheroskleroseimaging
- Koronare Kalklast (CAC, Agatston-Score) oder sonographischer Plaquenachweis (cerebrovaskulär, abdominal, femoral) zur individuellen Risikostratifizierung bei niedrigem/intermediärem Risiko optional
- Eventuell bei FH ohne bekannte klinische Atherosklerose zur Steuerung der Therapieintensität; CAC im Verlauf unter Statintherapie nicht geeignet.
Familienabklärung
- Nach Diagnoststellung einer (heterozygoten) FH muss zwingend eine Familienabklärung durch ein klinisches und wenn immer möglich genetisches (bei HeFH) Kaskadenscreening erfolgen
|
Gesamt-/LDL-C. (mmol/l) |
Triglyceride (mmol/l) |
Apo B (g/l) |
|
| Hypercholesterinämie |
> 5.0/3.0 |
< 2.0 mmol/l |
> 1.0 |
| Kombinierte Hyperlipidämie |
> 5.0/3.0 |
> 2.0 mmol/l |
> 1.0 |
| Hypertriglyzeridämie |
< 5.0/3.0 |
> 2.0 mmol/l |
< 1.0 |
| Moderate Hypertriglyzeridämie |
2.0–10.0 mmol/l |
||
| Schwere Hypertriglyzeridämie |
> 10.0 mmol/l |
| Häufigkeit | Genetik/Pathophysiologie | Labor/Klinik | kardiovaskuläres (kv) Risiko | |
| Familiäre Hypercholesterinämie (FH) | 1 : 250 | Autosomal-dominant; LDL-Rezeptor- APOB- oder PCSK9-Mutation; polygene Form bei 20% mit klinischer Diagnose | LDL-C, 5–12 mmol/l (heterozygote),
> 13 mmol/l (homozygote), Sehnenscheidenxanthome, Arcus lipoides < 45 Jahre |
↑↑↑↑
↑↑↑ |
| Familiär kombinierte Hyperlipidämie (FCHL) | 1 : 200 | polygen/VLDL-Überproduktion | TG > 2.0 mmol/l, Apo B > 1.2 g/l und pos. FA für frühzeitige kardiovaskuläre Erkrankung bei 1° Verwandtem | ↑↑ |
| Familiäre Dysbetalipoproteinämie | 1 : 10’000 | Autosomal-rezessiv/verminderte ApoE-mediierte Clearance von cholesterinreichen Remnants | Chylomikronenremnants; Chol/Apo B > 6.2 TG/Apo B < 10 & Apo E2/E2 | ↑↑ |
| Familiäre
Chylomikronämie |
1 : 1’000’000 | Autosomal-rezessiv/u.a. Lipoproteinlipasemutation | Chylomikronensyndrom, akute Pankreatitis (TG > 20 mmol/l) | ↔ |
| Familienanamnese (maximal 2 Punkte) | Punkte |
| Erstgradig Verwandter mit frühzeitiger KHK (M < 55 Jahre, F < 60 Jahre) | 1 |
| Erstgradig Verwandter mit LDL-C > 95. Perzentile (alters- und geschlechtsabhängig, CH ~5.5 mmol/l) | 1 |
| Erstgradig Verwandter mit Sehnenscheidenxanthomen oder Arcus cornealis | 2 |
| Kinder < 18. Lebensjahr LDL-C > 95. Perzentile (alters- und geschlechstabhängig) | 2 |
| Persönliche Anamnese (maximal 2 Punkte) | Punkte |
| Frühzeitige KHK (M < 55 Jahre, F < 60 Jahre) | 2 |
| Frühzeitige PAVK oder zerebrovaskuläre Verschlusskrankheit (M < 55 Jahre, F < 60 Jahre) | 1 |
| Klinische Untersuchung (maximal 6 Punkte) | Punkte |
| Sehnenscheidenxanthome | 6 |
| Arcus cornealis vor dem 45. Lebensjahr | 4 |
| LDL- Cholesterin-Werte | Punkte |
| > 8.5 mmol/l | 8 |
| 6.5–8.4 mmol/l | 5 |
| 5.0–6.4 mmol/l | 3 |
| 4.0–4.9 mmol/l | 1 |
| Molekulargenetische Analyse | Punkte |
| Nachgewiesene pathogene Mutation im LDL-Rezeptor-, Apo B- oder PCSK9 – Gen | 8 |
| > 8 Punkte: definitive Diagnose einer FH
6–8 Punkte: wahrscheinliche FH 3–5 Punkte: mögliche FH 0–2 Punkte: FH unwahrscheinlich |
| Thiazide (> 25 mg/Tag) | TG ↑ | Cyclosporin | LDL-C ↑ |
| Östrogene | TG ↑ | Sirolimus, Everolimus | Chol ↑, TG ↑ |
| Tamoxifen, Clomifen | TG ↑ | Olanzapin | TG ↑ |
| Androgene, Anabolika | HDL-C ↓ | Proteasehemmer | Chol ↑, TG ↑, HDL-C ↓ |
| Isotretinoin | Chol ↑, TG ↑ | Interferon | TG ↑ |
| Hypothyreose | LDL-C ↑↑ | Cholestatische Lebererkrankungen | Chol ↑↑ (LpX) |
| Diabetes mellitus (DM) | TG ↑, HDL-C ↓ | Akute intermittierende Porphyrie | LDL-C ↑ |
| Hypercortisolismus | Chol ↑, TG ↑ | Glykogenose Typ 1 | TG ↑↑ |
| Lypodystrophien | TG ↑↑, HDL-C ↓ | Sepsis | TG ↑ |
| Adipositas | TG ↑, HDL-C ↓ | Monoklonale Gammopathie | TG ↑ u/o Chol ↑ |
| Nephrotisches
Syndrom |
LDL-C ↑↑, TG ↑ | Anorexie | LDL-C ↑ |
| Alkoholabusus | TG ↑ | Schwangerschaft | TG ↑ |
Risikostratifizierung
Überprüfung, ob der Patient a priori der hohen oder sehr hohen Risikokategorie angehört (Tab. 6), falls dies nicht zutrifft: Risikoabschätzung mittels eines Risikoscores (CH: AGLA-Score, www.agla.ch; ESC-Score für Länder mit niedrigem Risiko, Webseite für div. Scores: https://u-prevent.com)
Risikomodifikatoren: Ermittlung und Berücksichtigung von Faktoren, die das Risiko bei Personen mit niedrigem oder intermediärem Risiko erhöhen bzw. diese Personen in eine höhere Risikogruppe klassifizieren:
- Begleiterkrankungen: chronisch-entzündliche Erkrankungen (Rheumatoide Arthritis, usw.); HIV-Infektion; Nichtalkoholische Fettlebererkrankung; obstruktives Schlafapnoesyndrom; Vorhofflimmern, linksventrikuläre Hypertrophie; Depression
- Begleitumstände: psychosozialer Stress oder Isolation; körperliche Inaktivität
- Bildgebender Atherosklerosenachweis: erhöhtes Risiko bei CAC (Agatston-Score) > 100 und/oder Plaquenachweis Carotis oder femoral; umgekehrt reduziert eine diesbezüglich unauffällige Untersuchung (keine Plaques in der Karotissonografie, Agatston-Score < 10) das kardiovaskuläre Risiko erheblich
- Biochemische Risikofaktoren: Lp(a) > 500 mg/l (120 nmol/l); hsCRP > 3 mg/l; Mikroalbuminurie
Anmerkung: Die Risikostratifizierung gem. ESC 2021 und AGLA 2023 unterscheidet sich in einigen Nuancen (v.a. bezüglich des niedrigen bis moderaten Risikos), die vernachlässigbar erscheinen.
| Risikokategorie | gemäss AGLA 2023/ESC 2021 | |
| Sehr hoch |
|
|
| Hoch |
|
|
| Moderat
und Niedrig |
|
|
Lipidsenkende Therapie und Zielwerte
- Bei Hypercholesterinämien, kombinierten Hyperlipidämien und moderaten Hypertriglyzeridämien ist die kardiovaskuläre Risikoreduktion das erste Therapieziel.
- Die Indikationsstellung erfolgt aufgrund des absoluten kardiovaskulären Risikos. Primär soll zur Risikoreduktion eine Statintherapie eingesetzt werden, um das LDL-Cholesterin zu senken.
- Bei einem niedrigen Risiko ist primär eine Lebensstiländerung empfohlen. In der PREDIMED-Studie wurde durch eine mit Olivenöl oder Nüssen angereicherte mediterrane Ernährung das kardiovaskuläre Risiko reduziert.
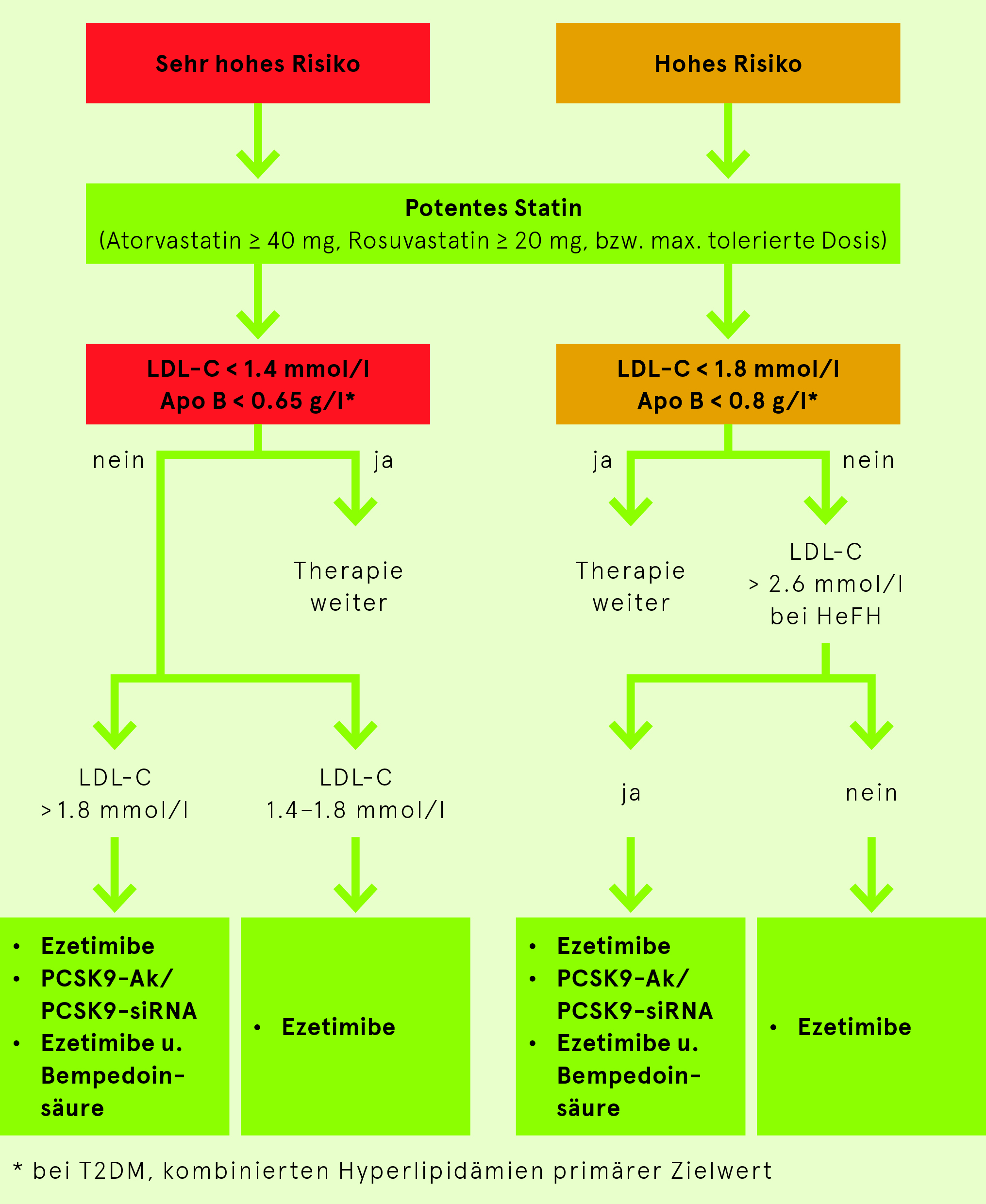
- Falls das LDL-C Ziel mit einer Statintherapie nicht erreichbar ist, soll eine Kombination mit Ezetimibe oder PCSK9-basierten Therapien oder Bempedoinsäure erfolgen.
- Je grösser die LDL-C Reduktion, desto grösser die absolute kardiovaskuläre Risikoreduktion. Deshalb soll bei hohem/sehr hohem kv Risiko immer eine potente Statintherapie (Atorvastatin 40 mg, Rosuvastatin 20 mg) eingesetzt werden, um das Ziel einer LDL-C Reduktion > 50% zu erreichen. Je höher das kv Risiko, desto tiefer der LDL-C Zielwert (Tab. 7).
- Das Apo B und das Non-HDL-Cholesterin sollen immer beim T2DM, bei kombinierten Hyperlipidämien und Hypertriglyzeridämien bestimmt werden.
| Risikokategorie | Zielwerte | Therapiestrategie | ||
| LDL-
Cholesterin* |
Non-HDL-Cholesterin* | ApoB* | Medikamentöse Therapie** |
|
| Sehr Hoch | < 1.4 mmol/l und 50% Reduktion | < 2.2 mmol/l | < 0.65 g/l |
|
| Hoch | < 1.8 mmol/l und 50% Reduktion | < 2.6 mmol/l | < 0.8 g/l |
|
| Intermediär | < 2.6 mmol | < 3.5 mmol/l | < 1.0 g/l |
|
| nierdrig |
|
|||
Lipidsenkende Therapie bei besonderen Patientengruppen
Ältere Patienten (> 75 Jahre)
- Es muss im Einzelfall unter Berücksichtigung der Gesamtsituation gemeinsam mit dem Patienten entschieden werden, ob eine Statintherapie durchgeführt werden soll.
- Metaanalysen randomisierter Studien zeigen für Patienten dieser Altersgruppe in der Primär- und Sekundärprävention eine mit jüngeren Patienten vergleichbare absolute Risikoreduktion.
Chronische Niereninsuffizienz
- Patienten mit dialysepflichtiger Niereninsuffizienz (KDIGO G5) profitieren nicht von einer Statintherapie. Wir empfehlen, die Statintherapie bei für eine Nierentransplantation gelisteten Dialysepatienten fortzuführen.
- Patienten mit einer fortgeschrittenen Niereninsuffizienz KDIGO G3-4 haben ein (sehr) hohes kardiovaskuläres Risiko und der Nutzen einer Statintherapie (+/- Ezetimibe) auf das kardiovaskuläre Risiko ist gut belegt (-20% pro mmol/l LDL-C-Reduktion), diese somit indiziert.
- Das Vorhandensein einer Albuminurie (KDIGO ≥ A2) zeigt unabhängig von der eGFR ebenso ein hohes kardiovaskuläres Risiko an, eine Statintherapie ist emphohlen.
- Der Nutzen der Statintherapie nimmt aber mit abnehmender eGFR ab und der Einsatz hoch dosierter (potenter) Statine bei einer eGFR < 30 ml/min ist umstritten.
Kombinierte Hyperlipidämie/Hypertriglyzeridämie, DM Typ 2
- Die kardiovaskuläre Risikoreduktion erfolgt primär mit Statinen, zudem können Ezetimibe und PCSK9-Ak/siRNA eingesetzt werden
- Ebenso kann eine Behandlung mit hochdosierter Eicosapentaensäure (Vakzepa, Icosapentethylester; im Moment in der CH noch nicht verfügbar) erwogen werden.
- Eine Kombination mit Fenofibrat kommt vor allem bei einer persistierend schweren Hypertriglyzeridämie in Betracht. Eine kardiovaskuläre Risikoreduktion wurde nur in post hoc Analysen bei TG > 2.0 mmol/l und einem HDL-C < 1.0 mmol/l nachgewiesen.
Schwere Hypertriglyzeridämie
- Aufgrund des Pankreatitisrisikos steht zunächst die Triglyzeridsenkung im Vordergrund.
- Die wichtigste Massnahme ist die Reduktion der Kalorien- und v.a. Fettzufuhr. Einfache Zucker (Haushaltszucker, Traubenzucker, Fruchtzucker) sollen gemieden werden.
- Gelingt es nicht, die Nüchtern-TG mit der Ernährungstherapie < 10 mmol/l zu senken, kommt eine zusätzliche Therapie mit Fibraten und/oder hochdosierter EPA in Betracht.
- Nach Kontrolle der Hypertriglyzeridämie erfolgt bei erhöhtem kardiovaskulären Risiko eine Kombinationstherapie mit Statinen.
Ernährungstherapie
Kardiovaskuläre Prävention:
- Gesättigte Fette < 10% der Gesamtkalorien, keine Transfette
- Mit Olivenöl/Nüssen angereicherte mediterrane Ernährung (kardiovaskuläre Risikoreduktion in der PREDIMED-Studie und CORDIOPREV-Studie)
- Erreichen eines normalen Körpergewichtes (BMI < 25 kg/m2)
- Gesteigerte Zufuhr von Nahrungsfasern
Hypertriglyzeridämie:
- Erreichen eines normalen Körpergewichtes (BMI < 25 kg/m2)
- Reduktion der Alkohohlzufuhr
- Reduktion der Fettzufuhr und Einsatz mehrfach ungesättigter Fettsäuren
- Reduktion der Fruktosezufuhr
- Einsatz von mittelkettigen Triglyzeriden evtl. bei Chylomikronämie
Medikamentöse Therapie
Statine
| Vor Therapie | Nach Therapiebeginn/-anpassung | Langzeitverlauf | |
| Lipide |
|
|
|
| Leberenzyme (ALT) |
|
|
|
| CK |
|
|
|
Präparate:
- Simvastatin (10–80 mg)*; 80 mg aufgrund des ungünstigen NW-Profils nicht empfohlen
- Pravastatin (20–40 mg)*
- Atorvastatin (10–80 mg)*
- Rosuvastatin (10–40 mg)*
- Fluvastatin (40 mg u. ret. 80 mg)*
- Pitavastatin (Livazo 1–4 mg)
*Generika
Eigenschaften:
- Gesteigerter LDL-Abbau infolge Cholesterinsynthesehemmung in der Leber
- LDL-C Senkung von Präparat/Dosis abhängig, bis 55%, zusätzliche LDL-C Senkung ca. 6% bei Dosisverdoppelung
- Reduktion von kardiovaskulärer Morbidität und Mortalität nachgewiesen
- Bei LDL-C > 3.5 mmol/l und/oder ACS/Stroke primär potentes Statin empfohlen (Simvastatin 40 mg, Atorvastatin ≥ 40 mg, Rosuvastatin 10–20 mg)
- Kombination mit Ezetimibe, PCSK9-Hemmern, Bempedoinsäure und Fenofibrat möglich
Ezetimibe
Präparate:
- Ezetrol (Ezetimibe) 10 mg/Tag
- Ezetimibe/Simvastatin (Inegy, Generika; 10/10 mg 10/20 mg, 10/40 mg, 10/80 mg); 10/80 mg aufgrund des ungünstigen Nebenwirkungsprofils nicht empfohlen
- Ezetimibe/Atorvastatin (Atozet 10/10 mg, 10/20 mg, 10/40 mg, 10/80 mg)
- Ezetimibe/Rosuvastatin (Zenon 10/10 mg, 10/20 mg, 10/40 mg; Generika; 10/10 mg, 10/20 mg)
Eigenschaften:
- Hemmung der intestinalen Cholesterinabsorption
- LDL-C Senkung ca. 20%
- Kardiovaskuläre Risikoreduktion in der SHARP- und IMPROVE-IT-Studie in Kombination mit Statinen
PCSK9-basierte Therapien
PCSK9 – Antikörper Präperate
- Evolocumab (Repatha 140 mg sc alle 2 Wochen)
- Alirocumab (Praluent 75 oder 150 mg sc alle 2 Wochen)
PCSK9 – siRNA Präperate
- Inclisiran (Leqvio 284 mg sc bei 0, 3 Monaten, dann alle 6 Monate)
Eigenschaften:
- PCSK9 ist eine hepatisch sezerniertes Protein, das das Recycling des LDL-Rezeptors stört. Eine Hemmung der Bildung von PCSK9 durch RNA-Interferenz (Inclisiran) oder Neutralisierung von zirkulierendem PCSK9 durch monoklonale Antikörper (Alirocumab, Evolocumab) führt zu einer ca. 50-60% Senkung des LDL-C.
- Eine kardiovaskuläre Risikoreduktion bei Hochrisikopatienten unter Statintherapie in der FOURIER- und ODYSSEY OUTCOMES-Studie gezeigt. Für Inclisiran liegen bisher keine Resultate von Studien mit kardiovaskulären Endpunkten (CVOT) vor.
- Subgruppenanalysen der PCSK9-Ak-CVOT weisen eine stärkere kardiovaskuläre Risikoreduktion bei Patienten mit ≥ 2 vorangegangenen Myokardinfarkten, einem Myokardinfarkt während der letzten beiden Jahre, einer Mehrgefässerkrankung, einem LDL-C > 2.6 mmol/l, hsCRP > 3 mg/l und Lp(a) > 500 mg/l nach.
- Limitatio der Spezialitätenliste beachten
Bempedoinsäure
Präparate:
- Nilemdo (Bempedoinsäure) 180 mg/Tag
- Nustendi (Bempedoinsäure 180 mg und Ezetimibe 10 mg/Tag)
Eigenschaften:
- Bempedoinsäure ist eine Prodrug, die in der Leber zu Bempedoyl-CoA aktiviert wird und dort die Acetyl-CoA-Carboxylase und somit die Cholesterinsynthese hemmt
- LDL-C Senkung ca. 20%, auch in Kobination mit Statinen und Ezetimibe
- Als Nebenwirkung muss v.a. ein Anstieg der Harnsäure und ein erhöhtes Risiko für Gichtarthritiden beachtet werden
- Bisher noch kein CVOT vorliegend
- Limitatio der Spezialitätenliste beachten
Fibrate
Präparate:
- Fenofibrat (Lipanthyl 200 M, Lipanthyl 267 M, Cholib [Fixkombination mit Simvastatin])
- Gemfibrozil (Gevilon Uno)
- Bezafibrat (Cedur retard)
- Ciprofibrat (Hyperlipen)
Eigenschaften:
- Gesteigerter Abbau triglyzeridreicher Lipoproteine (v.a. VLDL)
- Triglyzeridsenkung bis 50%, moderater Anstieg des HDL-C, z.T. LDL-C Anstieg infolge beschleunigter Umwandlung VLDL – LDL
- Nur Fenofibrat kann mit Statinen kombiniert werden
- Einsatz bei moderater und schwerer Hypertriglyzeridämie
- Kein konsistenter Nachweis einer kardiovaskuläre Risikoreduktion (nur in einigen Studien nachweisbar, Helsinki Heart-Studie, VA-HIT-Studie, ACCORD-LIPID-Studie bei Kombination mit Simvastatin in Subgruppe mit TG > 2.3 mmol/l und HDL-C < 0.9 mmol/l bei Patienten mit DM Typ 2).
- Einsatz vorwiegend bei schwerer Hypertriglyzeridämie
Omega-3-Fettsäuren
Präparate:
- Eicosapentaensäure (EPA)/Docosahexaensäure (DHA) (z.B. Burgerstein Omega-3-EPA, 378 mg EPA, 72 mg DHA)
- Vakzepa (Icosapentethylester): 2x2g/Tag
Eigenschaften:
- Hoch dosierte Omega-3-Fettsäuren aus Fischöl (2–4 g gereinigtes EPA/DHA) senken die Triglyzeride um ca. 35% und werden bei therapierefraktären Hypertriglyzeridämien empfohlen.
- Eine kardiovaskuläre Risikoreduktion konnte ausschliesslich mit Vakzepa (Icosapentethylester, hochdosiertes, reines EPA-Präparat, 4g/Tag) nachgewiesen werden, während andere Präparate (bspw. Omega-3-Carboxylsäure keine kardiovaskuläre Risikoreduktion gezeigt haben.
- Vakzepa ist von der Swissmedic für Reduzierung des Risikos für kardiovaskuläre Ereignisse bei mit Statinen behandelten erwachsenen Patienten mit hohem kardiovaskulärem Risiko und erhöhten Triglyceridwerten (≥1.7 mmol/l) sowie nachgewiesener kardiovaskulärer Erkrankung oder Diabetes und mindestens einem weiteren kardiovaskulären Risikofaktor zugelassen. Bislang erfolgte keine Aufnahme in die Spezialitätenliste (Stand 01/2023).
Vorgehen bei Nebenwirkungen bzw. Unverträglichkeit der lipidsenkenden Therapie
Statin-assoziierte Myopathie
| Unveränderte Therapie bei asymptomatischer CK-Erhöhung < 1000 U/l, Suche nach alternativen Ursachen (Makro-CK), Verlaufskontrolle |
| Suche nach Medikamenteninteraktionen |
| Suche nach anderen Ursachen einer Myopathie (ibs. Hypothyreose, Polymyalgie, Polymyositis, Medikamente usw.) |
| Wechsel auf ein Statin mit anderen pharmakokinetischen Eigenschaften (Simvastatin, Atorvastatin ersetzen durch Pravastatin, Fluvastatin, Rosuvastatin, Pitavastatin und umgekehrt) |
| Dosisreduktion, ggf. Kombination mit Ezetrol |
| Gabe eines Statins mit langer Halbwertszeit (Atorvastatin, Rosuvastatin) jeden 2. Tag |
| Absetzen der Statintherapie. Es gibt Hinweise, dass es nach Absetzen einer Statintherapie im Sinne eines Reboundphänomens vermehrt zu kardiovaskulären Ereignissen kommt, weshalb dieser Schritt bei Patienten mit KHK und tolerablen Symptomen nur gemacht werden soll, wenn die anderen Massnahmen nicht erfolgreich sind. |
| Einsatz alternativer Lipidsenker |
| Medikament | Interaktion mit |
| Fibrate (Ausnahme: Fenofibrat) | Allen Statinen |
| Antimykotika (Fluconazol, Ketoconazol) | Simvastatin, Atorvastatin |
| HIV-Proteasehemmer | Simvastatin, Atorvastatin, Rosuvastatin |
| Verapamil | Simvastatin, Atorvastatin |
| Amiodaron | Simvastatin, Atorvastatin |
| Cyclosporin | Simvastatin, Atorvastatin, Rosuvastatin |
| Makrolide | Simvastatin, Atorvastatin |
- Betrifft ca. 10% der mit Statinen behandelten Patienten
- Myalgien (typischerweise proximal betonte muskelkaterähnliche oder grippale Beschwerden, die oft durch körperliche Aktivität akzentuiert werden) oder Muskelkrämpfe
- CK-Erhöhung möglich, aber nicht obligat; CK-Erhöhung ohne Beschwerden möglich
- Rhabdomyolyse (CK > 10’000 U/l): sehr selten, v.a. infolge Medikamenteninteraktionen, die zu erhöhten Plasmakonzentrationen der Statine führen
- Immunvermittelte nekrotisierende Myopathie: Einzelfälle, Assoziation mit HMG-CoA-Reductase-Ak
- Risikofaktoren genetische Prädisposition, Alter > 80 Jahre, Leber- und Niereninsuffizienz, Alkoholabusus u.a.
- Dauer bis Auftreten der Beschwerden ca. 6 Monate, bis zum vollständigen Verschwinden nach Absetzen ca. 3 Monate, grosse individuelle Variabilität
- Systematisches CK-Monitoring bei beschwerdefreien Patienten unter einer Statinmonotherapie nicht gerechtfertigt
Hepatopathie
- Hepatopathien sind selten, können unter Statinen und Fibraten auftreten.
- Eine asymptomatische Transaminasenerhöhung bis zum maximal 3-fachen der oberen Norm wird als tolerabel betrachtet.
- Hypertriglyzeridämien sind regelhaft mit einer NAFLD assoziiert, die keine Kontraindikation für eine lipidsenkenden Therapie ist.
Statine und Diabetesrisiko
- Das Risiko für das Neuauftreten eines DM Typ 2 steigt unter einer Statintherapie um ca. 15%.
- Betroffen sind v.a. ältere Patienten, die mit potenten Statinen behandelt werden.
- Das kardiovaskuläre Risiko von Patienten mit DM wird durch Statine erheblich reduziert.
- Statine führen nicht zu einer Verschlechterung der Diabetes-Einstellung/Zunahme mikrovaskulärer Komplikationen.
Quellen/Links
- www.agla.ch
- https://www.escardio.org/Guidelines/Clinical-Practice-Guidelines/2021-ESC-Guidelines-on-cardiovascular-disease-prevention-in-clinical-practice
PD Dr. Stefan Bilz, Prof. Dr. Hans Rickli, Prof. Dr. Dr. h.c. Walter Riesen