化學實驗(二)
實驗十一 肥皂的製作及其性質
一、目的
利用皂化及鹽析法,由油脂製造肥皂,並比較肥皂及合成清潔劑的性質。
二、原理
植物油和動物脂肪都是脂肪酸和甘油(1,2,3-丙三醇)所形成的酯類化合物,絕大多數天然的脂肪酸分子沒有支鏈,含 4 至 28 個且為偶數的碳原子。油脂可在鹼性水溶液中發生水解反應,分解成為甘油和脂肪酸鹽,也就是肥皂,此反應又被稱為皂化反應saponification:
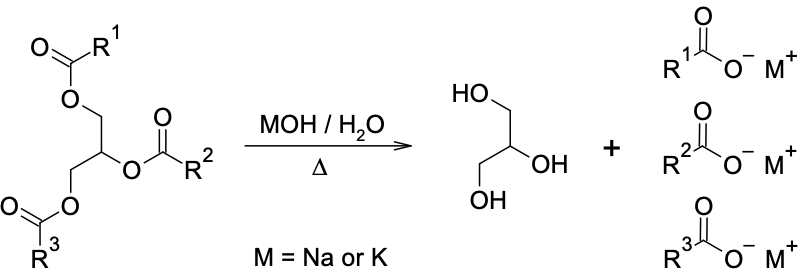
本實驗利用煮皂法,將油脂與氫氧化鈉溶液共熱,生成肥皂及甘油。當加入氯化鈉溶液時,肥皂溶解度降低而從水溶液中析出,此過程稱為鹽析(salting out)。
鈉肥皂或鉀肥皂均能溶於水,肥皂一端長碳鏈的部分為親油性;另一端為羧酸根陰離子為親水性,屬於陰離子介面活性劑。肥皂的介面活性容易受鈣、鎂及多種金屬陽離子影響,甚至形成難溶的脂肪酸鹽。
市售合成清潔劑多為數種界面活性劑的混合物,常使用的陰離子界面活性劑如:
- 含長碳氫鏈的硫酸酯鈉鹽
R-OH + H2SO4 → R-OSO3H + H2
R-OSO3H + NaOH → R-OSO3−Na+ + H2O
- 長鏈烷基苯磺鈉鹽
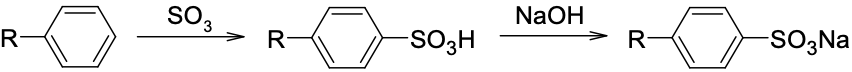
肥皂為強鹼弱酸性鹽類,水溶液呈鹼性,上述合成清潔劑則為強酸強鹼性鹽類,水溶液呈中性。根據不同的用途,市售肥皂和清潔劑均可能含有調整酸鹼度的添加物。
三、器材及藥品
器材:
試管、100、250 mL燒杯、抽氣過濾裝置、10、100 mL量筒、電磁加熱攪拌器、玻璃棒、滴管
藥品:
椰子油、氫氧化鈉、乙二醇、氯化鈉、市售肥皂、液體洗潔精、5% MgCl2、5% FeCl3、5% CaCl2、8% NaOH水溶液
實驗安全注意事項:
氫氧化鈉具腐蝕性,如不慎接觸皮膚需以大量清水沖洗。
四、實驗步驟
肥皂的製造
-
取 250 mL 燒杯,加入約 2 g 的 NaOH,加入約 8 mL 水溶解。秤取約 4 g 椰子油,加入NaOH 溶液中,再加入約 8 mL 乙二醇。
-
溫和加熱溶液使其沸騰,需攪拌避免突沸,並適時加水,以免乾涸。
-
加熱至油滴完全消失,皂化反應完成,結束加熱令其冷卻。
-
秤取約 30 g 的 NaCl,以約 150 mL 水溶解。
-
將肥皂水溶液倒入 NaCl 溶液中,攪拌使肥皂析出。
-
以抽氣過濾法過濾,再以 2-3 mL 冰水洗滌 2-3 次並壓乾,即得肥皂。
肥皂及合成清潔劑之性質
-
配製 A、B、C 三種溶液
A:取約 0.5 g 自製肥皂,溶於 50 mL 熱水
B:取約 0.5 g 市售肥皂,溶於 50 mL 熱水
C:取約 0.5 mL 液體洗潔精,溶於 50 mL 熱水
-
金屬鹽類試驗:
(a) 取 3 支清潔試管,分別加入 5 mL 的 A、B、C 三種溶液。
(b) 於各試管中分別加入 1 mL 的 5% CaCl2 水溶液,充分震盪後觀察其結果(如起泡、沉澱等現象)。
(c) 改用 5% MgCl2 及 5% FeCl3 水溶液,做同樣試驗,觀察其結果。
-
乳化試驗:
(a) 取 3 支清潔的試管,分別加入 5 mL 的 A、B、C 三種溶液。
(b) 於各試管中分別加入 2-3 滴植物油,充分震盪後靜置,觀察油水是否互溶。
(c) 另取 2 支清潔的試管,分別加入 5 mL 的水及 5 mL 的 8% NaOH 溶液,再滴入 1-2 滴植物油,震盪後觀察其結果。
-
使用液體洗潔精將實驗器材上的油脂確實洗乾淨
-
廢棄物分類回收:
-
肥皂→指定收集桶
-
8% NaOH乳化試驗 →無機–鹼性水溶液
-
氯化鐵試驗→無機–重金屬水溶液
-
五、實驗結果
金屬鹽類試驗:
| A 自製肥皂 | B 市售肥皂 | C 液體洗潔精 | |
| CaCl2 |
|
||
| MgCl2 |
|
||
| FeCl3 |
|
乳化試驗:
| A 自製肥皂 | B 市售肥皂 | C 液體洗潔精 | H2O | 8% NaOH |
|
|
市售肥皂廠牌品名:____________________
液體洗潔精廠牌、品名:____________________
成份:________________________________________
六、問題與討論
-
肥皂與合成清潔劑的性質有何不同?
-
本實驗中油脂加乙二醇之目的何在?
-
列表記錄實驗結果,並根據實驗結果說明並討論原因。
