化學實驗(二)
實驗十四 同離子效應與鹽效應
一、目的
測定酒石酸氫鉀(potassium hydrogen tartrate, KHTar)於不同溶劑中之溶解度,並計算 KHTar 之溶解度積常數(![]() )。
)。
二、原理
根據熱力學,鹽類 AnBm在液體中之溶解度積為
![]()
![]()
其中 a 為物質的活性。當溶液中的離子濃度很低時,我們可用離子的體積莫耳濃度取代離子的活性,將上式簡化為 ![]() 。
。
當溶夜中同時存在相同的離子( ![]() 或
或 ![]() )時,鹽類的
)時,鹽類的 ![]() 值維持不變,但其溶解度會因此而降低,此現象被稱為同離子效應 common ion effect。
值維持不變,但其溶解度會因此而降低,此現象被稱為同離子效應 common ion effect。
當溶液濃度提高,不再是稀薄的水溶液時,因溶夜中離子-離子、離子-水分子間作用力的改變無法被忽略,使得離子的體積莫耳濃度和離子活性發生偏差,此時我們可用以下方法來得知離子的活性,用以進行相關的平衡計算:
- 溶液中離子和分子間作用力的改變程度可用「離子強度」(ionic strength)描述,離子強度
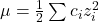
ci 為溶夜中離子 i 的體積莫耳濃度,zi 為其所帶電荷 - 根據計算所得的溶液離子強度,可查表得知溶液中某離子的活性係數
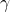 ,其活性
,其活性 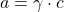
活性係數的值會受離子本身性質以及溶液的離子強度影響。
舉例說明
【問題】以 0.0125 M 的 MgSO4 水溶液為溶劑,加入難溶鹽類 CaF2 (![]() = 3.9×10-11),求溶夜中 Ca2+ 和 F– 的濃度?
= 3.9×10-11),求溶夜中 Ca2+ 和 F– 的濃度?
【解】
-
因為 Mg2+ 和 SO42– 的濃度高出 Ca2+ 和 F– 甚多,在計算溶液離子強度時僅考慮 Mg2+ 和 SO42–
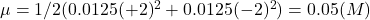
-
查表可知在
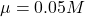 時,Ca2+ 和 F– 的活性係數
時,Ca2+ 和 F– 的活性係數 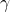 分別為 485 和 0.81
分別為 485 和 0.81 -
![Rendered by QuickLaTeX.com K_{sp}=a_{Ca^{2+}} \cdot a^2_{F^-}=( \gamma _{Ca^{2+}} \cdot [Ca^{2+}] ) \cdot ( \gamma _{F^{-}} \cdot [F^{-}] ) ^2](https://pressbooks.pub/app/uploads/quicklatex/quicklatex.com-e5c3fae7e5402ee3f39d6b80628e7908_l3.png)
![]()
可求得 [Ca2+] = 3.1×10-4 M,[F–] = 6.2×10-4 M
【討論】
若不考慮 MgSO4 造成離子的活性改變,直接使用上面求得的 Ca2+ 和 F– 濃度計算,會得到 ![]() = 1.2×10-10,是以純水作為溶劑時的三倍,溶解度變為約 1.5 倍。這種因為溶液中其他電解質的存在,造成鹽類樣品溶解度提高的現象被稱為「鹽效應」。
= 1.2×10-10,是以純水作為溶劑時的三倍,溶解度變為約 1.5 倍。這種因為溶液中其他電解質的存在,造成鹽類樣品溶解度提高的現象被稱為「鹽效應」。
本實驗將以滴定法測定不同溶劑中酒石酸氫鉀(HOOC(CHOH)2COOK, hydrogen potassium tartrate, KHTar)的溶解度,並探討溶劑對溶解度積的影響。
KHTar(s) ![]() K+(aq) + HTar−(aq)
K+(aq) + HTar−(aq)
HTar−(aq) + OH–(aq) → Tar2–(aq) + H2O(l)
三、器材及藥品
器材:
250 mL 錐形瓶、250 mL 燒杯、玻棒、滴定管
藥品:
酒石酸氫鉀、0.10 M NaNO3、0.10M KNO3、0.10 M NaOH 水溶液、酚酞指示劑
四、實驗步驟
-
秤取各 2 g 左右的 KHTar 三份,將此三份 KHTar 置於各不同之 250 mL 錐形瓶內,各加入 150 mL 的水、0.10 M NaNO3、0.10M KNO3 水溶液,並標示以便識別。
-
搖動各瓶溶液至少 15 分鐘,然後將各瓶靜置桌上,使未溶解之固體沉澱。測定並記錄下各瓶溶液之溫度。以重力過濾法將各瓶澄清液部分過濾至各別的燒杯中。
-
取二個錐形瓶,用水洗淨(注意不可有固體殘留),再用少量濾液潤洗。二錐形瓶分別以移液吸管準確量取加入第一組 KHTar 濾液 50 mL,並各加二滴酚酞指示劑。
-
以 0.10 M NaOH 水溶液滴定至淡紅色終點為止。
-
重複步驟 3.-4.,滴定第二、第三組 KHTar 濾液。
-
由所測數據,計算在此三種不同溶劑中,KHTar 之溶解度(以M表示,取各溶液二次滴定結果之平均值),並由各溶液的溶解度計算 KHTar 之
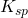 值。
值。 -
廢棄物分類回收:未用完之 NaOH 水 溶液 → 無機–鹼性水溶液
五、實驗結果
| H2O | 0.10 M NaNO3 | 0.10 M KNO3 | ||||
| 飽和 KHTar 溶液之溫度(˚C) | ||||||
| 被滴定之飽和 KHTar 濾液之體積(mL) |
|
|||||
| 0.10 M NaOH 水溶液使用量(mL) |
|
|||||
| HTar– 量(mol) |
|
|||||
| KHTar 溶解度(M) |
|
|||||
| KHTar 溶解度平均值(M) |
|
|||||
| Ksp * |
|
|||||
* 以離子的濃度直接計算
六、問題與討論
-
(a) 計算 0.10 M 的硝酸鈉和硝酸鉀溶液的離子強度;
(b) 利用下表,找出鉀離子在這兩種溶劑中的活性係數;
(c) 根據你的實驗結果,計算在 0.10 M 硝酸鈉溶劑中,酒石酸氫根離子的活性係數。
-
在本實驗中,使用 0.10 M 的硝酸鉀作為溶劑,除了同離子效應外,鹽效應是否存在?請參照實驗結果,說明你的看法。
不同離子強度溶夜中,離子的活性係數

