化學實驗(一)
實驗五 水溶液中鈣離子的定量
一、目的
利用 EDTA 鉗合滴定法以分析水溶液中鈣離子的含量。
二、原理
EDTA(ethylenediaminetetraacetic acid , 乙二胺四乙酸)是廣泛使用的金屬鉗合試劑(chelating agent,或稱螯合試劑),其結構如下:

其中兩個氮原子和四個解離後的羧酸基(–COO–)皆能提供孤電子對與多種金屬離子形成穩定的錯合物。若以 H4Y 表示 EDTA,則其解離方程式可寫為:
當 pH 3 至 6 時,EDTA主要以 H2Y2– 的型態存在,當 pH > 10 時則為 Y4− 型態,更容易和金屬結合,然而 pH值並不宜太高,否則許多金屬離子可能形成氫氧化物沉澱。在滴定鈣離子時,以 pH 10 左右最為合適。
在 EDTA 滴定中我們仰賴錯合指示劑來判斷滴定終點,錯合指示劑本身亦為為一配基或鉗合劑,單獨存在或與金屬結合會呈現不同的顏色。在 EDTA 滴定中,使用的金屬指示劑與金屬的結合能力較 EDTA 弱,因此當 EDTA 加入金屬指示劑錯合物時,EDTA 會逐漸取代指示劑而與金屬結合:
Y4− + Mn+In → MY n-4 + In In = 指示劑
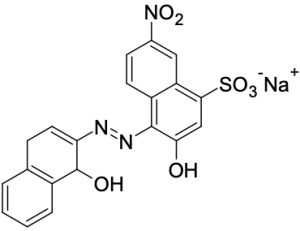
當達到滴定終點時,溶液會呈現單獨存在型態的指示劑顏色。在滴定鈣離子時最常用的指示劑為 Eriochrome Black T,簡稱 EBT 指示劑,在 pH 10 環境中,其自由型態為藍色,和鈣離子結合後則為紅色,操作上有時會添加少量鎂離子作為輔助。EBT 指示劑的結構如下:
三、器材及藥品
器材:
100 mL 及 500 mL 量瓶、吸量管、量筒、錐形瓶、滴定管
藥品:
EDTA 二鈉鹽(Na2H2-EDTA·2H2O,分子量 372.25 g/mol)、 0.01 M EDTA 二鉀鎂鹽(K2Mg-EDTA·2H2O,分子量 426.75 g/mol)、0.1 M CaCl2、EBT 指示劑溶液、pH 10 緩衝溶液(NH4OH / NH4Cl)、未知濃度 CaCl2 溶液
注意 勿使用自來水配製溶液
四、實驗步驟
-
用吸量管取 0.1 M CaCl2 溶液 10 mL,使用量瓶將其稀釋為 100 mL 的 0.01 M CaCl2 溶液。
-
使用量瓶配製 0.01 M EDTA 二鈉鹽溶液 500 mL。(三組共用一份)
-
用吸量管取 0.01 M CaCl2 溶液 20 mL 置於 250 mL 錐形瓶中,加水稀釋至約 100 mL,加 pH 10 緩衝溶液 2 mL、2-3 滴 EBT 指示劑和 0.01 M EDTA 二鉀鎂鹽溶液 1 mL。用 EDTA二鈉鹽溶液滴定。*
-
用吸量管取 0.01 M CaCl2 溶液 20 mL置於250 mL錐形瓶中,加水稀釋至約 100 mL,加 pH 10 緩衝溶液 2 mL和 2-3 滴EBT指示劑,但不加 EDTA 二鉀鎂鹽溶液。用 EDTA 二鈉鹽溶液滴定。
-
預測滴定 CaCl2 標準溶液所需之 EDTA 量,並比較兩種滴定方法的差異,選擇一種作為滴定未知溶液用。
-
取未知濃度 CaCl2 溶液 20 mL,使用你選擇的方法滴定之,並計算其中 Ca2+ 濃度。
* 終點的顏色變化為:紅→藍,以完全沒有紅色做為終點。在終點附近的顏色變化較慢,須小心緩慢滴定!
初學者常誤以紅紫色為終點。可取 pH 10 緩衝溶液 1 mL 稀釋至 50 mL 並加入EBT指示劑、EDTA二鈉鹽溶液各一滴,做為鑑別顏色之用。
五、實驗結果
EDTA標定
預估EDTA二鈉鹽用量 _________ mL
| EDTA 二鈉鹽用量 | 平均用量 | |
| 添加 K2Mg-EDTA | mL | mL |
| mL | ||
| 不添加 K2Mg-EDTA | mL | mL |
| mL |
未知濃度測定
| EDTA 二鈉鹽用量 | 平均用量 | |
| □ 添加 K2Mg-EDTA | mL | mL |
| □ 不添加 K2Mg-EDTA | mL |
未知溶液中 Ca2+ 濃度為 _________ M
六、問題與討論
-
滴定已知濃度 CaCl2 溶液時,添加或不添加 K2Mg-EDTA 對滴定過程與結果有何影響?為什麼?
-
請敘述你選擇添加或不添加 K2Mg-EDTA 的理由?
-
請推測當被滴定的溶液的 pH值為 12 時,實驗可能受到那些影響?
-
請查閱自來水公司公布之水質資料,本地最近自來水中鈣濃度為何?若實驗使用的 EDTA溶液、樣品溶液皆是使用自來水配制,會造成什麼樣的誤差?假設實驗使用的逆滲透水中鈣離子的濃度可忽略。
如果也將自來水中可和 EDTA 錯合的鎂及其他過渡金屬離子也列入考慮,誤差會更大嗎?
