化學實驗(二)
實驗十七 質子交換膜燃料電池
一、目的
學習質子交換膜燃料電池的構造與操作。
二、原理
燃料電池是經由電化學反應而非燃燒與機械轉換的過程,從燃料獲取電能的裝置。氫氧燃料電池根據選用的反應、操作條件與結構設計可分為許多不同的形式,本實驗選擇使用結構簡單、能在常溫下操作的質子交換膜燃料電池(proton exchange membrane fuel cell, PEMFC),其結構如下圖所示:
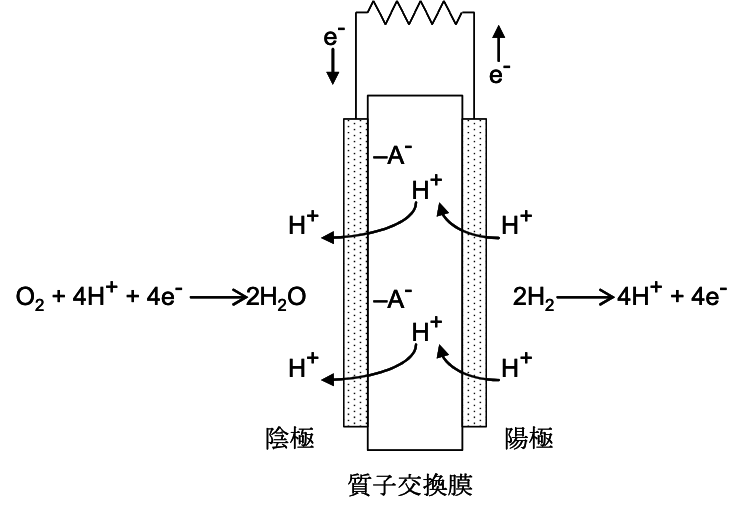
陰極與陽極分別消耗氧氣與氫氣產生電能和水,充電時則是發生逆反應,將水電解為氫氣與氧氣。
在氫氧燃料電池中,電子無法經由水和質子交換膜傳導,而是經由導線由陽極傳導致陰極,而陽極產生的質子(氫離子)則可通過質子交換膜傳至陰極,形成完整的電力迴路。在本實驗中我們使用的質子交換膜材質是具有磺酸官能基(圖中 –AH = –SO3H)的有機聚合物,有很高的解離常數,能有效提供並傳導質子。
我們可以由熱力學中 Gibbs 自由能與化學反應中反應商的關係式,推導出Nernst公式:
![]()
其中 E 和 E° 分別為實驗時與標準狀態下之電化學電池電位,R 為氣體常數、T 為絕對溫度、F 為法拉第常數、n 為電化學反應式中交換的電子數,Q 為反應商。但在實驗中常會發現,所測得的電池電位和理論值不同,如電解所需電位差大於理論值的 overpotential 現象,或電池所能提供的電位差小於理論值。此現象可歸因於電極材料本身特性;電極和反應物、產物之間的親和力;電極表面的反應物或產物濃度改變等因素。
三、器材及藥品
器材:
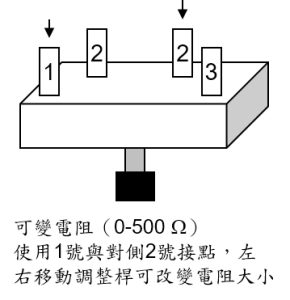
質子交換膜燃料電池組件(如圖,含兩具水/氣體儲存槽、由塑膠外殼、兩片電極和質子交換膜組成的電池)、燒杯、直流電源供應器、三用電表、可變電阻

藥品:
RO水(或去離子水、蒸餾水)
四、實驗步驟
-
檢查燃料電池零件、結構是否完整。
-
將燃料電池本體一端排放口的橡皮塞取下,將蒸餾水注入水/氣體儲存槽至水由排放口流出。蓋回橡皮塞。
-
同步驟2.,將蒸餾水裝填至另一儲存槽。
-
將直流電源供應器的輸出電壓歸零,燃料電池的氫氣端電極與直流電源供應器的 “–” 端連接,氧氣端電極與電源供應器的 “+” 端連接。
-
開啟直流電源供應器,調整輸出電壓至 1.8 V,將燃料電池充電至收集氫氣和氧氣各約 12 mL 和 6 mL。關閉直流電源供應器並撤除充電用電路。注意:電壓不可超過 2.0 V,以免損壞電池。
-
使用三用電表直接量測燃料電池兩電極間的電位差,此時電池的負載可視為無限大。[1]
-
依電路圖接上可變電阻與三用電錶,測量在不同的負載下,電池所提供的電位差與電流大小,並繪製電位差/電流關係圖(取 8 組數據)。

-
重複步驟 2.-5.。電解完成後,拔開氧氣儲存槽與電池的連接軟管,打開電池氧氣側的排放口,將電池氧氣側的氣體由純氧氣換為空氣。
-
接上量測電路約二分鐘後,重複步驟 6.-7.
五、實驗結果
-
負載無限大時,燃料電池兩電極間的電位差
O2/H2 V
Air/H2 V
-
燃料電池輸出的電位差與電流關係
| O2/H2 | Air/H2 | ||
| 電位差 | 電流 | 電位差 | 電流 |
|
|
|||
|
|
|||
|
|
|||
|
|
|||
|
|
|||
|
|
|||
|
|
|||
|
|
|||
六、問題與討論
-
使用試算表軟體繪製「電位差-電流」關係圖。
-
試由實驗結果計算電池最大輸出功率,以及在最大輸出功率時的電位差與電流大小。該電位差和量測到的最大電位差是否相等?
-
(a) 使用 Nernst 公式分別計算 O2/H2 和 Air/H2 燃料電池所能提供的電位差理論值。(b) 實驗所得 O2/H2 和 Air/H2 燃料電池的電位差是否相同?
-
在本實驗的氫氧燃料電池中,為何可使用導電度非常低的蒸餾水或去離子水,而不用加入其他電解質(如酸、鹼或鹽類)?若取消質子交換膜裝置將有何影響?
- 量測電壓時電錶的電阻非常大,若電路中僅有電池和量測電位差的電錶,電池的內電阻可忽略,且電流非常小,電池內的反應速率非常慢。此時所測得的是該電池所能提供的最大電位差。 ↵
