化學實驗(二)
實驗二十一 酵素催化反應
一、目的
由酵素催化反應中產物濃度與時間的關係,進行簡單動力學分析,並認識酵素催化反應基本特性。
二、原理
催化劑能藉由改變反應途徑而改變化學反應的速率,但無法改變化學反應的熱力學特性與平衡。生物體內維持生命所需的物質與能量,絕大多數藉由催化劑來控制特定化學反應來產生,這些催化劑大多是蛋白質,被稱為酶或酵素(enzyme)。因為蛋白質分子的性質會受到環境,如酸鹼、溫度、溶液中其他分子影響,所以酵素必須在特定環境下才能表現活性(催化反應的能力)。
德國化學家 L. Michaelis 和 M. Menten 曾提出一簡單的酵素催化反應的化學動力學模型:
E:酵素 ; S:反應物(substrate)
E + S → ES rate = k1[E][S]
酵素和反應物結合成為複合物(complex)
ES → E + product rate = k2[ES]
複合物發生反應
ES → E+S rate = k1’[ES]
複合物可能未發生反應就分解
產物生成速率 = k2[E]0[S]/(KM+[S])
[E]0 為酵素總濃度;KM=( k1’ + k2)/ k1
本實驗使用的酵素是辣根過氧化物酶(Horseradish peroxidase, HRP,分子量約 34 kDa),能催化過氧化物對芳香環類化合物的氧化反應,我們可選擇具有特殊顏色的產物或反應物以便觀察。實驗所選用的催化反應:
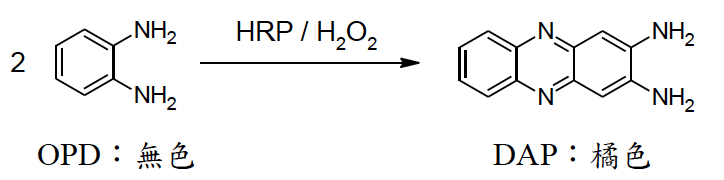
無色的鄰苯二胺(o-phenylenediamine, OPD)與過氧化氫間的氧化反應速率極慢,若被辣根過氧化物酶催化,則可快速形成橘色的 2,3-二胺基吩嗪(2,3-diaminophenazine, DAP)產物。這是一個常被應用在生化檢測上的催化反應。
本實驗中我們將在不同反應時間,使用分光光度計觀察溶液中 DAP 對波長 470 nm 的光的吸收,利用比爾定律可簡單獲得反應期間各時間點溶液中 DAP 的濃度。
三、器材及藥品
器材:
滴管、試管、分光光度計(spectrophotometer)、塑膠製比色槽(cuvette)
藥品:
鹽酸鄰苯二胺(o-phenylenediamine (OPD) dihydrochloride)
、辣根過氧化物酶(Horseradish peroxidase, HRP)
、2-(N-嗎啉)-乙基磺酸(2-(N-morpholino)ethane sulfonic acid, MES)/ 鈉鹽混合物(MES hemisodium salt)
、過氧化氫
四、實驗步驟
溶液配製(助教及指定同學統一配製)
-
0.05 M 2-(N-嗎啉)-乙基磺酸緩衝溶液(MES buffer),pH ≈ 6.1
-
使用 MES buffer 配製 0.25 mM 鹽酸鄰苯二胺(OPD)溶液。
-
使用 MES buffer 配製 5.5 nM 辣根過氧化物酶(HRP)溶液。
-
~3% 過氧化氫水溶液。
分光光度計校正
-
參考附錄(五)將分光光度計波長設定為 470 nm,使用 MES buffer 進行 100%T/0A(光百分之百穿透/無吸收)和 0%T(無光穿透)校正。將偵測模式設定為 A(吸收度)。
酵素催化反應偵測
Part I.
-
乾淨試管中加入 OPD 溶液 6.0 mL,以滴管加入兩滴稀釋過氧化氫水溶液(勿多加)。
-
加入 HRP 溶液 1.0 mL,搖搖晃試管使其混合均勻,開始計時。
-
取反應溶液置入乾淨比色槽,裝至約八分滿,放入分光光度計開始量測。由反應開始 20 秒後,每隔 20 秒記錄吸收度值,紀錄 5 分鐘,之後改為每 60 秒記錄一次。偵測時間共計 10 分鐘。
-
取出比色槽,勿倒掉裡面反應溶液,保留讓其繼續反應,待步驟 16. 使用。
Part II.
-
乾淨試管中加入 OPD 溶液、MES buffer 各 3.0 mL,以滴管加入兩滴稀釋過氧化氫水溶液。
-
重複步驟 7.-8.。
-
取出比色槽,丟棄反應溶液,以滴管吸取蒸餾水約 2 mL 清洗三次。
Part III. 加熱對酵素催化反應的影響
-
HRP 溶液 1.0 mL 置於乾淨試管中,於 70-100°C 之熱水浴中加熱約 3 分鐘,取出冷卻。
-
加入 OPD 溶液 6.0 mL、兩滴稀釋氧化氫水溶液,搖搖晃試管使其混合均勻,開始計時。
-
重複步驟 8.。
Part IV. 產物最終吸收偵測
-
將步驟 9. 中保留,裝有反應溶液的比色槽放入分光光度計中量測。
-
假設此時 OPD 已完全被氧化為 DAP,由溶液中 OPD 濃度計算 DAP 濃度,並求出比爾定律公式 A = ε × l × c 中 ( ε× l ) 之值。
-
整理並歸還分光光度計、比色槽。
五、 實驗結果
吸收度:
| 20 s | 40 s | 60 s | 80 s | 100 s | |
| Part I. |
|
||||
| Part II. |
|
||||
| Part III. |
|
| 120 s | 140 s | 160 s | 180 s | 200 s | |
| Part I. |
|
||||
| Part II. |
|
||||
| Part III. |
|
| 220 s | 240 s | 260 s | 280 s | 300 s | |
| Part I. |
|
||||
| Part II. |
|
||||
| Part III. |
|
| 360 s | 420 s | 480 s | 540 s | 600 s | |
| Part I. |
|
||||
| Part II. |
|
||||
| Part III. |
|
Part IV.
最終吸收度 Afinal =
OPD 全部反應變為 DAP,則樣品溶液中 [DAP]final = mM
代入 Afinal = ε × l × [DAP] final,可得 ( ε× l ) =
六、實驗數據處理:(建議使用試算表軟體簡化工作)
利用計算出之 ( ε× l ) 值,將實驗記錄中的吸收度換算為 DAP 產物濃度(或 OPD 反應物濃度,[OPD]t = [OPD]0 – 2 × [DAP]t )
[DAP](或 [OPD],擇一計算):
| 20 s | 40 s | 60 s | 80 s | 100 s | |
| Part I. |
|
||||
| Part II. |
|
||||
| Part III. |
|
| 120 s | 140 s | 160 s | 180 s | 200 s | |
| Part I. |
|
||||
| Part II. |
|
||||
| Part III. |
|
| 220 s | 240 s | 260 s | 280 s | 300 s | |
| Part I. |
|
||||
| Part II. |
|
||||
| Part III. |
|
| 360 s | 420 s | 480 s | 540 s | 600 s | |
| Part I. |
|
||||
| Part II. |
|
||||
| Part III. |
|
繪製 DAP 產物(或 OPD 反應物)「濃度對反應時間」關係圖
七、問題與討論
-
在何種情況下,描述酵素催化反應的 Michaelis-Menten 公式能被簡化為反應速率速率 = (a) k2[E]0[S]/KM 或 (b) k2[E] 0 ?
-
你的實驗結果可套用上題中哪一個簡化公式?你是如何判斷的?
-
在使用分光光度計進行量測時,(a). 樣品室蓋子為何要保持關閉? (b). 為何在實驗前,進行吸收度讀數歸零校正時用的是 MES buffer?
