化學實驗(一)
實驗一 食醋中醋酸的測定
一、目的
使用中和滴定法測定食醋中的醋酸。
二、原理
為了測定溶液中的酸含量,我們必須使用標準鹼溶液來滴定,但常用的強鹼如氫氧化鈉和氫氧化鉀固體易吸收空氣中的水氣而潮解,其固體和溶液都會吸收大氣中的二氧化碳而發生中和反應形成碳酸鹽,因此強鹼溶液在配製後還需要對其濃度進行標定。此外強鹼溶液會和玻璃緩慢反應,所以強鹼溶液除了不可長久暴露於空氣中,長時間儲存則需使用聚乙烯(PE )之類聚合物材質的容器或表面塗有石蠟的玻璃瓶。
標準鹼溶液的精確濃度則需藉由純度在 99.9% 以上純度的一級試劑滴定來決定,此一過程稱為標定,常用的試劑有鄰苯二甲酸氫鉀(KHP )、碘酸氫鉀 KH(IO3)2 和苯甲酸等,這些試劑需具有高純度、在空氣中穩定、不易吸水潮解、分子量較大(稱量時的誤差影響較小)等特性。本實驗使用的鄰苯二甲酸氫鉀為單質子弱酸,以氫氧化鈉溶液滴定時選用酚酞為指示劑。滴定過程應盡量避免二氧化碳介入造成誤差。
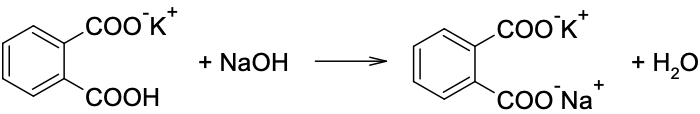
食醋的總酸含量可藉標準鹼滴定來測定。食醋中的酸類分子絕大多數為醋酸,故分析結果通常用醋酸來代表。一般的食醋約含 5% 醋酸。
三、器材及藥品
器材:
250 mL 燒杯、250 mL 錐形瓶、滴定管、10 mL 吸量管
藥品:
0.1 N 氫氧化鈉溶液 、 鄰苯二甲酸氫鉀(potassium hydrogen phthalate, KHP, COOHC6H4COOK)、 酚酞指示劑 、 食醋
四、實驗步驟
標定氫氧化鈉溶液
-
滴定管潤洗後加入氫氧化鈉溶液。
-
空白試驗:取 50 mL 蒸餾水加入 2 滴指示劑,緩慢滴入氫氧化鈉溶液,輕輕晃動溶液使其混合均勻,溶液由無色變為粉紅色,且 20 秒內不褪色為滴定終點。紀錄氫氧化鈉溶液用量。
-
精稱約 0.6 g 已烘乾的KHP,分別放入不同之 250 mL 錐形瓶中,分別以 50 mL 蒸餾水溶解,並加入 2 滴酚酞指示劑。
-
以氫氧化鈉溶液滴定 KHP 溶液。如果超過滴定終點,可用已知濃度的 HCl 溶液逆滴定之。紀錄氫氧化鈉溶液用量。
-
計算氫氧化鈉濃度,須扣除空白試驗所消耗的氫氧化鈉溶液。
-
重複步驟 1-5
食醋中醋酸含量測定
-
以吸量管取 2.0 mL 食醋置於 250 mL 錐形瓶中。加入 50 mL 蒸餾水,並加入 2 滴酚酞指示劑。
-
以氫氧化鈉溶液滴定至終點,紀錄所使用的氫氧化鈉溶液。
-
計算食醋中醋酸含量
-
重複步驟 7-9
-
廢棄物分類回收:未用完之氫氧化鈉溶液 → 無機–鹼性水溶液
五、實驗結果
空白實驗
| 第一次 | 第二次 | |
| 蒸餾水體積(mL) |
|
|
| 滴定前滴定管讀數 |
|
|
| 滴定終點滴定管讀數 |
|
|
| 使用氫氧化鈉體積(mL) |
|
平均使用氫氧化鈉 mL
標定氫氧化鈉溶液
| 第一次 | 第二次 | |
| KHP重量(g) |
|
|
| KHP莫耳數(mol) |
|
|
| 滴定前滴定管讀數 |
|
|
| 滴定終點滴定管讀數 |
|
|
| 使用氫氧化鈉體積(mL ) |
|
|
| 扣除空白實驗之氫氧化鈉體積(mL) |
|
|
| 氫氧化鈉濃度(M) |
|
氫氧化鈉當量濃度平均值 N
食醋中醋酸含量測定
食醋商品名稱 (密度以 1.04 g/cm3計)
| 第一次 | 第二次 | |
| 食醋體積(mL) |
|
|
| 滴定前滴定管讀數 |
|
|
| 滴定終點滴定管讀數 |
|
|
| 使用氫氧化鈉體積(mL) |
|
|
| 扣除空白實驗之氫氧化鈉體積(mL) |
|
|
| 醋酸量(mol) |
|
|
| 醋酸濃度 |
% |
% |
醋酸濃度濃度平均值 %
六、問題與討論
-
滴定時指示劑的用量應否限制?太多或太少對實驗有何影響?
-
你覺得本實驗方法是否適合用於測定烏醋,為什麼?
-
空白試驗之目的為何?
-
滴定時為何使用錐形瓶而非燒杯?
-
在有關滴定技術的敘述中,常見「當量濃度」一詞,其單位為 N,請自行查閱資料並簡單解釋之。
