BEHANDLING (REV 015, REV 033, REV 050, REV 055, REV 078, REV 079)
236 CAR T-cellebehandling og Kimerisk antigenreseptor-T-celleterapi. BiTEs «Bispecific T-cell Engagers». Eksperimentell immunsupressiv behandling
Øyvind Palm and Ragnar Gunnarsson
Eksperimental immunosupressiv behandling
Dette kapitlet omhandler to nye behandlingsformer som har et stort potensiale innen deler av revmatologen; 1) CAR T-cellebehandling og 2) Kimerisk antigenreseptor-T-celleterapi (BiTEs)
1. CAR T-cellebehandling
Oversikt
Kimerisk antigenreseptor-T-celleterapi (CAR T-cellebehandling) er en ny og svært effektiv behandlingsmetode som er under utprøving innen revmatologi. Den er ikke en etablert behandling for revmatiske sykdommer, men under utprøving for enkelte av de mest alvorlige tilfellene. CAR T-terapi er inntil nylig hovedsakelig utviklet og brukt for behandling av visse typer kreft, spesielt blodkreft (June CH, 2018).
Noen av de potensielle fordelene med CAR T-terapi for revmatiske sykdommer inkluderer:
- Målrettet behandling: CAR T-celler kan programmeres til å angripe spesifikke celler som er involvert i sykdomsprosessen, noe som kan føre til mer presis og effektiv behandling med færre bivirkninger sammenlignet med tradisjonelle medisiner.
- Potensielt langvarig effekt: CAR T-celleterapi har potensial til å gi langvarig sykdomsbekjempelse, da de modifiserte cellene kan forbli i kroppen og fortsette å bekjempe sykdommen over tid.
- Persontilpasset behandling: CAR T-celleterapi kan potensielt skreddersys for hver enkelt pasient, basert på deres spesifikke sykdom og immunrespons.
Utfordringer: Det er fortsatt mange utfordringer som må overvinnes før CAR T-terapi kan bli en realitet for revmatiske sykdommer. Noen av disse utfordringene inkluderer:
- Identifisering av riktige mål: Det er viktig å identifisere de spesifikke cellene og molekylene som er ansvarlige for sykdomsprosessen ved hver revmatisk sykdom for å kunne utvikle effektive CAR T-celler.
- Sikkerhet: CAR T-celleterapi kan forårsake alvorlige bivirkninger som cytokinfrigjøringssyndrom/MAS og nevrotoksisitet. Det er viktig å utvikle strategier for å minimere disse risikoene.
- Kostnad: CAR T-celleterapi er en svært kostbar behandling, og det er viktig å finne måter å gjøre den mer tilgjengelig for pasienter.
Definisjon
Kimerisk antigenreseptor T-celleterapi (CAR T cellebehandling) benytter genteknologi til å modifisere pasientens egne T-celler, slik at de gjenkjenner og angriper spesifikke antigener på overflaten av B-celler. CAR T-cellebehandling ble opprinnelig utviklet for kreftbehandling, spesielt mot B-celle leukemi og lymfom (Schuster SJ, 2017).
Effekt ved systemisk lupus (SLE): Rettet mot CD-19 celler (anti-CD-19 CAR T) har CAR T-behandling av alvorlig SLE vist lovende resultater. Kliniske effekter inkluderer remisjon av sykdomsaktivitet målt ved SLEDAI, DORIS og LLDAS kriterier i løpet av 3-6 måneder, normalisering av anti-DNA- antistoffer i blodet (serokonversjon) og komplement-C3-nivåer, samt betydelig reduksjon av proteinutskillelse i urinen ved lupusnefritt. Fordi CAR T-cellene kan passere blod-hjerne barrieren forventes effekt også på CNS-lupus.
Fordeler sammenlignet med rituksimab: Sammenlignet med rituksimab antas CAR T-behandling å ha bedre vevspenetrasjon, det vil si evnen til å nå frem til B-celler i lymfeknuter og benmarg. Dette kan forklare den bedre effekten som er observert ved CAR T-behandling av SLE (Kamburova EG, 2013).
Langtidseffekt. Det er fortsatt usikkert om den positive effekten av CAR T-behandling vedvarer over tid. Foreløpige observasjoner etter minst to år (per 2024) tyder imidlertid på at det ikke er tegn til tilbakefall av sykdommen eller behov for ytterligere SLE-medikasjon.
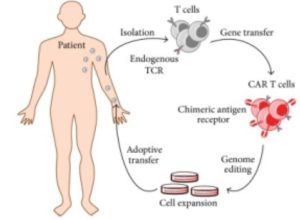
CAR-T-behandlingen i praksis
Behandlingen starter med at T-celler hentes ut fra pasientens blod. Disse cellene blir deretter modifisert i et laboratorium ved hjelp av virus-transfeksjon som er en teknikk som gjør det mulig å introdusere nye gener i cellene. De modifiserte T-cellene (CAR T-celler) blir deretter dyrket opp til et tilstrekkelig antall (1 million celler per kg kroppsvekt) over en periode på 12 dager.
Før CAR T-cellene gis tilbake til pasienten, får pasienten en mild form for cellegift. Dette for å redusere antallet eksisterende immunceller og gi plass til de nye CAR T-cellene. Etter infusjonen av CAR T-cellene får pasienten ytterligere immunsuppresjon for å unngå autoimmune reaksjoner, som cytokinstorm (MAS/HLH) eller immuneffektor-assosiert nevrotoksisk syndrom (ICANS).
Pasienten følges nøye opp de første ti dagene etter behandlingen med regelmessig kontroll av kroppstemperatur, blodtrykk og CRP. Mild feber etter infusjonen er vanlig og antas å være en immunologisk reaksjon på behandlingen. Noen pasienter kan oppleve infeksjoner som urinveisinfeksjon, luftveisinfeksjon eller herpes zoster (Taubmann J, DGRh 2023).
B-cellene som påvirkes
CAR T-cellene angriper en rekke ulike B-celler, inkludert pro-B-celler, pre-B-celler, umodne B-celler, modne B-celler, aktiverte B-celler, hukommelses-B-celler, plasmablaster og plasmaceller. Dette fører til en kraftig reduksjon av B-celler i blodet i løpet av få dager. Langlevende plasmaceller (som er CD19-negative), som produserer antistoffer, blir imidlertid ikke påvirket av behandlingen.
Nivået av CAR T-celler i blodet avtar gradvis, og i løpet av 50-150 dager etter behandlingen vil de naturlige B-cellene vanligvis komme tilbake.
Vaksiner
Observasjoner til nå viser at vaksine-titere som beskytter mot mot meslinger, rubella, kusma, zoster og tetanus påvirkes lite av CAR T-behandlingen. Dette kan skyldes at de langlevende CD19-negative plasmacellene som produserer antistoffer ikke blir undertrykt i samme grad som andre B-celler (Taubmann J, DGRh 2023).
Utprøvende behandling
CAR T-cellebehandling er fortsatt i under utprøving innen revmatologi og er en svært kostbar behandling. Imidlertid oppnås langvarig sykdomsfrihet (remisjon) uten behov for medisiner, samt normalisering av antistoffnivåer over tid. Behandlingen har også et unikt potensiale til helbrede noen av pasientene.
I tillegg til SLE, blir CAR T-cellebehandling utprøvd mot andre revmatiske sykdommer som alvorlige tilfeller av myositt, antisyntetase syndromet, systemisk sklerose (Bergmann C, 2023) og ANCA vaskulitt (Jin X, 2021; Mitra A, 2023). CAR-T-behandling av andre autoimmune sykdommer, fibrose-sykdommer og infeksjoner, i tillegg til kreft kan også bli aktuelt (Baker DJ, 2023).
Cytokin frisettingssyndrom (CRS)
CAR T-cellebehandling medfører mer eller mindre kraftig frigjøring av proinflammatoriske cytokiner (TNF, interferon-γ). Reaksjonen kan forsterkes av endotelceller, monocytter/makrofager (IL6) og en immunologisk kaskade-reaksjon (onkopedia.com).
- Klinisk ses feber og influensa-lignende symptomer.
- I alvorlige tilfeller: hypotoni, respirasjonssviktsvikt og kapillær lekkasje syndrom
- Debut 2-7 dager etter CAR T-behandlingen. Varighet inntil 7-14 dager
- Behandlingen består av febernedsettende (paracetamol), væskeinfusjon og tocilizumab.
Immune effector cell-associated neurotoxicity syndrome (ICANS)
ICANS er en alvorlig nevrologisk bivirkning som kan oppstå etter immunterapi, spesielt etter CAR T-cellebehandling. ICANS er en sjelden, forsinket komplikasjon av Cytokine Release Syndrome (CRS). ved CRS krysser proinflammatoriske cytokiner blod-hjerne-barrieren og forårsaker en “cytokinstorm” i hjernen.
Symptomene kan variere fra mild til livstruende og oppstår vanligvis 1–3 uker etter behandlingen. De omfatter endret mental status med konsentrasjonsvanske og forvirring, afasi, tremor, krafttap, koordinasjonsproblemer, krampeanfall og koma.
Tidlig gjenkjenning av symptomene er avgjørende for rask behandling som vanligvis består av høye doser kortikosteroider (Brudno JM, 2024).
|
Lupus (N=91)
|
SSc (N=22)
|
IIM (N=13)
|
|
|
Effektivitet
|
De fleste pasientene var sykdomsaktivitetsfrie per siste evalueringsdato. Relaps ble rapportert hos en pasient.
|
Stabilisering/forbedring i alle aktuelle områder og reduksjon i mRSS (modifisert Rodnan Skin Score).
|
Kliniske responser hos alle pasientene. Relaps ble rapportert hos en pasient.
|
|
Oppfølgingsperiode
|
>60 måneder
|
1-13 måneder
|
1-18 måneder
|
|
CRS*/MAS
|
Ett tilfelle av høygradig CRS som lot seg behandle.
|
Alle tilfeller var milde, forbigående og reversible.
|
Alle tilfeller var milde, forbigående og reversible.
|
|
ICANS/nevrotoksisitet**
|
To tilfeller av høygradig ICANS; begge ble raskt behandlet.
|
To milde, forbigående tilfeller av ICANS. Ett tilfelle av Grad 3 ICANS.
|
Ett tilfelle av uspesifisert ICANS.
|
|
Infeksjoner
|
Noen alvorlige infeksjoner (virale og lungebetennelser) har blitt rapportert.
|
Noen alvorlige infeksjoner (virale, lungebetennelser) har blitt rapportert.
|
Noen alvorlige infeksjoner (virale, lungebetennelser) har blitt rapportert.
|
|
**Immune Effector Cell-Associated Neurotoxicity Syndrome
|
|||
Litteratur
- Nordmann-Gomes A, 2025
- Müller F, 2024
- Appalanami R, 2024
- Baker DJ, 2023
- Jin X, 2021
- Mitra A, 2023
- Schuster SJ, 2017
2. BiTEs «Bispecific T-cell Engagers» immunoterapi.
Definisjon. BiTEs «Bispecific T-cell Engagers» er immunoterapi. Er molekylær eller immunoglobulin bru som binder seg til både T-lymfocytter, vanligvis via anti-CD3 samt og ved behandling av autoimmune sykdommer til spesifikke målproteiner på overflaten av B-lymfocytter enten anti-CD19, anti-CD20 eller BCMA (B-cell maturation antigen) og målrettet destruerer disse. Dette resulterer mer målrettet og komplett B-cellehemming, en mann får til med anti-CD20 antistoffbehandling som; rituksimab, okrelizumab eller obinutuzumab.
BiTEs behandlingen gir en langvarig B-cellehemning med immunosuppresiv effekt. BiTEs behandling er under utvikling for autoimmune sykdommer, har pilot studier vist lovende resultater på enkeltpasienter med bl.a. rheumatoid artritt (RA), med reduksjon av sykdomsaktivitet og forbedret livskvalitet, samt og enkeltpasient ved systemisk sklerose (SSc) (1, 2). Teoretisk kan dette ha effekt på systemisk lupus erythematosus (SLE) og foregår en studie på dette på mosunetuzumab (ClinicalTrials.gov ID NCT05155345) i tillegg på multiple sklerosis (MS) samt ANCA assosierte vaskulitter og muligvis systemisk sklerose. Nylig publiset case rapport med 4 pasienter; med alvorlige former av; SSc, RA, idiopatisk inflammatorisk myositt (anti-MDA5) og primært Sjögrens syndrome, viste uttalt effekt ved bruk av teklistamab på 22-12 uker (4).
T-cell engagers (TCE)
- CD19 TCE: blinatumomab/Blincyto®
CD20 TCE: glofitamab/ Columvi®, mosunetuzumab og epkoritamab/Tepkinly®
BCMA TCE: teklistamab/Tecvayli®
Per dags dato (september 2024) er fire typer av BiTEs immunoterapi mot CD19, CD20 og BCMA registrerte i Norge:
Blinatumomab/Blincyto® er registrert som monoterapi til behandling av voksne med CD19-positiv residiverende eller refraktær B-celleprekursor akutt lymfoblastisk leukemi (ALL).
Glofitamab/ Columvi® er samen med en enkeltdose på 1000 mg obinutuzumab (anti-CD20 antistoff) på syklus 1 dag 1 er registrert i Norge som monoterapi for behandling av voksne med residiverende eller refraktært diffust storcellet B-cellelymfom (DLBCL), etter ≥2 linjer med systemisk terapi.
Epkoritamab/Tepkinly® er registret ved diffust storcellet B-cellelymfom (DLBCL): Som monoterapi til behandling av voksne med residivert eller refraktært diffust storcellet B‑cellelymfom (DLBCL) etter 2 eller flere linjer med systemisk behandling. Follikulært lymfom (FL): Som monoterapi til behandling av voksne med residivert eller refraktært follikulært lymfom (FL) etter 2 eller flere linjer med systemisk behandling.
Teklistamab/Tecvayli® er registert som monoterapi til behandling av pasienter med residiverende og refraktær myelomatose, som har fått minst 3 tidligere behandlinger, inkl. et immunmodulerende middel, en proteasomhemmer og et anti-CD38-antistoff, og har vist sykdomsprogresjon under siste behandling.
Når man sammenligner BiTEs behandling med «chimeric antigen receptor T-cell therapy» CAR-T-celleterapi og autolog stamcelletransplantasjon ved alvorlige autoimmune sykdommer kan man konkludere følgende (3).
BiTEs:
- Målrettet presisjon: BiTEs kan designes for å målrettet nå immunceller eller molekyler som driver den autoimmune sykdommen, noe som potensielt reduserer bivirkninger sammenlignet med annen behandling, som regel gir bredere immunsuppressive effekt.
- Enklere produksjon og administrasjon: BiTEs er “off-the-shelf” behandling, noe som betyr at de ikke krever individuell tilpasning som CAR-T-celler. Dette gjør dem potensielt raskere tilgjengelige og billigere.
- Potensielt mindre toksiske: Mens CAR-T-celleterapi kan forårsake alvorlige bivirkninger som cytokinfrigjøringssyndrom (CRS – «cytokine release syndrome») og nevrotoksisitet (ICANS – «Immune effector cell-associated neurotoxicity syndrome»), har BiTEs generelt vist noe mildere bivirkningsprofil en CAR-T behandling.
- Mindre invasiv behandling: BiTEs administreres ved injeksjon, noe som er mindre invasivt enn høydose cellegiftbehandling med autolog stamcellestøtte (HMAS) som krever celletekstraksjon, kjemoterapi med aplasi og reinfusjon av CD34+ stamceller og er dokumentert ved alvorlig diffus systemisk sklerose og multiple sklerosose (MS).
- Potensial for langvarig effekt: Kasuistikker antyder at BiTEs kan indusere en langvarig immunrespons, noe som kan føre til vedvarende remisjon av den autoimmune sykdommen. Det foreligger foreløpig ingen randomiserte undersøkelser på autoimmune sykdommer eller vaskulittsykdommer.
Litteratur:
- Bucci L, Hagen M, Rothe T, Raimondo MG, Fagni F, Tur C, et al. Bispecific T cell engager therapy for refractory rheumatoid arthritis. Nat Med. 2024;30(6):1593-601.
- Subklewe M, Magno G, Gebhardt C, Bucklein V, Szelinski F, Arevalo HJR, et al. Application of blinatumomab, a bispecific anti-CD3/CD19 T-cell engager, in treating severe systemic sclerosis: A case study. Eur J Cancer. 2024;204:114071.
- Shah K, Leandro M, Cragg M, Kollert F, Schuler F, Klein C, et al. Disrupting B and T-cell collaboration in autoimmune disease: T-cell engagers versus CAR T-cell therapy? Clin Exp Immunol. 2024;217(1):15-30.
- Hagen M, Bucci L, Böltz S, Nöthling DM, Rothe T, Anoshkin K, et al. BCMA-Targeted T-Cell-Engager Therapy for Autoimmune Disease. The New England journal of medicine. 2024;391(9):867-9.
