ANDRE SYKDOMMER (REV 063-REV 077)
178 Lungesykdommer. Lunger og revmatisk sykdom, pulmonale manifestasjoner. NSIP, UIP, Lungecyster, LIP (REV 096, REV 125, REV 126, REV 127, REV 128, REV 128, REV 129, REV 130, REV 131)
Lungesykdom
Jan Tore Gran and Øyvind Palm
Kunnskap om lungesykdommer er viktig for revmatologer for å kunne tilby best mulig behandling og oppfølging til våre pasienter.
Systemiske revmatiske sykdommer og lungeinvolvering:
Lungemanifestasjoner er vanlige ved en rekke revmatiske sykdommer og kan være den første eller dominerende presentasjonen. Kunnskap om lungesykdommer er derfor essensielt for revmatologer, da det muliggjør tidlig diagnostisering, riktig behandling og tverrfaglig samarbeid med lungeleger for å sikre optimal pasientbehandling.
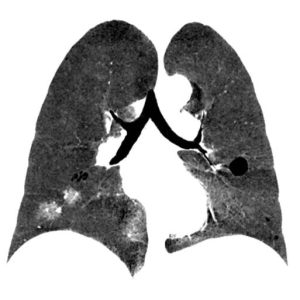
Eksempler på revmatiske sykdommer med mulig lungeaffeksjon:
- Systemisk sklerose: Interstitiell lungesykdom, pulmonal arteriell hypertensjon
- Revmatoid artritt: Interstitiell lungesykdom, pleuritt, revmaknuter
- Systemisk lupus erythematosus (SLE): Pleuritt, akutt lupus pneumonitt, kronisk lungesykdom
- Antisyntasesyndrom: Interstitiell lungesykdom, organiseringspneumoni
- Granulomatose med polyangiitt (GPA): Alveolær blødning, interstitiell lungesykdom, knuter/kaviteter
- Polymyositt og dermatomyositt: Interstitiell lungesykdom, respirasjonssvikt ved svelgeproblemer
- Sjögren syndrom: Interstitiell lungesykdom, lymfomatøs infiltrasjon
- Systemiske vaskulitter: Alveolær blødning, interstitiell lungesykdom
- Eosinofil granulomatose med polyangiitt (EGPA): Astma, eosinofil pneumoni
Medikamentelle bivirkninger: Enkelte medisiner som brukes til å behandle revmatiske sykdommer, som metotreksat og cyklofosfamid, kan ha bivirkninger som påvirker lungene. Revmatologer må være oppmerksomme på disse bivirkningene og overvåke pasientenes lungefunksjon nøye.
Epidemiologisk utgjør lungesykdommer ca. 10% av dødsfallene i vestlige industriland, og er i Norge en av de vanligste årsaker til sykehusinnleggelser og død. De tre vanligste årsakene er lungekarsinom (ca. 40%), KOLS/emfysem (ca. 25%) og pneumoni (ca. 20%).
Interstitiell lungesykdom er en fremtredende komplikasjon ved revmatiske inflammatoriske/autoimmune revmatiske sykdommer.
Symptomer på lungesykdom kan inkludere:
- Allmennsymptomer med redusert appetitt/vekttap, feber og nattesvette.
- Mer spesifikke tegn er tørrhoste eller med ekspektorat, blodtilblandet hoste, dyspne (se nedenfor) og smerter eller ubehag i brystet.
Lungediagnostikk omfatter:
- Anamnese
- Kliniske undersøkelse med perkusjon og auskultasjon
- Blodprøver inklusiv serologiske tester
- Lungefunksjonsundersøkelser og blodgassanalyser,
- Bildediagnostikk
- Transthorakal og endobronkial ultralyd.
- CT, HRCT, MR, PET/CT.
- Perfusjons- og ventilasjonsscintigrafi.
- Angiografi.
- Thorakotomi.
- Ekkokardiografi.
- Høyre hjertekateter-undersøkelse
Litteratur: Herold G og medarbeidere, Innere Medizin, 2024.
Behandling. Ved pågående inflammasjon i lungevev, som ved ikke-spesifikk interstitiell pneumoni (NSIP), er behandlingsmålet å reversere mattglassforandringer (et radiologisk funn) og stanse progresjon til fibrose (arrdannelse i lungevevet). Kortikosteroider er ofte førstevalget, men bør unngås ved systemisk sklerose. Dosen justeres etter sykdommens alvorlighetsgrad. DMARDs som mykofenolat, azathioprin, takrolimus, rituksimab, cyclofosfamid kan også benyttes.
-Utprøvende behandling: I noen tilfeller kan antifibrotiske legemidler (for eksempel nintendanib) forsøkes. Ved systemisk sklerose, diffus form, kan stamcelletransplantasjon (HMAS) fra benmarg være aktuelt.
– Lungetransplantasjon
Lungetransplantasjon kan være en behandlingsmulighet for pasienter med kronisk, livstruende lungesykdom i sluttstadiet, når andre behandlingsalternativer er uttømt og det er høy risiko for død innen 1-2 år. Pasienten må imidlertid være i stand til å tåle operasjonen og den påfølgende, livslange behandlingen. Derfor er det viktig med en grundig medisinsk utredning av hjertefunksjon, infeksjoner/infeksjonsrisiko og psykologisk status, i tillegg til lungefunksjonen.
Indikasjoner og hyppighet. KOLS (kronisk obstruktiv lungesykdom) og emfysem utgjør omtrent halvparten av indikasjonene for lungetransplantasjon, men andelen med lungefibrose har økt. Andre tilstander, inkludert systemsykdommer som revmatiske sykdommer, utgjør en mindre andel. I Norge utføres dobbeltsidig lungetransplantasjon som standard. Mangelen på organer har begrenset antallet transplantasjoner til omtrent 30 per år det siste tiåret (Leuckfeldt I, 2023).
Revmatiske sykdommer og lungetransplantasjon. Blant revmatiske sykdommer med alvorlig lungesykdom som kan føre til henvisning for lungetransplantasjonsvurdering er revmatoid artritt, systemisk sklerose, antisyntetase syndrom eller interstitiell pneumoni med autoimmune trekk (IPAF). I utredningen av disse pasientene påvises ofte antinukleære antistoff (ANA) i blodet, og non-spesifikk interstitiell pneumoni (NSIP) er et vanlig funn (Atienza-Matheo B, 2020).
Tabell basert på ACR/Chest anbefalinger for medikamentell behandling ved progredierende interstitiell lungesykdom (Interstitial lung disease guidelines, 2023). *Forutsetter tegn til fibrose eller UIP-mønster ved CT. For detaljer vises til originalpublikasjonen.
| Behandlingsmuligheter | Systemisk sklerose | myositt/antisyntetase syndrom | MCTD | RA | Sjøgrens syndrom |
| Foretrekkende alternativ | mykofenolat, tocilizumab, rituksimab | mykofenolat, azathioprin, rituksimab, calcineurin-hemmere | mykofenolat, azathioprin, rituksimab | mykofenolat, azathioprin, rituksimab | mykofenolat, azathioprin rituksimab |
| Andre muligheter | cyklofosfamid, nintedanib*, azathioprin | JAK-hemmer, cyklofosfamid, | tocilizumab, cyklofosfamid | cyklofosfamid | cyklofosfamid. |
| + | |||||
| Kortikosteroider | Sterk advarsel mot å bruke kortikosteroider | Kortvarig | Kortvarig | Kortvarig | Kortvarig |
| Progresjon av ILD til tross for ovenfor nevnte medikasjon, vurder: | Henvise for ev. autolog stamcellebehandling | nitendanib*, IVIG | nitendanib* | nitendanib*, pirfenidon | nintendanib* |
ARDS
- Vennligst se Respirasjonssvikt, akutt nedenfor i dette kapitlet.
Astma
Læringsmål REV 127. Revmatologen skal ha god kunnskap om KOLS og astma, og selvstendig kunne utføre diagnostikk og akuttbehandling.
Astma er en kronisk inflammatorisk sykdom i luftveiene som rammer omtrent 10% av befolkningen i Norge. Sykdommen er kompleks og består av flere tilstander med ulike fenotyper. Årsaker til astma inkluderer generisk disposisjon for atopi (allergisk disposisjon) med allergi og eksem. Astma og astmaanfall kan utløses av en rekke faktorer, inkludert virale luftveisinfeksjoner, anstrengelse, gastroøsofageal reflukssykdom, kronisk sinusitt, allergener i miljøet, acetylsalisylsyre, betablokkere, tobakksrøk, insekter, planter, parfyme, fedme og emosjonelt stress.
–Symptomer er typisk anfallsvis dyspne, stridor eller hoste som ofte er verst om natten. Atopi er ofte til stede.
Akutt astmaeksaserbasjon (astmaanfall). Ved akutt astma-eksaserbasjon sitter pasienten vanligvis fremoverbøyd med dyspne. Fin håndtremor kan forekomme på grunn av salbutamol (en korttidsvirkende beta-2-agonist), og noen kan ha mild takykardi. Ved auskultasjon høres bilaterale stridor.
Laboratoriefunn og lungefunksjonsmålinger. Laboratorieprøver viser ofte eosinofili i blod og sputum hos pasienter med allergisk astma. Ved non-allergisk astma kan man ofte se leukocytose og høy CRP. Lungefunksjonsmålinger ved akutt astmaeksaserbasjon viser vanligvis redusert peak expiratory flow (PEF) (< 33% av forventet verdi) og oksygenmetning (< 92%). Pulsoksymetri og gjentatte PEF-målinger er nyttige for å monitorere forløpet.
–Behandling av akutt livstruende astma inkluderer oksygentilførsel, systemiske steroider, inhalasjon med korttidsvirkende beta-2-agonister og kortidsvirkende muskarinreseptoragonister, samt intravenøs magnesiumsulfat (Hashmi MF, 2024).
-Behandling av kronisk astma kan følge en trinnvis tilnærming med fem trinn (Rajan S, 2020):
- Lavdose inhalert kortikosteroid ved behov, pluss formoterol (en langtidsvirkende beta-2-agonist).
- Inhalert lavdose kortikosteroid daglig, pluss korttidsvirkende beta-2-agonist ved behov.
- Inhalert lavdose kortikosteroid pluss langtidsvirkende beta-2-agonist, pluss korttidsvirkende beta-2-agonist ved behov.
- Inhalert mediumdose kortikosteroid pluss langtidsvirkende beta-2-agonist, pluss korttidsvirkende beta-2-agonist ved behov.
- Høydose inhalert kortikosteroid pluss langtidsvirkende beta-2-agonist, pluss langtidsvirkende muskarinreseptorantagonist eller anti-IgE
Livstruende astma foreligger ved progredierende dyspne som ikke responderer på systemiske kortikosteroider og beta 2 agonist i forstøverapparat.
- KOLS er beskrevet i eget avsnitt nedenfor i dette kapitlet.
Bronkoskopi
Læringsmål REV 130 Revmatologen skal kjenne til indikasjoner, kontraindikasjoner og komplikasjoner ved bronkoskopi og lunge- og pleurabiopsier.
Dyspne
Læringsmål REV 125. Revmatologen skal kjenne de fysiologiske mekanismene bak de vanligste respirasjonsforstyrrelsene og kunne gjøre en selvstendig vurdering av pasienter med dyspnoe, stridor og andre respiratoriske symptomer, samt iverksette utredning og behandling. Kjenne de ekstrapulmonale årsakene til respirasjonssvikt.
Definisjon. Dyspne, også kalt kortpustethet, er en subjektiv opplevelse av pustebesvær med varierende intensitet.
Epidemiologisk utgjør dyspne ca. 7% av akuttinnleggelser fra akuttmottak. I lungemedisinsk praksis ses dyspne hos opp til 60% av pasientene.
Symptomer er vanlig og kan skyldes primær luftveissykdom, infeksjoner, kardial svikt, nevromuskulær sykdom, systemisk sykdom (inkludert ILD ved revmatiske sykdommer) og psykogene faktorer.
Dyspne oppfattes som kronisk dersom varigheten er mer enn 4-8 uker.
Sykdomsårsaker kan respiratorisk skyldes astma, KOLS, pneumoni, aspirasjon, pneumothoraks, lungekreft eller lungeemboli. Hjertesykdommer med dyspne omfatter hjertesvikt, lungeødem, akutt koronarsykdom, perikard-tamponade, hjerteklaff-sykdom, pulmonal hypertensjon, arytmi eller intrakardial shunting. Nevromuskulære årsaker er massiv adipositas, kyfoskoliose, CNS eller medulla skade, frenicus-paralyse, non-inflammatorisk myopati og nevropati. Psykogene årsaker er hyperventilasjon og psykogen dyspne. Vurder også systemsykdommer som anemi, akutt nyresvikt, metabolsk acidose, thyreotoksikose, levercirrhose, anafylaksi, sepsis, angioødem og epiglottitis. Hepatopulmonalt syndrom kan foreligge ved samtidig leversvikt. Aterovenøs malformasjon, post-pneumektomi syndrom, residiverende lungeemboli, atrieseptumdefekt, åpenstående foramen ovale, atelektase, hepatisk hydrothorax og portopulmonal hypertensjon kan også medføre dyspne (Ho APT, 2023).
Ved ANCA vaskulitt, sjeldnere ved systemiske bindevevssykdommer er lungeblødning ved kapillaritt dyspne-årsak. Også antisyntetase syndromet kan preges av progredierende dyspne.
Anamnesen skal dekke mulige årsaker (se ovenfor). Det er viktig å kartlegge faktorer relatert til debut, varighet og symptomer i hvile eller belastning.
Klinisk vurderes respirasjons- og hjertefrekvens, body mass index /BMI (vekt/høyde2), kroppstemperatur og vanlig klinisk undersøkelse av lunger, hals, hjerte, abdomen, ekstremiteter, blodtrykk og puls. Oksygenmetning.
Laboratorieprøver med SR, SR, Hb, leukocytter med differensialtellinger, trombocytter, elektrolytter, lever-, nyre- og thyreoidea-funksjonsprøver, albumin, NT-Pro-BNP, troponin, CK.
Vurder også ANA og ANCA ved mistanke om systemisk bindevevssykdom eller vaskulitt. Ved artritt suppleres med anti-CCP. Urin stiks. Ved mistanke om antisyntetase syndromet suppleres med myosittspesifikke antistoff (inklusiv anti-Jo-1, PL7 og PL12). Arteriell blodgass.
Bildediagnostikk med røntgen eller CT thoraks.
Lungefunksjonsundersøkelser kan vurderes.
EKG og Ekkokardiografi for vurdering av kardiale årsaker.
Bronkoskopi med lavage kan være indisert
Behandlingen retter seg mot årsaken. Pasienter med progredierende dyspne må følges tett. Vurder pulsoksimetri og hjertemonitorering. Terskelen for oksygentilskudd via nesekateter, intubasjon og intensivmedisinsk behandling må ikke være for høy. For supplerende informasjon er lokale metodebøker og Metodebok i Indremedisin (OUS-Ullevål, Dyspne) aktuelle.
Litteratur: Hashmi MF, 2023
- Akutt respirasjonssvikt er omtalt nedenfor i dette kapitlet.
- Akuttmedisinske tilstander er samlet i et eget kapittel.
Hoste
Læringsmål REV 125. Revmatologen skal kjenne de fysiologiske mekanismene bak de vanligste respirasjonsforstyrrelsene og kunne gjøre en selvstendig vurdering av pasienter med dyspnoe, stridor og andre respiratoriske symptomer, samt iverksette utredning og behandling. Kjenne de ekstrapulmonale årsakene til respirasjonssvikt.
Definisjon. Hoste er en refleks som hjelper til med å rense luftveiene for slim og irritanter. Det kan være et symptom på en rekke forskjellige tilstander, både akutte og kroniske. Hoste kan som ved dyspne være tegn på lungesykdom. Kronisk hoste har pr definisjon vart minst 8 uker.
Sykdomsårsaker omfatter interstitiell lungesykdom ved revmatiske systemsykdommer, astma, refluks-sykdom, KOLS, ACE-hemmer, aspirasjon, kardial svikt, lungekreft, psykogen hoste.
Undersøkelser inkluderer: auskultasjon av lungene med stetoskop, lungefunksjonsmålinger, røntgen og helst CT av lungene, blodprøver og bronkoskopi.
Diagnosen av hoste avhenger av symptomene, pasientens historie og en rekke undersøkelser.
Litteratur: Sharma S, 2023
- Dyspne er beskrevet i avsnittet ovenfor.
- Akuttmedisinske tilstander er samlet i et eget kapittel.
KOLS
Læringsmål REV 127. Revmatologen skal ha god kunnskap om KOLS og astma, og selvstendig kunne utføre diagnostikk og akuttbehandling.
Kronisk obstruktiv lunge sykdom (KOLS) er en heterogen tilstand med økende redusert respiratorisk luftstrøm og destruksjon av lungevev. Det er den vanligste lungesykdommen i Norge, og rammer ca. 400 000 personer. Sykdommen er assosiert med strukturelle forandringer i lungevev på grunn av kronisk inflammasjon.
Årsaker er langvarig eksponering for toksiske gasser, vanligvis (90%) sigarett-røk. Andre årsaker er residiverende infeksjoner ved IgA mangel, α-1 antitrypsinmangel og luftforurensning.
Obstruksjonen ved KOLS kan forenklet defineres ved en vedvarende ratio FEV1/FVC <0,7 (<70%) ved lungefunksjonsmålinger til tross for bronkodilatatorisk medikasjon (non-reversibel).
-Symptomer. KOLS varierer fra asymptomatisk til fatal respiratorisk svikt. Initialt er residiverende bronkitt med ekspektorat vanlig. Debutsymptomer er dermed hoste, dyspne og ekspektorat.
–Undersøkelser ved KOLS inkluderer:
- 6-minutter gangtest
- Laboratorieprøver inklusiv α-1 antitrypsin
- Infeksjonsutredning
- Lungefunksjonstester
- Bildediagnostikk
–Behandlingen omfatter en kombinasjon av røkestans, lungerehabilitering og medikamenter. Akutt eksaserbasjon av KOLS kan behandles utenfor sykehus eller ved innleggelse, avhengig av alvorlighetsgraden. I milde tilfeller brukes bronkodilatorer, steroider og antibiotika. Moderate og alvorlige tilfeller håndteres på sykehus og vil ofte trenge oksygen og bronko-dilaterende medikasjon (Agarval AK, 2023).
- Vennligst se også avsnittet om akutt respirasjonssvikt nedenfor.
Lungefunksjonsundersøkelser
Læringsmål REV 126. Revmatologen skal ha god kunnskap om indikasjon, nytte og begrensninger av PEF-måling og spirometri. Selvstendig kunne tolke flow-volumkurve og spirometri.
- Vennligst se eget kapittel om lungefunksjonsundersøkelser
Pneumoni
Læringsmål REV 128. Revmatologen skal ha god kunnskap om pneumoni/nedre luftveisinfeksjoner, samt selvstendig kunne utføre diagnostikk og akuttbehandling. Ha kunnskap om komplikasjoner som empyem og lungeabscess.
Pneumoni er infeksjon i lungevevet i de nedre luftveier og kan forårsakes av bakterier, virus sopp og parasitter.
-Klassisk pneumoni forårsakes ofte av bakteriene
- Streptococcus pneumoniae
- Haemophilus influenzae
- Staphylococcus aureus
- Gruppe A streptokokker
- Moraxella catarrhalis
- Anaerobe og aerobe gram-negative bakterier.
-Atypisk pneumoni kan blant annet skyldes:
- Legionella
- Mycoplasma pneumoniae
- Chlamydia pneumoniae
- Chlamydia psittaci.
Nosokomiale infeksjoner oppstår mer enn 48 timer etter innleggelse i sykehus. Infeksjonen er generelt mer antibiotikaresistente og omfatter aerobiske gram-negative bakterier:
- Pseudomonas aeruginosa
- Escherichia coli
- Klebsiella pneumoniae
- Enterobacter spp
- Acinetobacter spp
- Gram-positive kokker som staphylococcus aureus som inkluderer methicillin-resistente S. aureus og streptococcus spp.
Symptomer på pneumoni inkluderer feber, utmattelse, nedsatt appetitt, hoste og dyspne. Eldre personer kan også oppleve forvirring.
Utredning
–Blodprøver omfatter hemoglobin, leukocytter med differensialtelling, trombocytter, CRP, SR, blodkulturer, sputum-analyser, urin antigen-tester eller PCR undersøkelser for påvisning av spesifikke bakterier.
-Bildediagnostikk. Konvensjonell røntgen av lungene er vanlig, mens CT kan gi et mer detaljert bilde.
Behandling. Pneumoni behandles primært med antibiotika (Sattar SBA, 2024). Valg av antibiotika avhenger av mistenkt årsak og pasientens individuelle forhold.
- Vennligst se også kapitlet om infeksjoner.
Lungeempyem og lungeabscess er begge alvorlige lungesykdommer som kan være livstruende. De kjennetegnes av ansamling av puss i lungene, men har forskjellige årsaker og symptomer. Både lungeempyem og lungeabscess gir ofte symptomer som feber, hoste og dyspné. Lungeabscess skiller seg imidlertid ut ved at det ofte gir purulent oppspytt. Begge tilstandene behandles med antibiotika, men lungeabscess kan i tillegg kreve kirurgisk inngrep.
Empyem defineres som en ansamling puss, gram-positive bakterier eller positive bakteriekulturer i pleurahulen. Empyem utvikles oftest etter pneumoni (20%), thorakskirurgi eller traume mot thoraks. Symptomene kan være som ved pneumoni; feber, hoste, dyspne. Behandlingen består av antibiotika og i noen tilfeller drenasje av puss.
Lungeabscess er en mikrobakteriell infeksjon i lungene som fører til nekrose i lungeparenkymet. Akutt lungeabscess har vart mindre enn fire uker, mens kronisk tilstand har vart over fire uker. Sekundær lungeabscess oppstår som følge av underliggende pulmonale lesjoner. Personer med svekket immunforsvar, som ved HIV/AIDS, etter transplantasjon eller langvarig immunsuppressiv behandling (blant annet ved revmatisk sykdom), er spesielt utsatt for lungeabscess (Eira IM, 2019). Pasienter med høy risiko for aspirasjon er også utsatt, for eksempel etter hjerneslag, ved øsofagusdysfunksjon, alkoholoverforbruk og kognitive vansker.
Symptomer på lungeabscess omfatter feber, nattesvette, hoste, brystsmerter, dyspne, purulent oppspytt og vekttap. Lungeabscess behandles med antibiotika, og i noen tilfeller kan drenasje av puss eller kirurgi være nødvendig (Sabbula BR, 2023).
Respirasjonssvikt, akutt.
Læringsmål REV 096. Revmatologen skal beherske behandling av akutt respirasjonssvikt i samråd med fagspesialitetene (lungeleger og anestesileger).
Definisjon. Respirasjonssvikt oppstår når gassutveksling i lungene er utilstrekkelig, noe som fører til lavt oksygennivå (PaO2 < 60 mmHg) og/eller høyt karbondioksidnivå (PaCO2 > 50 mmHg) i blodet. Akutt lungesviktsyndrom (ARDS) er en alvorlig form for respirasjonssvikt karakterisert ved alvorlig hypoksi (lavt oksygennivå) og bilaterale, diffuse lungefortetninger på røntgen (Opdahl H, 2010).
Det finnes to hovedtyper respirasjonssvikt:
-
Hypooksemisk respirasjonssvikt (type 1): Kjennetegnes ved PaO2 < 60 mmHg med normal eller lav PaCO2. Gassutvekslingen over den alveolære-kapillære membranen er redusert, noe som medfører utilstrekkelig oksygentilførsel til blodet (hypoksemi). Dette kan være forårsaket av en rekke tilstander som påvirker lungefunksjonen, inkludert pneumoni, pneumothoraks (punktert lunge), lungeblødning, aspirasjon (innånding av fremmedlegemer) og drukning.
-
Hyperkapnisk respirasjonssvikt (type 2): Kjennetegnes ved PaCO2 > 50 mmHg (hyperkapni) og indikerer at respirasjonsmuskulaturen svikter. Dette kan være forårsaket av obstruktive lungesykdommer som KOLS og astma, svekkelse av respirasjonsmuskulaturen (for eksempel ved nevromuskulære sykdommer), eller påvirkning av sentralnervesystemet (CNS), som ved overdose av opioider.
Akutt respirasjonssvikt kan oppstå plutselig og forverres raskt, og krever øyeblikkelig medisinsk behandling. Utredning og behandling av pasienter gjøres i samarbeid med lungelege og anestesilege.
–Revmatiske sykdommer med akutt respirasjonssvikt er lungeblødning ved ANCA-vaskulitt, PAN eller Goodpastures syndrom, sjelden ved SLE. Også raskt progredierende antisyntetase syndrom og lungeemboli ved antifosfolipid syndrom og andre systemiske bindevevssykdommer kan medføre lungesvikt.
Epidemiologi. Risikoen for akutt respirasjonssvikt øker med alderen, og er høyere hos personer med kroniske lungesykdommer, hjertesykdom eller nedsatt immunforsvar.
Symptomer: Rask og anstrengt pust, dyspné, cyanose, angst og uro, forvirring og nedsatt bevissthetsnivå, svette og tachykardi.
Utredning
Anamnesen (eventuelt fremmedanamnese) kartlegger forutgående sykdom og symptomer.
Klinisk gjøres en generell medisinsk undersøkelse. Lungene auskulteres og perkuteres.
Blodprøver: Måler oksygen- og karbondioksidnivået i blodet, hemoglobin, celletellinger, samt andre parametere som kan gi informasjon om årsaken.
Bildediagnostikk med røntgen av lungene kan vise tegn på pneumoni, pneumothoraks, eller andre lungesykdommer. CT av lungene kan gi mer detaljert informasjon om lungene og luftveiene.
Arterial blodgassanalyse måler oksygen- og karbondioksidnivået i arterielt blod.
Pulsoksymetri måler oksygenmetningen i blodet.
Behandling av respirasjonssvikt
Behandling av den underliggende årsaken er avgjørende for å forbedre lungefunksjonen og sikre tilstrekkelig oksygenering og ventilasjon.
Oksygentilskudd er ofte nødvendig for å korrigere hypoksemi (lavt oksygennivå i blodet). Dette kan gis via nesekateter, ansiktsmaske eller i mer alvorlige tilfeller gjennom en respirator. Valg av metode avhenger av alvorlighetsgraden av hypoksemi og pasientens behov.
Respirasjonsstøtte. Ved alvorlig respirasjonssvikt, spesielt hyperkapnisk respirasjonssvikt, kan det være nødvendig med mekanisk ventilasjon. Respiratoren overtar da pasientens pusting og sikrer tilstrekkelig ventilasjon og oksygenering.
Medikamentell behandling
Medikamentell behandling kan være nødvendig for å behandle spesifikke årsaker til respirasjonssvikt og eventuelle komplikasjoner. Dette kan inkludere:
- Bronkodilatorer: For å lindre bronkospasme (sammentrekning av luftveiene) ved astma eller KOLS.
- Antibiotika: Ved pneumoni forårsaket av bakterier.
- Kortikosteroider: For å redusere inflammasjon i lungene ved ARDS eller andre inflammatoriske tilstander.
- Diuretika: For å fjerne overflødig væske fra lungene ved lungeødem.
- Antikoagulantia: For å forebygge eller behandle blodpropp (lungeemboli).
Fysioterapi kan være en viktig del av behandlingen, spesielt etter en episode med akutt respirasjonssvikt. Fysioterapeuten kan hjelpe pasienten med pusteøvelser, hosteteknikker og generell mobilisering for å forbedre lungefunksjonen og forebygge komplikasjoner (Azoulay E, 2019). (Gragossian A, 2022; ARDS).
Andre tiltak. I tillegg til spesifikk behandling av årsaken til respirasjonssvikt, er det viktig å optimalisere pasientens generelle tilstand. Dette kan innebære væskebehandling, ernæringsstøtte og behandling av eventuelle underliggende sykdommer.
- Akuttmedisinske tilstander er samlet i et eget kapittel.
Stridor
Læringsmål REV 125. Revmatologen skal kjenne de fysiologiske mekanismene bak de vanligste respirasjonsforstyrrelsene og kunne gjøre en selvstendig vurdering av pasienter med dyspnoe, stridor og andre respiratoriske symptomer, samt iverksette utredning og behandling. Kjenne de ekstrapulmonale årsakene til respirasjonssvikt.
Stridorer en høyfrekvent respiratorisk lyd som oppstår ved unormal luftpassasje i luftveiene. Lyden skyldes turbulens i luftstrømmen forårsaket av en forsnevring eller obstruksjon i luftveiene.
Typer stridor og årsaker. Stridor kan være inspiratorisk, ekspiratorisk eller bifasisk, avhengig av når i respirasjonssyklusen lyden oppstår.
- Inspiratorisk stridor: Høres best ved innpust og kan skyldes obstruksjon i øvre luftveier, som ved trakealstenose (forsnevring av luftrøret), glottisødem (hevelse i stemmebåndene) og laryngospasme (ufrivillig sammentrekning av stemmebåndene).
- Ekspiratorisk stridor: Høres best ved utpust og kan tyde på obstruksjon i nedre luftveier, som ved astma, KOLS (kronisk obstruktiv lungesykdom), lungeemboli eller pneumothoraks (punktert lunge).
- Bifasisk stridor: Høres både ved innpust og utpust og kan tyde på en obstruksjon som påvirker både øvre og nedre luftveier.
Hos barn kan stridor være forårsaket av medfødte misdannelser eller anomalier i luftveiene. Både hos barn og voksne kan akutt innsettende stridor være et tegn på livstruende luftveisobstruksjon eller infeksjon.
Diagnostikk og utredning. Ved uklar årsak til stridor kan røntgen eller bronkoskopi være nødvendig for å stille diagnosen (Sicari V, 2023).
- Respirasjonssvikt er omtalt nedenfor og dyspne ovenfor i dette kapitlet.
Tuberkulose i lunger, pleuravæske, søvnapne, lungeinfeksjoner hos immunsupprimerte, fremmedlegemer
Læringsmål REV 129. Revmatologen skal ha kunnskap om lungetuberkulose, pleuraeffusjoner, obstruktivt søvnapnesyndrom, lungeinfeksjoner hos immunsupprimerte og fremmedlegeme i luftveier.
Tuberkulose er en infeksjonssykdom forårsaket av bakterien Mycobacterium tuberculosis. Lungene er det vanligste organet som rammes, men tuberkulose kan også påvirke andre organer som mage-tarmkanalen, lymfesystemet, huden, sentralnervesystemet (CNS), leveren og ledd/skjelett. Personer med svekket immunforsvar, for eksempel på grunn av immunsuppressiv behandling med kortikosteroider, csDMARDs og biologiske legemidler er spesielt utsatt.
Vanlige symptomer på tuberkulose inkluderer kronisk hoste, blodig oppspytt (hemoptyse), vekttap, nattesvette og lavgradig feber. Interferon-gamma release assays (IGRA) i blod brukes i diagnostikken sammen med bildediagnostikk, som for eksempel røntgen thoraks (Adigun R, 2024). Ved mistanke om tuberkulose bør infeksjonsmedisiner eller lungelege kontaktes.
- Vennligst les også i kapitlet om tuberkuløs artritt og osteomyelitt.
Pleuravæske ved revmatiske sykdommer
Pleuravæske kan oppstå i forbindelse med inflammasjon, spesielt ved revmatoid artritt (RA), systemisk lupus (SLE), sjeldnere ved systemisk sklerose og Sjøgrens syndrom. Pleuravæsken ved inflammasjon består typisk av et eksudat (med høyt proteinnivå på over 30 g/L), slik man blant annet ser ved RA (Balbir-Gurman A, 2006). Persisterende pleuravæske hos pasienter med SLE kan være assosiert med «Shrinking lung syndrome» (Henderson LA, 2013).
Utredning av pleuravæske inkluderer: Blodprøver med ANA, anti-CCP. Analyse av pleuravæske for proteinnivå, dyrkning, PCR og cytologi (ved mistanke om malignitet).
- Vennligst se eget kapittel om pleuritt og pleuravæske.
Obstruktiv søvnapne
Obstruktiv søvnapne er en sykdom der øvre luftveier kollapser og medfører luftveisobstruksjon under søvn. Diagnosen stilles helst etter undersøkelse i et søvnlaboratorium (Cupston E, 2023).
- Vennligst se mer i kapitlet om ØNH manifestasjoner.
Lungeinfeksjoner hos immunsupprimerte
- Vennligst se kapitlet om opportunistiske infeksjoner
Fremmedlegemer i luftveiene
Små barn er mest utsatt for aspirasjon av fremmedlegemer. En studie viste at blant barn under fem år var 98% under to års alder. Mange er asymptomatiske. Symptomene omfatter hoste, kvelningsfornemmelse og dyspne. Bildediagnostikk: Røntgen thoraks er vanligste initiale undersøkelse. Denne kan vise atelektase, pneumothoraks og air trapping. Imidlertid er bildet normalt i hele 35% av tilfellene. Supplerende CT-undersøkelse eller bronkoskopi er da indisert. Via bronkoskop kan dessuten fremmedlegemer fjernes. Differensialdiagnoser omfatter astma og infeksjon i øvre luftveier (Cramer N, 2023).
- Vennligst se også kapitlet om ØNH manifestasjoner.
Lungesykdommer ved revmatiske tilstander. ILD, NSIP, UIP, OP/COP/BOOP, LIP
Læringsmål REV 131. Ha god kunnskap om indikasjon, utførelse og begrensninger ved røntgen og CT av thoraks, og ved røntgen thoraks selvstendig kunne tolke funn av luftholdighet, fortetninger, interstitielt ødem, frakturer, subkutant emfysem og luft/væske i pleurahulen.
Definisjon
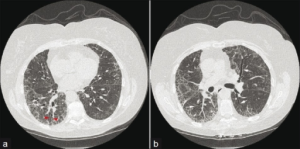
Revmatiske sykdommer kan ramme alle deler av lungene. Selv om sykdom i lungevevet (ILD) generelt er mest alvorlig, er det viktig også å diagnostisere manifestasjoner i lungehilus og pleura så tidlig som mulig. Ubehandlet kan enkelte revmatiske lungesykdommer føre til respirasjonssvikt og død innen kort tid, for eksempel ved antisyntetase syndromet eller lungeblødning ved pulmonal kapillaritt. I andre tilfeller er lungeforandringene stabile over mange år. Infeksjoner i lungene må alltid vurderes som differensialdiagnose. Riktig håndtering av lungemanifestasjoner ved revmatiske sykdommer kan være avgjørende for å bevare organfunksjon og overlevelse (Ewig S, 2021).
Interstitiell lungesykdom (ILD)
Epidemiologi
Forekomsten og alvorlighetsgraden av lungemanifestasjoner er ulikt fordelt mellom de revmatiske sykdommene. Alle inflammatoriske bindevevssykdommer kan angripe lungene. Tabellen viser en oversikt.
| Diagnose | Prevalens av lungemanifestasjoner (totalt) |
ILD | Referanse |
| Antisyntetase syndrom | nær 100% | Nær 100% | Gran JT, 2002 |
| Systemisk sklerose | ca. 60% | ca. 60% | Suliman YA, A& R 2015 |
| Myositt/Dermatomyositt | 23% | 23% | Marie I A & R 2002 |
| Sjøgrens syndrom | 27% | 23% | Palm O, Rheumatology, 2013 |
| Systemisk lupus (SLE) | 93% | 1-2% | Weidemann HP, J Thoracic Imaging , 1992 |
| MCTD | 36% | 36% | Reiseter S, Arthritis Research and Therapy, 2017 |
| ANCA-vaskulitter | |||
| –MPA | 25-55% | 3-45% | Alba MA, Autoimm Rev, 2017 |
| –GPA | 85-90% | 23% | Alba MA, Autoimm Rev, 2017 |
| –EGPA | 91% | 39% | Comarmord C A&R 2013 Alba MA, Autoimm Rev, 2017 |
| Polyarteritis Nodosa (PAN) | Uvanlig | Uvanlig | |
| Revmatoid artritt (RA) | 80% | 10% | Olson AL, 2011 |
| Sarkoidose | 90% | 10-20% | Aryal S, Ther Adv Resp Dis, 2019 |
| IPAF | 100% | 100% |
De vanligste interstitielle lungeforandringene ved revmatiske sykdommer er (mer nedenfor i dette kapitlet):
- Ikke-spesifikk interstitiell pneumoni (NSIP): Karakterisert ved betennelse og fibrose (arrdannelse) i lungevevet.
- Ususal interstitiell pneumoni (UIP): En mer aggressiv form for lungefibrose med dårligere prognose.
- Organiserende pneumoni (OP): En betennelsestilstand i lungene der bindevev fyller luftrommene. Ved fravær av assosiert revmatisk sykdom kalles tilstanden kryptogen organiserende pneumoni (COP).
- Lymfocytær interstitiell pneumoni (LIP): En sjelden form for lungesykdom karakterisert ved opphopning av lymfocytter i lungevevet.
- Akutt interstitiell pneumoni (AIP)/diffus alveolær skade (DAD): En raskt progredierende og alvorlig form for lungebetennelse.
- Desquamativ interstitiell pneumoni (DIP): En sjelden form for lungesykdom med opphopning av makrofager i alveolene (lungeblærene).
Klassifiseringen av disse tilstandene er basert på histologiske undersøkelser (vevsprøver), men bildediagnostikk med høyoppløselig CT (HRCT) gir ofte tilstrekkelige holdepunkter for å stille en diagnose.
Patogenese
Forståelsen av de eksakte sykdomsmekanismene bak revmatiske lungesykdommer er fortsatt ufullstendig. Det antas at en kombinasjon av genetiske og miljømessige faktorer spiller en rolle. Ved inflammatoriske bindevevssykdommer kan immunsystemet angripe lungevevet og forårsake betennelse og skade. Dette kan føre til utvikling av fibrose, som er en irreversibel prosess der lungevevet erstattes av arrvev, noe som reduserer lungefunksjonen.
Tabell: Histologiske og radiologiske forandringer ved interstitielle pneumonier (Ewig S, 2021):
| Type (diagnoser) | Interstitiell inflammasjon | Fibroblast proliferasjon | Intraalveolære makrofager | Bikake-forandringer |
| NSIP (Systemisk sklerose, Antisyntetase syndrom, Myositt, RA, SLE, Sjøgrens, MCTD, IPAF) | Uttalt | ev. | Flekket | Sjeldent |
| UIP (SSc, Antisyntetase s, Myositt, RA, SLE, Sjøgrens, ANCA-vaskulitt, IPAF) | Minimal | Uttalt | ev fokalt | Flekket |
| LIP (Sjøgrens) | Uttalt | Minimalt | Ingen | Ev. |
| DAD (-SLE, ANCA-vaskulitt) | Minimal | Diffus | Ingen | Ingen |
| DIP (RA) | Minimal | Diffus | Ingen | Ingen |
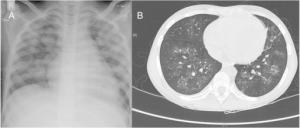
Interstitiell lungesykdom (ILD) er en gruppe tilstander karakterisert ved inflammasjon og/eller fibrose i det parenkymatøse lungevevet (vevet som utgjør selve lungestrukturen). ILD kan være assosiert med en rekke revmatiske sykdommer, og er en av de vanligste årsakene til ILD.
Risikofaktorer for ILD ved revmatiske sykdommer:
- Revmatoid artritt (RA): Anti-CCP-antistoffer, alder over 65 år, mannlig kjønn og røyking.
- Systemisk sklerose: Diffus form med Scl-70-antistoff, afroamerikansk etnisitet, røyking, mannlig kjønn og høy alder ved revmatologisk diagnose.
- Myositt. Høy alder, artritt, anti-Jo-1-antistoff (antisyntetase syndrom), MDA5-antistoff, forhøyet CRP og senkningsreaksjon (SR).
- Sjøgrens syndrom: Høy alder, mannlig kjønn, røyking, ANA-positivitet, påvist revmatoid faktor (RF) og forhøyet CRP..
Klassifisering av ILD. En kan ILD inn i fire hovedgrupper:
- Granulomatøs sykdom: For eksempel sarkoidose,
- ILD assosiert med systemisk bindevevssykdom eller annen kjent sykdom: For eksempel ANCA-vaskulitt eller eksogen allergisk alveolitt.
- Andre sjeldne sykdommer: For eksempel Langerhans histiocytose, lymfangioleiomyomatose/LAM, asbestose eller medikamentindusert lungesykdom.
- Idiopatisk ILD: Årsaken er ukkjent (Travis WD, 2013).
Symptomer og utredning
Symptomene omfatter irritasjons-/tørrhoste, belastningsdyspne og tegn til magesyrerefluks.
Anamnesen ved ILD bør kartlegge tilfeller av lungesykdom i familien, tobakksbruk, medikamentbruk og andre relevante miljøfaktorer. I tillegg bør man spørre om sicca-symptomer (tørre øyne og munn), ledd-, muskel- og hudsymptomer.
Kliniske undersøkelser omfatter vurdering av respirasjonsbesvær, cyanose, clubbing (trommestikkefingre), samt auskultasjon for å avdekke krepitasjoner over lungene.
Bildediagnostikk med CT lunger/HRCT (høyroppløselig CT) er viktig for å visualisere lungevevet og vurdere omfanget av sykdommen.
Lungefunksjonstester inkludert DLCO (diffusjonskapasitet for karbonmonoksid), gir informasjon om lungefunksjonen.
Laboratorieprøver som ANA med subgrupper, ev. også myosittspesifikke antistoff, anti-CCP / ACPA, ACE (angiotensinkonverterende enzym) kan være relevante.
Kapillaroskopi anbefales ved Raynauds fenomen (Ottaviani S, 2022).
Non-spesifikk interstitiell pneumoni (NSIP)
Definisjon. NSIP (nonspesifikk interstitiell pneumoni) er en vanlig form for interstitiell lungemanifestasjon hos pasienter med revmatiske sykdommer. Prognosen er generelt bedre enn ved UIP (usual interstitial pneumonia), men NSIP kan gradvis utvikle seg til (UIP) over tid. NSIP kan debutere akutt, subakutt eller gradvis og responderer ofte godt på immunsuppressiv behandling.
Undersøkelser og diagnostikk
Diagnosen NSIP stilles ideelt sett ved lungebiopsi, men i praksis er det ofte tilstrekkelig med HRCT (høyroppløselig computertomografi) av lungene med oppfølgende kontroller. Infeksjoner (for eksempel opportunistiske som pneumocystis) og diffus alveolær lungeblødning er viktige differensialdiagnoser. Lungeleger utfører derfor ofte diagnostisk bronkial lavage (lungeskylling) for å avklare diagnosen.
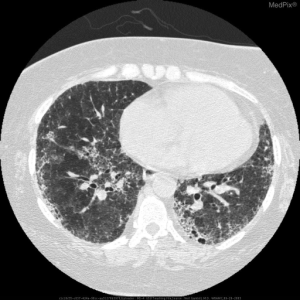
Bildediagnostikk:
Typiske funn på HRCT er mattglass fortetninger (“ground glass opacities”) og fravær av bikake-mønster (“honeycombing”) eller traksjonsbronkiektasier.
Mattglassforandringer skyldes fortetninger intraalveolært og interstitielt i lungevevet. På CT bilder skal man kunne skimte karstrukturene gjennom slike forandringer. Mattglass kan være et tegn på aktiv inflammasjon, som indikerer behov for antiinflammatorisk behandling, men også infeksjoner og lungeblødninger kan gi mattglassforandringer. Distribusjonen av forandringene, pasientens sykehistorie og andre undersøkelsesfunn er avgjørende for riktig tolkning.
Blodprøver: Ved utredning av uklare revmatiske sykdommer er følgende blodprøver relevante:
- ANA (antinukleære antistoffer) med subgrupper
- SSA (anti-Sjögren’s syndrome-related antigen A)
- SSB (anti-Sjögren’s syndrome-related antigen B)
- RNP (anti-ribonukleoprotein) (MCTD)
- Scl-70 (anti-topoisomerase I) (Systemisk sklerose)
- Anti-CCP (antistoffer mot cyklisk citrullinert peptid) (revmatoid artritt)
- Myosittspesifikke antistoffer (myositt/dermatomyositt, antisyntetase syndrom)
- MDA5 (antistoff mot melanoma differentiation-associated protein 5) (myositt)
- CK (kreatin kinase) (myositt)
Ususal interstitell pneumoni (UIP) og lungefibrose
Definisjon. UIP (usual interstitial pneumonia), også kjent som idiopatisk lungefibrose (IPF), er en kronisk og progressiv lungesykdom karakterisert ved irreversibel lungeskade og fibrose (arrdannelse) i lungevevet. UIP er ofte assosiert med revmatiske sykdommer, men kan også oppstå uten kjent årsak (idiopatisk).
Forekomst ved revmatiske sykdommer. UIP forekommer ved flere autoimmune, systemiske revmatiske sykdommer. Lungemanifestasjoner ved revmatoid artritt (RA) utgjøres av UIP i mer enn 60% av tilfellene (Bongartz T, Nannini C, A&R, 2010).
Symptomer og sykdomsutvikling. UIP starter ofte gradvis med økende tungpust (dyspné) ved anstrengelse, tørrhoste og eventuelt leddsmerter. Sykdommen utvikler seg vanligvis langsomt over tid, men kan i noen tilfeller ha et raskere forløp.
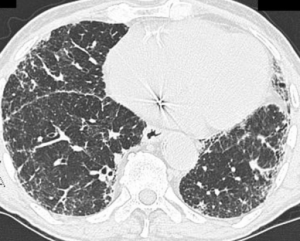
Patogenese. UIP kjennetegnes ved et karakteristisk bikakemønster (“honeycombing”) på CT-bilder av lungene, spesielt i de nedre delene (basalt) og på begge sider (bilateralt). Bikakemønsteret representerer sluttfasen av en rekke lungesykdommer og skyldes fortykkelse, ødeleggelse eller anatomisk forskyvning av intraalveolære septa (veggene mellom lungeblærene). Disse anatomiske forandringene hindrer normal gassutveksling og fører til nedsatt lungefunksjon.
Utredning
Laboratorieprøver. Ved UIP og uklare revmatiske sykdommer er det viktig å undersøke for spesifikke antistoffer i blodet, inkludert anti-CCP (antistoffer mot cyklisk citrullinert peptid), ANA (antinukleære antistoffer) inkludert SSA (anti-Sjögren’s syndrome-related antigen A) og ANCA (anti-nøytrofile cytoplasmatiske antistoffer) med PR3 og MPO.
Bildediagnostikk. Funn på CT av lungene er avgjørende for diagnosen og kan også gi en pekepinn om behandling. Et kjennetegn på UIP er bikake-mønster (“honey-combing”), særlig basalt, bilateralt på CT-bildene. Bikake-mønster representerer endestadiet av en rekke lungesykdommer.
Behandling. Immunmodulerende behandling (prednisolon, DMARDs, biologiske legemidler) har vist lite eller ingen effekt i studier, tvert imot kan de forverre prognosen på grunn av økt infeksjonsrisiko (Raghu G, Anstrom KJ, NEJM 2012).
Prognose. UIP medfører lungeforandringer med dårligst prognose. Generelt er fem års overlevelse mindre enn 50% (Strand MJ, Sprunger D, Chest 2014). Den dårlige prognosen gjør utprøving av ny, anti-fibrotisk behandling spesielt viktig. Pasienter med progredierende sykdom og alvorlig nedsatt lungefunksjon bør vurdere med tanke på lungetransplantasjon.
Organiserende Pneumoni (OP/COP/BOOP)
Definisjon. Organiserende pneumoni (OP) er en lungesykdom karakterisert ved fibrose i de perifere delene av lungene og assosiert betennelse. OP kan oppstå som en komplikasjon av andre tilstander, som for eksempel revmatiske sykdommer, eller uten kjent årsak (kryptogen organiserende pneumoni, COP). Tidligere ble OP også kalt bronkiolitt obliterans organiserende pneumoni (BOOP).
Forekomst ved revmatiske sykdommer. OP ses ofte ved antisyntetase syndrom og andre inflammatoriske myositter, men kan også forekomme ved andre inflammatoriske revmatiske sykdommer som revmatoid artritt, systemisk lupus erythematosus og systemisk sklerose.
Symptomer. Typiske symptomer på OP inkluderer hoste, ekspektorat (oppspytt), dyspné (tungpust) og nattesvette.
Utredning av OP omfatter:
-Laboratorieprøver; Analyse av antistoff i blodet inklusiv ANA (antinukleære antistoffer), SSA (anti-Sjögren’s syndrome-related antigen A), myosittspesifikke antistoff som jo-1, PL7 og PL12 (antisyntetase syndrom).
-Bildediagnostikk CT-undersøkelse av lungene kan vise karakteristiske forandringer som fortetninger, noduli (knuter) og ringformede strukturer (atoll-tegn).
Behandling av organiserende pneumoni (OP) avhenger av den underliggende årsaken og sykdommens alvorlighetsgrad.
Kryptogen organiserende pneumoni (COP):
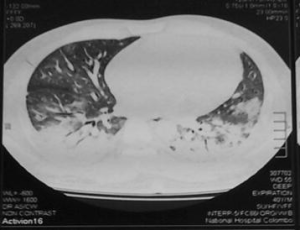
- Kortikosteroider: Er vanligvis førstelinjebehandling og gir ofte god effekt. Prednisolon er det vanligste kortikosteroidet som brukes, og dosen tilpasses individuelt.
- Andre immunsuppressive midler: Ved utilstrekkelig effekt av kortikosteroider eller ved tilbakefall etter avsluttet behandling, kan andre immunsuppressive midler som azatioprin eller mykofenolatmofetil forsøkes.
OP assosiert med revmatisk sykdom:
- Behandling av underliggende sykdom: Det er viktig å behandle den revmatiske sykdommen som er årsaken til OP. Dette kan innebære justering av immunsuppressiv behandling eller bruk av biologiske legemidler.
- Kortikosteroider: Kan også brukes ved OP assosiert med revmatisk sykdom, men effekten er ofte mindre enn ved COP.
- Andre immunsuppressive midler: Kan forsøkes ved utilstrekkelig effekt av kortikosteroider eller ved tilbakefall.
Supplerende behandling: Ved hypoksi (lavt oksygennivå i blodet). Antibiotika ved mistanke om bakteriell infeksjon. Støttebehandling: For eksempel fysioterapi og ernæringsstøtte.
Prognose og oppfølging: Prognosen for OP er generelt god, spesielt ved COP. De fleste pasienter responderer godt på behandling med kortikosteroider, og lungefunksjonen bedres ofte betydelig. Ved OP assosiert med revmatisk sykdom kan prognosen være mer variabel, avhengig av alvorlighetsgraden av den underliggende sykdommen. Regelmessig oppfølging med lungefunksjonstester og bildediagnostikk er viktig for å monitorere sykdomsforløpet og behandlingseffekten (Yoo JW, Song JW Radiology, 2011).
Lungecyster
Lymfocytisk Interstitiell Pneumoni (LIP)
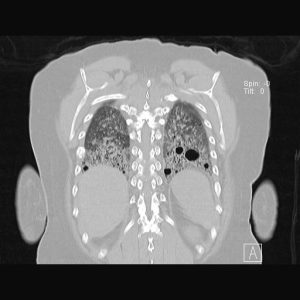
Definisjon. Lymfocytær interstitiell pneumoni (LIP) er en sjelden lungesykdom karakterisert ved benigne ansamlinger av lymfocytter, små knuter (noduli) og lymfoide follikler i lungevevet. Disse forandringene er ofte asymptomatiske.
Assosiasjon med revmatisk sykdommer og andre tilstander.
LIP ses hyppigst hos pasienter med Sjøgrens syndrom, en autoimmun sykdom som primært rammer kjertler som produserer spytt og tårer. Sjeldnere kan LIP også forekomme ved revmatoid artritt (RA) og ved systemisk sklerose. I tillegg er LIP assosiert med noen sjeldne genetiske tilstander, som for eksempel Birt-Hogg-Dubé syndrom (Minnis P, 2016) og andre sjeldne differensialdiagnoser (se tabell nedenfor).
Bildediagnostikk. CT-undersøkelse av lungene er viktig for å diagnostisere LIP. Typiske funn er multiple tynnveggede cyster (Gupta N, 2016).
Laboratorieprøver. Ved utredning av LIP er det relevant å undersøke for spesifikke antistoffer i blodet, som kan gi holdepunkter for underliggende revmatisk sykdom. Aktuelle immunologiske blodprøver inkluderer:
- ANA (antinukleære antistoffer): En gruppe antistoffer som ofte er positive ved autoimmune sykdommer.
- SSA (anti-Sjögren’s syndrome-related antigen A) og SSB (anti-Sjögren’s syndrome-related antigen B): Antistoffer som ofte er positive ved Sjögrens syndrom.
- Anti-CCP (antistoffer mot cyklisk citrullinert peptid): Antistoffer som ofte er positive ved revmatoid artritt.
| Differensialdiagnoser ved multiple lungecyster (tilpasset etter Berger I et al, Tidskr nor legefor, 2020) |
|||
| Diagnose | Cystekontur | Distribusjon | Tilleggsfunn i thoraks |
| Lymfoid interstitiell pneumoni (LIP) | Runde, ovale, irregulære. Størrelsen varierer | Diffus peribronkovaskulær, subpleural, basal | Mattglass-fortetninger. Noduli i akutte stadier. Ev. Sjøgrens syndrom |
| Lymfangioleiomyomatose (LAM) | Runde, små. Irregulære ved langt-kommet sykdom | Diffus, mer sentral | Ev. noduli. Mattglass-fortetninger. Chylothoraks |
| Nevrofibromatose-kompleks (NFC) | Runde, små | Diffus, få | Noduli |
| Pulmonal langerhans celle-histiocytose (PLCH) | Runde, ovale, Irregulære/bisarre | Øvre og midtre lungefelt. Utsparing av costo-freniske vinkel | Små, stjerneformede noduli. Varierende tykkelse på cystevegger |
| Birt-Hogg-Dube-syndrom (BHD) | Runde, ovale. Irregulære. Varierer i størrelse | Midtre og nedre lungefelt. Subpleuralt, peribronkovaskulært | Ingen |
Andre lungeforandringer ved revmatisk sykdom
Air trapping og mosaikk-mønster på CT kan indikere reversible forandringer med potensiale for lungemedisinsk behandling ved follikulær bronkiolitt. Derimot er obliterativ bronkiolitt ofte behandlings-refraktær.
Bronkiektasier ses hyppig ved RA og som følge av kronisk lungesykdom også ved andre revmatiske sykdommer. De medfører redusert lungefunksjon og økt risiko for residiverende infeksjoner.
Lungeblødning / alveolær diffus blødning ses ved ANCA-vaskulitter, særlig MPA og GPA der de kan være blant initiale symptomer, sjeldnere ved SLE, ved antifosfolipid syndrom, kryoglobulinemi og anti-GBM vaskulitt (Goodpastures).
Nodulære lesjoner kan representere revmatoide knuter (RA-noduli) som ses ved a-CCP positiv RA. Oftest foreligger RA-knuter også på strekksiden av albuer, fingre eller andre lokaliseringer. En sjelden gang kan RA-noduli i lunger medføre ruptur og pneumotoraks. Granulomer ved ANCA-vaskulitt eller sarkoidose er differensialdiagnoser.
Knuter i lunger skal vurderes nøye for å utelukke malignitet. Metastaser, primære lungetumorer, men også MALT-lymfom som har økt forekomst ved Sjøgrens og RA. Lymfomatoid granulomatose (LYG) er en malign, Epstein-Barr assosiert lymfoproliferativ sykdom med bilaterale nodulære forandringer i lungene. Diagnosen baseres på histologi med granulomer som inneholder maligne B-lymfocytter (Vikse J, 2021). Ved uklare nodulære fortetninger er tett oppfølging og om nødvendig også biopsi aktuelt. Radiografisk kan man basere seg på CT-funn i henhold til Fleischner anbefalinger (MacMahon H, 2017) (se tabell nedenfor) .
| Fleischner anbefalinger for oppfølging av solide og delvis knuter/lungefortetninger hos voksne (MacMahon H, 2017) | ||||
| Knute/nodulus type | <6mm* | 6-8mm* | >8mm* | Kommentarer |
| En enkelt nodulus | ||||
| Lav risiko** | Ingen rutinemessig kontroll | CT ved 6-12 mnd og vurder ny CT ved 18-24 mnd | Vurder CT ved 3 mnd, PET/CT eller biopsi | Knuter<6mm trenger ikke rutine-kontroll blant lavrisiko-pasienter |
| Høy risiko*** | Vurder å gjøre CT etter 12 mnd | CT ved 6-12 mnd | Vurder CT ved 3 mnd, PET/CT elelr biopsi | Spesielle pasienter med høy risiko og suspekt nodulus morfologi, lokalisering i øvre lungelapper eller kombinasjoner av dette bør sikres kontroll innen 12 måneder. |
| Multiple noduli | ||||
| Lav risiko** | Ingen rutine-kontroll | CT ved 3-6 mnd, vurder også ved 18-24 mnd | CT ved 3-6 mnd og ved 18-24 mnd | Vurder anbefalingene basert på den mest suspekte knuten. Kontroll-intervaller kan variere etter størrelse og risiko. |
| Høy risiko*** | Vurder CT etter 12 mnd | CT ved 3-6 mnd og ved 18-24 mnd | CT ved 3-6 mnd og ved 18-24 mnd | Vurder anbefalingene basert på den mest suspekte knuten. Kontroll-intervaller kan variere etter størrelse og risiko. |
| Mindre tette knuter og infiltrasjoner | <6mm (<100m3) | ≥6mm | ||
| En enkel fortetning | ||||
| Mattglass | Ingen rutine kontroll | CT ved 6-12 mnd for å bekrefte persistens, deretter CT hver 2. år i 5 år | Suspekte knuter/fortetninger < 6mm vurderes kontrollert etter 2 og 4 år. Hvis fast konsistens eller vekst, bør reseksjon vurderes. | |
| Delvis fast konsistens | Ingen rutine kontroll | CT ved 3-6 mnd for å bekrefte persistens,. Hvis uendret og fast konsistens < 6mm anbefales årlig CT i 5 år. | I praksis kan knuten med delvis fast konsistens ikke sikkert defineres før ≥6 mm og knuter <6mm behøver vanligvis oppfølgende kontroll. Persistente delvis faste knuter med fast komponent ≥6 mm bør oppfattes som høyst suspekte. | |
| Multiple | CT etter 3-6 mnd. Hvis stabil, vurderes CT etter 2 og 4 år. | CT ved 3-6 mnd. Videre oppfølgning baseres på den/de mest suspekte knuten(e). | Multiple <6mm rene mattglass fortetninger er vanligvis benigne, men vurder oppfølging hos utvalgte pasienter med høy risiko etter 2 og 4 år. | |
| * Gjennomsnitt av lange og korta akse. **Pasienter uten røke-anamnese eller andre risikofaktorer ***Røke-anamnese eller andre risikofaktorer |
||||
Emfysem subkutant kan påvises med røntgen eller CT. Kliniske foreligger krepitasjoner (“kram snø”) ved palpasjon. Årsaker kan være komplikasjon til respiratorbehandling, spontan pneumotoraks eller etter skader, inklusiv dykkerulykke.
Ikke-interstitielle lungeforandringer
Hilusadenitt
Årsaker: Forstørrede lungehili kan skyldes sykdom i lymfeknute, blodkar eller i bronkiene: Sarkoidose. Tuberkulose. Hodgkins lymfom. Ca. pulm. GPA/Wegeners. Hjertesvikt. Pulmonal arteriell hypertensjon (PAH). Eisenmengers syndrom (kongenital kardial septumdefekt med venstre-høyre shunt øker pulmonalarterietrykket og kan gå over til høyre-venstre shunt). Pulmonalarterie aneurisme. Mononukleose. Meslinger.
- Vennligst se også kapitlet om lymfadenopati.
Laboratorieprøver, bildediagnostikk, vevsprøver
- Vennligst se eget kapittel om utredning av systemiske bindevevssykdommer
Årsaker: Mangel på antitrombin, Protein C eller Protein S. Stase. Traume. Antifosfolipid syndrom (ApLS)
Hovedsymptomer: Dyspne 58-84 %, Brystsmerter 58-88 %, Tachypne 70-85 %, Tachykardi 30-58 %
Utredning: Pulmonary embolism severity index (PESI) (Kalkulator). Laboratorium: D- Dimer (fibrinolytisk nedbrytningsprodukt av fibrin, FDP) økt hos 20-96 %, ikke tolkbart i svangerskap. PaO2 redusert hos 80-90 %
Bildediagnostikk: Røntgenologisk pleuravæske hos 30-69 %. CT etter lungeemboli-protokoll: sensitivitet 64-100 %, spesifisitet 89-100 % (likevel ikke for helt perifere tromber). Scintigrafi av lunger: hvis normal = ingen lungeemboli. Pulmonal angiografi (gullstandard): sensitivitet 98 %, spesifisitet 96 %.
Behandling: Massiv emboli — trombolyse heparin direkte i blodet, supplere med oksygen og morfin. Mindre emboli — Fragmin 200 IE/kg s.c x 1 + start warfarin eller DOAC (ikke DOAC ved ApLs).
- Vennligst er også kapitlet om blodsykdommer
Lunge-infiltrater, ikke-revmatologiske
Maligne sykdommer: Ca. pulm. Hodgkins lymfom. Lymfomatoid granulomatose (lunge-lymfom). Metastaser. Myelomatose
Kardiovaskulære: Lungeødem. Emboli. Oksygen-indusert
Infeksjoner: Pneumocystis jiroveci. Mycoplasma pneumoni. Tbc. aspergillose og andre fungale infeksjoner. Chlamydia psittaci pneumoni. Virus
Hypersensitivitet: Medikamenter. Astma
Corpus alieni: Dust lung, farmers lung, aspirasjon
Avleiringer: Hemosiderose. Amyloidose.
Infiltrater med eosinofili: EGPA / Churg Strauss. Løfflers. Astma. Kronisk eosinofil pneumonitt.
Andre: Uremi. Proteinose (Pulmonary alveolar proteinosis, PAP). Stråleskade. Hamman-Rich syndrom (akutt interstitiell pneumoni med høy dødelighet). Hand Schüller Christian sykdom (en histiocytose). Eosinofilt granulom.
Litteratur
- Herold G og medarbeidere, Innere Medizin, 2024
- Leuckfeldt I, 2023 (lungetransplantasjon i Norge)
- Ewig S, 2021
- MacMahon H, 2017 (lungefortetninger/noduli)
- Holle JU, 2011 (vaskulitt)
