BASISKOMPETANSE (REV 001-005)
2 Anatomi, fysiologi, patologiske prosesser (REV 001-002)
Jan Tore Gran and Øyvind Palm
Læringsmål REV 001. Revmatologen skal ha god kunnskap om anatomi og fysiologi ved normale og patologiske prosesser relevant for revmatiske sykdommer, herunder beinmetabolisme, fatigue, inflammasjon, smertefysiologi og smertemekanismer.
Læringsmål REV 002. Revmatologen skal ha god kunnskap om normal, samt mikroskopisk og makroskopisk pato-anatomi og histologi av organsystemer og vev relevant for revmatologiske sykdommer.
- Benmetabolisme er beskrevet i kapitlet om osteoporose. Fatigue er omtalt i eget kapittel, Inflammasjon beskrives i kapitelet om immunsystemet og smertefysiologi og smertemekanismer er beskrevet i kapitlene om smertetilstander, fibromyalgi, algodystrofi og analgetika.
Ledd og leddsykdommer
Et ledd er en bevegelig forbindelse mellom to eller flere ben. Leddene gir oss mulighet til å bevege oss, og de finnes i alle deler av kroppen. Det er tre hovedtyper ledd:
Ekte ledd: Disse leddene har en leddhule fylt med leddvæske. Leddvæske smører og nærer leddbrusk og andre strukturer i leddet. Ekte ledd er de mest bevegelige leddene i kroppen, for eksempel skulder-, albue, hofte og kneledd. Skulderleddet er også et eksempel på et sammensatt ledd, der flere ledd fungerer sammen.
Halvekte ledd: Disse leddene har en leddskive av fibrobrusk som deler leddet i to rom. Halvekte ledd er mindre bevegelige enn ekte ledd. Eksempler er kjeveledd og håndledd.
Uekte ledd: Disse leddene har ingen leddhule eller leddbrusk. Uekte ledd er de minst bevegelige leddene i kroppen. Forbindelsen mellom tenner og tannkjøtt er uekte ledd der tennene er festet med et ligament.
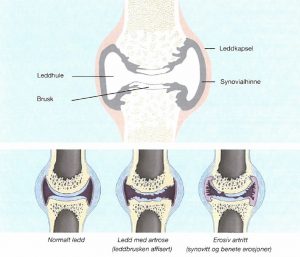
De forskjellige strukturene i et ledd jobber sammen for å gi bevegelse, stabilitet og støtte:
- Leddflater og brusk. Leddflater danner overflatene i ledd. De er dekket av leddbrusk.
- Leddhulen er et lukket rom mellom leddflatene. Leddhulen er fylt med leddvæske.
- Leddkapselen er en bindevevshinne som omgir leddet. Leddkapselen inneholder leddhulen og leddvæske.
- Leddbånd er sterke bånd av bindevev som forbinder leddbenene og stabiliserer leddet.
- Sener er bånd av bindevev som fester muskler til ben. Sener kan bidra til å bevege leddet.
- Leddskiver (i halvekte ledd): En skive av fibrobrusk som deler leddet i to rom. Leddskiver bidrar til å stabilisere leddet og fordele belastningen jevnt.
- Menisker (i kneleddet): En C-formet skive av fibrobrusk i kneleddet. Menisken bidrar til å stabilisere kneleddet og fordele belastningen jevnt.
- Synovialvæske er en tyktflytende væske som smører og nærer leddbrusk og andre strukturer i leddet.
I tillegg til disse kan ledd også inneholde andre strukturer, som for eksempel fettvev og blodkar.
Leddbrusk og bruskskade
Den viktigste funksjonen til brusken er å ta opp og fordele belastning over den underliggende benvevet. Brusken har en unik evne til å tåle kompresjon og gjenopprette sin opprinnelige form.
Oppbyggingen av brusk. Brusk er en sentral del av de fleste ledd og en viktig struktur i patogenesen av revmatiske sykdommer, som revmatoid artritt (RA) og artrose. Brusk består av celler (kondrocytter) liggende i en matrise av kollagen og grunnsubstans (proteoglykaner og vann). Brusken er avaskulær, alymfatisk, aneuronal og agenerende (Holck P, snl, 2020). Det aller meste, 85-90%, av kollagenet i brusk er av type II, i motsetning til type I som dominerer i benvev. Kollagen type III finnes i hud, synovium og karvegger.
Bruskskade. Flere mekanismer kan utløse bruskskade. Mest kjent er fysisk overbelastning ved skader, men også inflammatoriske prosesser ved revmatiske sykdommer kan føre til bruskskade. På cellenivå vil cytokiner som som interlukin-1 (IL-1), IL-6 og tumor nekrose faktor -alfa (TNF-alfa) indusere nedbrytning av ekstracellulær matriks, kondrocytter og dermed brusken. Omfattende forskning pågår for å avklare mekanismene bak bruskskade mer detaljert. Et av målene med dette er å komme frem til effektive medikamenter (Tateiwa D, 2019).
Andre, ikke-revmatiske brusksykdommer omfatter kondrodystrofier (genetisk), svulster som benigne kondromer og sjeldnere malignt kondrosarkom. Leddbrusken begrenset evne til regenerasjon, noe som ble gjenkjent allerede i 1743 av John Hunter som slo fast “once destroyed is not repaired”. Resultatet er at selv små defekter ikke repareres og kan degenerere “bare areas” til artrose over tid.
Behandling av bruskskade.
Tilpasset trening, vektreduksjon ved overvekt og smertelindring er de viktigste tiltakene ved bruskskade og artrose i vektbærende ledd (Katz JN, 2022). Regenerering av brusk er en stor utfordring:
- Kirurgisk behandling har ikke vist seg vellykket over tid for en stor del av pasientene, men vurderes i enkelte tilfeller.
- Stamceller fra benmarg kan muligens bidra til vellykket behandling i fremtiden (Gorgan S, 2022; Jeng L, 2011).
- Injeksjoner med plateberiket plasma har usikker effekt (Benell KL, 2021; Ekås GR, 2015).
- Vekstfaktorer og hormoner kan fremme bruskvekst, men mangler terapeutisk bruk i praksis (Weng C, 2021).
Leddhinnen (synovialhinnen, synovium) og leddvæsken
Leddhinnen med synovialt vev (synovialhinnen) omgir leddene og bidrar til stabilitet, beskyttelse, ernæring av brusk og smøring av leddet via synovialvæsken. En balanse mellom anabole og proteolytiske enzymer er avgjørende for kontroll over reparasjon og nedbrytning av brusk og ledd. Matriksdegraderende enzymer, som matrix metalloproteinaser (MMPs), forekommer i normal synovialvæske, men i høyere konsentrasjon ved artritt og artrose (Tchetverikov I, 2005).
Leddhinnen inneholder ingen epiteliale strukturer og dermed ingen basalmembran. Dette betyr at det ikke er noen barriere mellom leddvæske og synoviale blodkar. Synoviocyttene (cellene i leddhinnen) ligger i en matrise (et element som holder andre strukturer på plass) som består av fibrøse proteiner som kollagen, elastin og glykosaminoglykaner (Martel-Pelletier J, 2016). Ligamentene rundt leddet smelter sammen med ytre deler av kapselen.
Leddvæske produseres i synovialhinnen. Den er til stede i små mengder for å dekke leddhinnens folder, fukte, smøre og ernære brusken, noe som reduserer friksjon og degenerasjon. Leddvæske gir også næring til leddbrusk, som ikke har noen blodtilførsel. I tillegg bidrar leddvæske til å fjerne avfallsstoffer fra leddene, og den har en viktig funksjon i å beskytter leddbrusk og andre strukturer i leddet mot infeksjoner. Det intraartikuIære trykket er normalt negativt, men blir positivt ved hydrops (ansamling av væske i leddet) og øker ytterligere ved fleksjon/ekstensjon av leddet. Det laveste trykket oppnås ved 30-40° fleksjon.
Mange av de patologiske forandringen i synovialhinnen gjenspeiles i leddvæsken. Inflammasjon øker permeabiliteten i synovialt vev. Patologisk leddvæske ved artritt kjennetegnes av betydelig forhøyet nivå av cytokiner som både initierer og vedlikeholder synovial inflammasjon. Forskning på leddvæske har bidratt til utvikling av en rekke effektive medikamenter som spesifikt hemmer proinflammatoriske cytokiner (McInnes IB, 2007; Orr C, 2017 ).
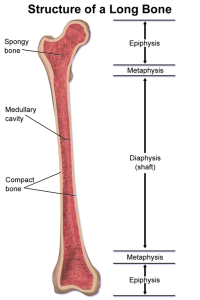
Ossøse deler
Epifyse (endedelen), metafyse (overgang mellom epifyse og diafyse) og diafyse (skaftet) er de tre hoveddelene av et rørformet ben. Metafyse-arterier ender i slyngede kar nær epifyselinjen.
Skade på benvev. En rekke inflammatoriske revmatiske sykdommer kan angripe ossøse deler av skjelettet. Osteoporose, uansett årsak, medfører redusert benmasse og dermed økt risiko for frakturer. Revmatoid artritt gjenkjennes ved usurerende skader i ledd. Juvenil artritt (barneleddgikt) kan føre til overvekst i epifyser i affiserte ledd. Hos barn rammes oftest metafysen av infeksiøs osteomyelitt. Større skjelettskader kan oppstå ved histiocytose, Paget sykdom og osteomyelitt. Ved systemiske bindevevssykdommer, for eksempel systemisk lupus (SLE), ses derimot ofte non-destruktiv artritt. Selv etter uttalt og langvarig artritt med feilstillinger kan radiologiske tegn til skade på ossøse deler mangle.
Betegnelser på ledd
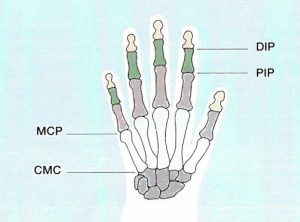
Hender
- Distale Inter-Phalangealledd (DIP)
- Angripes ofte ved artrose og ved psoriasisartritt, men ikke ved revmatoid artritt (RA)
- Proksimale Inter-Phalangealledd (PIP)
- Angripes ved artrose, RA og psoriasisartritt
- Meta Carpo Phalangealledd (MCP, grunnledd)
- Angripes ved RA og psoriasisartritt, ikke ved artrose
- Carpo Metacarpo Phalangealledd (CMC)
- CMC-1 (ved tommel) angripes ved artrose
Føtter
- MetaTarso Phalangealledd) (MTP) tilsvarer MCP (grunnledd) i hender
- Hele MTP-rekken angripes ved RA, MTP-1 (store tå) ved artrose (hallux valgus)
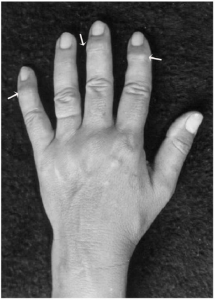
Illustrasjon til høyre: Ferrazzo KL, Osório LB, Ferrazzo VA – Case reports in dentistry (2013). CC BY 3.0
Typer av ledd
Synoviale / diarthrodiale ledd. Artikulasjoner med fri bevegelighet og synovial-membran (perifere ledd)
Synartroser er uekte ledd uten leddhule. Synartrose har svært redusert bevegelighet. Artikulasjon der de benete delene er forbundet med sammenhengende fibrøst vev. Det fines ulike former:
Symfyser er ben-deler som er separert av en skive. Leddet er bundet sammen av ligamenter (intervertebralt/pubis).
Synkondroser dekkes av brusk. Liten eller ingen synovialhinne eller leddhule (sternomanubrium). Synkondroser forbenes i løpet av oppveksten.
Syndesmoser forbindes via bindevev. Ben-delene sammenholdes av ligamenter uten at det foreligger brusk (distal tibiofibular).
Synostoser er benbruer = ankylose som normalt utvikles blant annet mellom skallebena fra 40 års alder.
Embryologi: Proksimale strukturer utvikles før distale (Proximodistal gradient). Kraniale strukturer dannes før kaudale (kranial til caudal gradient). Således vil overekstremiteten utvikles 24 timer før tilsvarende distale struktur. Dette har betydning ved fosterskader.
Artritt og synovitt
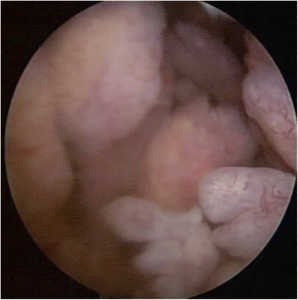
Artritt er en inflammatorisk tilstand i leddhinnen (synovitt). Synovialt vev, særlig fibroblast-lignende synoviocytter, er et hovedmålorgan for immunologiske angrep ved mange inflammatoriske revmatiske artritt-sykdommer, som revmatoid artritt, psoriasisartritt, men også ved artrose (Orr C, 2017). Histologisk ses mikroskopisk hyperplasi av cellelaget i synovialhinnen (synovitt). På cellenivå tilkommer en akkumulering av inflammatoriske celler slik som T- og B-lymfocytter, plasmaceller, makrofager, neutrofile, mast celler, killer cells og dendrittiske celler. Angiogenese bidrar til at synovialt vev transformeres til en invaderende “pannus” som kan skade både brusk og bensubstans (Mullan RH, 2007). Heterogenitet i synovialt vev med ulike immunologiske funksjoner på cellenivå kan forklare ulike fenotyper/uttrykksformer av revmatoid artritt (Bhamidipati K, 2022).
Mange av de patologiske forandringen i synovialhinnen gjenspeiles i leddvæsken. Økt intraartikulær væske (hydrops) med patologisk sammensetning og forhøyet trykk i leddet er karakteristisk. På cellenivå øker inflammasjon permeabiliteten i synovialt vev. Patologisk leddvæske ved artritt kjennetegnes av betydelig forhøyet nivå av cytokiner som både initierer og vedlikeholder synovial inflammasjon. Forskning på leddvæske har bidratt til utvikling av en rekke effektive medikamenter som spesifikt hemmer proinflammatoriske cytokiner (McInnes IB, 2007; Orr C, 2017 ).
- Symptomer på artritt og andre kliniske forhold er beskrevet i eget kapittel
Pannus. Når inflammatorisk vev sprer seg fra leddhinnen (synovia) til brusk på en ekspansiv måte, kalles det pannus. Dette kan sees tydeligst ved direkte inspeksjon (artroskopi), MR eller ultralydundersøkelser. Pannus kan ved revmatoid artritt bestå av makrofager, fibroblast-lignende synoviocytter (FLS), dendrittiske- eller plasmaceller og mastceller. Disse cellene spiller en rolle i å forårsake skade på brusk og benvev, noe som kan føre til erosjoner (Jang S, 2022).
Artritt-sykdommer. Typiske autoimmune artritt-sykdommer inkluderer revmatoid artritt (RA), urinsyregikt, juvenil artritt (barneleddgikt) og spondyloartritter (psoriasisartritt, reaktiv artritt, Bekhterevs /ankyloserende spondylitt og IBD-relatert artritt). Artritt ved infeksjon omtales som infeksiøs artritt eller septisk artritt.
- Vennligst se også egen del i boken som omhandler artrittsykdommer.
Ryggsøylen
Ryggsøylen (columna vertebralis), er en kompleks struktur som gir støtte, stabilitet og bevegelighet til kroppen. Den er bygd opp av vanligvis 24 virvler som er forbundet av ledd, muskler og ligamenter.
Ryggsøylen kan deles inn i fem seksjoner:
- 7 halsvirvler: Gir bevegelighet til hodet.
- 12 brystvirvler: Festet til ribbeina og danner brystkassen.
- 5 lendevirvler: Bærer mye av kroppens vekt.
Hver virvel har en kropp og en bue. Buen danner en ring som omslutter ryggmargen. Mellom virvlene er det bruskskiver som fungerer som støtdempere og gir bevegelighet.
Fasettleddene er synovialledd som finnes mellom de fleste virvlene. De er små ledd som gir bevegelighet i ryggraden, men begrenser også bevegelse for å beskytte ryggmargen. Fasettleddene er dekket av brusk og omgitt av en synovialhinne som produserer leddvæske.
Skiveleddene er mellomvirvelskivene som ligger mellom virvlene. De fungerer som støtdempere og gir bevegelighet i ryggraden. Skiveleddene er bygd opp av en geleaktig kjerne omgitt av en fibrøs ring.
Iliosakralledd er et synovialledd som forbinder korsbenet (sacrum) med hoftebeinet (ilium). Det er et kraftig ledd som gir stabilitet til bekkenet og ryggraden og absorberer støt. Iliosakralleddet er dekket av brusk og omgitt av en synovialhinne som produserer leddvæske. Inflammasjon i iliosakralledd (sakroiliitt) er essensielt ved spondyloartritt.
Det er en rekke sykdommer som kan ramme ryggsøylen. Noen av de vanligste åer muskelspenninger, slitasjegikt, skiveprolaps og isjias som er beskrevet i et eget kapittel. For revmatologen er også spondyloartritt en viktig sykdomsgruppe.
Bindevev og bindevevssykdommer
Bindevev er et av de viktigste vevene i kroppen. Det finnes i alle organer og systemer, og gir støtte, struktur og stabilitet til kroppen. Bindevev er bygd opp av forskjellige celler og fibre. Løst bindevev finnes mellom organer og vev, og gir støtte og fylling. Fast bindevev i sener, leddbånd og bein, og gir styrke og stabilitet. Spesielt bindevev inkluderer fettvev, blod og lymfe, og har forskjellige funksjoner i kroppen. Bindevev består hovedsakelig av den ekstracellulære matriks (ECM) som igjen består av proteinfibre (først og fremst kollagen) og grunnsubstans.
Kollagener er ekstra-cellulære polypeptider med en høy andel av aminosyrene prolin og hydroksyprolin. Type I utgjør 90 % av alt kollagen i organismen. Type III finnes i hud, synovium og blodkarvegg. Kollagen syntetiseres fra pre-prokollagen til kollagen. Ved høy omsetning øker mengden av aminoterminal propeptide type III (PIIINP) og av type I (PINP), samt karboksyterminal peptid type I (PICP). I osteoporose-behandlingen er det nyttig å måle PINP, da det er den beste markøren for osteoblastaktivitet (oppbygging av bensubstans).
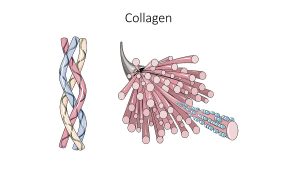
De lange kollagenfibrene er representert av kollagentypene I, II, Ill, IV og XI. De enkelte kollagenfibrene er bundet sammen av korte kollagenfibre (kollagen IX, XII og XIV). Kollagen VII binder kollagenfibrene til den basale lamina, en tynn membranliknende struktur som skiller ECM fra cellene. Kollagen inneholder mye av aminosyrene hydroksyprolin og hydroksylysin.
Grunnsubstanser:
Glykosaminoglykaner, proteoglykaner og glyko-proteiner er grunnsubstanser i bindevevet. Disse forsterker ECM og bindes til bl.a. reseptorproteiner på overflaten av celler (integriner).
-Glykosamino-glykaner består av uronsyrer (glukuronsyre og iduronsyre) og heksosaminer (glukosamin og galaktosamin).
-Proteoglykaner består av et protein assosiert med glykosamino-glykaner som dermatan-, kondroitine-, keratin- og heparansulfat.
-Aggrecan er det dominerende proteoglykanet i bruskvev.
-Glykoproteiner. Eksempler på glykoproteiner er fibronektin og laminin.
Fibroblaster syntetiserer bl.a. kollagen, elastin, glykosaminoglykaner, proteoglykaner og vekstfaktorer. Disse cellene kan transformeres til myofibroblaster, som har trekk av både fibroblaster og glatte muskelceller.
Systemiske bindevevssykdommer kan angripe ulike deler av bindevevet ved en autoimmun prosess. Symptomene på bindevevssykdommer kan variere mye avhengig av typen sykdom og hvilke organer som er rammet. Typiske systemiske bindevevssykdommer inkluderer systemisk lupus erythematosus (SLE), Sjøgrens sykdom, MCTD, myositt og systemisk sklerose.
- Vennligst les mer om systemiske bindevevssykdommer i egen del av boken.
Blodårer, vaskulitt og vaskulittsykdommer
Blodårer er et nettverk av rør som transporterer blod, oksygen og næringsstoffer til alle deler av kroppen. De er avgjørende for kroppens funksjon og overlevelse. Blodårene kan deles inn i arterier, vener og kapillærer. De er alle bygd opp av tre lag:
- Tunica intima: Det innerste laget er laget av endotelceller, som er glatte celler som sørger for en jevn blodstrøm.
- Tunica media: Det midterste laget er laget av muskelceller og elastiske fibre, som gir blodårene styrke og fleksibilitet.
- Tunica adventitia: Det ytterste laget er laget av bindevev, som beskytter blodårene.
Blodårene har en rekke viktige funksjoner. De transporterer arterielt, oksygenrikt blod fra hjertet til alle deler av kroppen, næringsstoffer fra fordøyelsessystemet til vevene og avfallsstoffer fra vevene til lungene og nyrene, hvor de skilles ut fra kroppen. I tillegg transporteres hormoner fra kjertlene til målorganene. Blodårene hjelper også til med å regulere kroppstemperaturen ved å utvide eller trekke seg sammen.
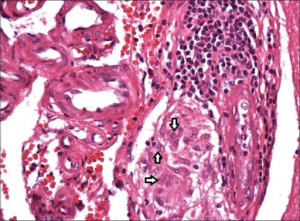
Vaskulitt defineres som en inflammasjon av selve karveggen med eller uten nekrose, forsnevring av karlumen eller trombosering. Vaskulitt kan være lokalisert overfladisk til hud (kutan vaskulitt) eller dypere hudlag og indre organer (systemisk vaskulitt). Ofte brukes betegnelsen synonymt med arteritt, men vaskulitt omfatter vegg-inflammasjon av alle typer kar, også vener.
Histologiske forandringer ved vaskulitt. Karakteristisk for vaskulitt er oppsvulmet endotel, fibrinutfelling i karveggen, granulocytter i karveggen, kjerne-fragmenter perivaskuIært (leukocytoklase) og ekstravaserte erytrocytter. For diagnosen vaskulitt kreves betennelsesceller i karvegg og endotelskade. Beste bevis på endotelskade er ekstravasering. Med fibrinoid nekrose menes akkumulering av proteiner (fibrin) i karveggen som ses ved flere typer kar-skader.
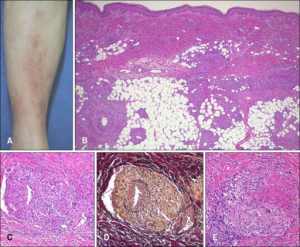
-Kjempeceller er store, flerkjernede celler kalles kjempeceller og ses blant annet ved temporalis arteritt (kjempecelle arteritt), uten å være spesifikke for denne sykdomsgruppen.
-Leukocytoklastisk vaskulitt betegner alle lesjoner hvor det kan påvises fragmenter av leukocytter (kjernestøv = nukleær dust) (leukocytoklase). Multiple årsaker (Bouiller K, 2016).
-Nekrotiserende vaskulitt. Nekrotiserende vaskulitt kjennetegnes ved destruksjon og fibrinoid degenerasjon, neutrofil infiltrasjon av celleveggen og perivaskuIær blødning og leukocytoklase.
-Granulomatøs arteritt og granulomer. Et granulom er et fokalt område med granulomatøs betennelse. Granulomatøs arteritt karakteriseres av granulomer eller granulomatøs betennelse. Sistnevnte defineres som en kronisk betennelse hvor den dominerende celletypen er aktiverte makrofager med epitelliknende utseende (epiteloide celler). Granulomatøs betennelse ses ved sarkoidose, infeksjoner, GPA (sammen med fibrinoid nekrose).
- Vennligst les om vaskulitt i en egen del av kompendiet.
