BINDEVEVSSYKDOMMER (REV 021-033)
46 Utredning med rutine-blodprøver, antistoffer / biomarkører (ANA med flere), urinprøver, bildediagnostikk og vevsprøver ved Systemiske Bindevevssykdommer (REV 025)
Jan Tore Gran and Øyvind Palm
Autoimmune sykdommer angriper ca. 5% av befolkningen. De fleste tilfellene diagnostiseres ved hjelp av blodprøver som gjenspeiler inflammasjon, organfunksjon og av serum antistoff. Disse antistoffene kan være diagnostiske og prognostiske markører. Bildediagnostikk og biopsi er ofte avgjørende for en sikker diagnose. Undersøkelsene er også viktig for persontilpasset behandling.
Antistoffer kan dukke opp før kliniske symptomer på de ulike sykdommene. De korrelerer dårlig med sykdomsaktivitet, men kan hjelpe å identifisere fenotyper med forventede spesifikke organmanifestasjoner. Antistoffer kan derfor være viktige for valg av tilpasset behandling og oppfølging (Sirotti S, 2017).
Blodprøver
Blodprøver er kan brukes til å vurdere inflammatorisk aktivitet, tegn på organskade og til å skille mellom de forskjellige autoimmune sykdommene. Blodprøver er omtalt generelt med tolkninger i eget kapittel og under hver enkelt diagnose.
En “pakke” med orienterende laboratorieprøver bør omfatte:
SR, CRP, Hemoglobin, trombocytter, leukocytter med diff.telling, elektrolytter, CK, ALAT, ASAT, ALP, LD, kreatinin, albumin, glukose, TSH, f-T4, Na, K, Ca. Antistoff: a-CCP, ANA, a-dsDNA, ENA. Urin stiks
- Ved myositt: Myosittspesifikke antistoff.
- Ved SLE eller Sjøgrens: C3 og C4 (komplementfaktorer).
- Systemisk sklerose: Sklerodermi-antistoff. Pulmonal hypertensjon: Pro-BNP
- Differensialdiagnose: Mistanke om sarkoidose: ACE.
- Differensialdiagnose: Vaskulitt: ANCA, kryoglobuliner, elektroforese, kryofibrinogen
- Differensialdiagnose: IgG4 relatert sykdom: IgG4 og IgG
Antinukleære antistoff (ANA) er ofte tilstede og er markører, men ikke obligate for spesifikk diagnose.
| Subklasser av ANA | Sykdoms-assosiasjon |
| Anti-dobbeltkjedet (nativt) DNA (anti-Dna) | SLE |
| Anti-centromer (CENP) | Systemisk sklerose, begrenset form (CREST) |
| Anti-C1q | SLE, hypokomplementær urticaria (HUVS) |
| Anti-Sm (Smith) | SLE
|
| Anti-RNP (U1RNP) | MCTD |
| Anti-SSA (Ro 52/60) | Sjøgrens, SLE (særlig subakutt, kutan form) |
| Anti-SSA (La) | Sjøgrens, SLE (særlig subakutt, kutan form) |
| Anti Scl70 (topoisomerase I) | Systemisk sklerose, diffus form |
| Anti-PMScl75/100 | Skleromyositt (overlapp systemisk sklerose og polymyositt) |
| Anti-Jo-1 | Antisyntetase syndrom |
ANA (Antinukleære antistoff)
ANA er autoantistoffer rettet mot bestanddeler i cellekjernen. ANA påvises ved de fleste systemiske (autoimmune) bindevevssykdommene, men produseres også ved andre tilstander og i lave titere hos 1 – 5% av friske, gjerne eldre personer. ANA kan også induseres av medikamenter. Hvilke strukturer i cellekjernen antistoffet er rettet mot, avgjøres ved bestemmelse av subspesifisiteter (subklasser). Anti-ENA (ekstraherbare nukleære antistoff) omfatter en rekke ANA antistoffer som med spesielle metoder kan ekstraheres (ANApatterns.org). ANA er positiv hos ca. 60% med juvenil artritt, særlig oligoartikulær JIA.
En negativ ANA-test kan med stor sikkerhet utelukke flere typer systemiske bindevevssykdommer, slik som SLE og MCTD. Imidlertid ses inflammatorisk myositt, Sjøgrens syndrom og systemisk sklerose selv om ANA-testen er normal. Analyse av ekstraherbare antinukleære antistoff (ENA) er imidlertid positiv hos de aller fleste. Vennligst les mer om ANA tester i eget kapittel for bindevevssykdommer.
Positiv ANA-test forekommer oftest i høye titere ved systemiske bindevevssykdommer som SLE og MCTD, men også ved andre autoimmune sykdommer som autoimmun hepatitt og thyreoiditt. En positiv ANA test bør derfor utredes med videre undersøkelser. Ved myositt og ved systemisk sklerose kan immunologisk laboratorium utføre mer omfattende diagnose-spesifikke antistoffundersøkelser (“myositt-spesifikke antistoff, skleroderma-blott”) som er beskrevet under disse sykdommene.
-Årsaker til “falsk” positiv ANA-test:
- 1-5 % av friske personer har ANA i lave titere, stigende insidens med stigende alder.
- Noen ELISA-tester kan være forurenset, noe som kan gi falskt positive resultater.
- Medikamenter kan indusere ANA uten kliniske manifestasjoner (prokainamid, isoniazid, klorpromazin).
- Andre årsaker:
- Inflammatoriske sykdommer: Glomerulonefritt, tyreoiditt, myastenia gravis, kronisk leversykdom.
- Infeksjonssykdommer: Akutt hepatitt, infeksiøs mononukleose (EBV).
- Maligne sykdommer: Leukemi.
Testmetoder. Generelt kan en dele testmetodene inn i to hovedgrupper; de manuelle og de elektrokjemiske metodene. Blant de manuelle er immunfluorescens (IF)-testen oftest benyttet, mens ELISA (EliA er en variant) benyttes som elektrokjemisk metode.
| Metode | Fordeler | Ulemper |
| IF-ANA | Kostnadseffektiv, enkel å gjennomføre. Høy sensitivitet og spesifisitet | Tidkrevende, subjektiv vurdering kan medføre falsk positive resultater. ENA-klassifisering er vanskelig. Kvalifisert personal er nødvendig. |
| ELISA (EliA) | Automatisert. Kvantifisering er mulig. Høy sensitivitet. Kan klassifisere antistoff | Falsk positive forekommer. Kostbar. Krever rent antigen for analysene. |
| DID | Kostnadseffektiv. Svært spesifikk. Påviser multiple antistoff samtidig. | Lav sensitivitet. Subjektiv vurdering av resultatene. Trenger store volum av prototype-sera. |
| CIE | Kostnadseffektiv. Høy-spesifikk. Påviser multiple antistoff samtidig. Raskere enn dobbel diffusjon | Moderat sensitiv. Subjektiv interpretasjon. Behøver store volum av sera. |
| PHA | Semikvantitativ. Høy-spesifikk | Tidskrevende. Krever rent antigen. |
| Western blot | Mer sensitiv enn DID og CIE. Høy-spesifikk | Kostbar. Tidskrevende. Påviser utelukkende lineære epitoper. |
| Dot/Line blot | Enkel å utføre. Høy-sensitiv og spesifikk. Kan automatiseres. | Kvalitativ. Vanskelig å skille mellom de enkelte antistoff. |
| MIA | Påviser multiple antistoff samtidig. Kvantifisering mulig. | Kostbar |
| Flowcytometri | Kostnadseffektiv. Automatisert. Høy-sensitiv | Ett resultat av gangen |
| Mikcro-array | Påviser multiple antistoff samtidig. Automatisering mulig. Høy sensitivitet og spesifisitet. Kostnadseffektiv | Begrenset tilgjengelighet |
Supplerende laboratorie-prøver ved høy ANA: SR, CRP: hvite med differensial-telling, trombocytter, leverenzymer, kreatinin, TSH, anti-thyreomikrosom / thyreoglobulin, anti-mitokondrie -antistoff/IgM, anti-HBsAg, HAV, anti-HBC total, RF, anti-CCP, kryoglobuliner, urin stiks og mikro. Myositt-spesifikke antistoff (MSA) eller skleroderma-blot ved aktuelle symptomer.
Subklasser av ANA (ekstraherbare nukleære antistoff/ENA og andre)
- Anti-single stranded (denaturert) DNA: SLE, RA, autoimmun hepatitt, glomerulonefritt, procainamid. Friske (3,7%)
- Anti-double stranded (nativt) DNA: SLE, RA, glomerulonefritt, mononukleose, sarkoidose (sjelden). Friske (0.3 %).
- Anti-Sm: nefritt
- Anti-DNA: nefritt
- Anti-C1q: Hypokomplementær urticaria (HUVS)
- Anti-Histon: Medikamentutløst lupus
- Anti-PCNA: Sjøgrens, hepatitt
- SSA; Sjøgrens, hepatitt, myositt
- SSB Sjøgrens, hepatitt
- RNP: MCTD
- NMO: Nevromyelitis optica
- ANCA: Uspesifikk (dersom fravær av PR3 eller MPO: ANCA-vaskulitt)
- Anti-RNP: MCTD eller SLE
- Anti-Ro (SSA): SLE, (MCTD), Subakutt kutan LE (SCLE).
- Anti-La (SSB): SLE, MCTD, SCLE. SSA-antistoff forekommer selv om ANA ikke slår ut.
Systemisk sklerose og antistoff
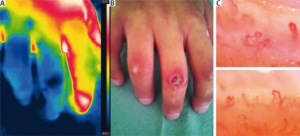
- Anti-centromer: / CENP: CREST (Systemisk sklerose begrenset form).
- Anti-Scl 70 (topoisomerase I): Systemisk sklerose, diffus form).
- RNA-polymerase-III: Systemisk sklerose, diffus form. Økt risk for renal krise (med alvorlig blodtrykksstigning og nyresvikt).
- Fibrillarin-antistoff (se U3-RNP nedenfor).
- Ku-antistoff: Uspesifikt antistoff som forekommer også ved flere andre autoimmune sykdommer som RA, systemisk sklerose og myositt: 1 av 3 har overlapp syndrom (ofte med innslag av systemisk sklerose), 28% SLE, 4% dermatomyositt/-polymyositt (DM/PM), 14% Systemisk sklerose og 20% andre autoimmune sykdommer (Ho T, 2003).
- PM-Scl 100 eller PM-Scl 75 indikerer sklero-myositt (myositt-overlapp: sjekk hudsymptomer, muskelkraft, atrofier og CK, EMG og MR av lårmuskler, Raynauds fenomen). PM-Scl 100 eller PM-Scl 75 forekommer hos ca. 80% med sklero-myositt.
- Th/To antistoff: Forekommer ved Systemisk sklerose, begrenset form. Antatt økt risiko for lunge-manifestasjoner og pulmonal hypertensjon.
- U3-RNP (fibrillarin-antistoff). Oftest ved diffus form av systemisk sklerose, men kan ses også ved primært Raynauds fenomen og ved SLE. Økt risk for pulmonal arteriell hypertensjon
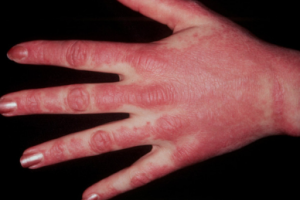
- SRP (Signal recognition particle (SRP)-antistoff): Myositt. Ofte akutt start med svelgebesvær (øsofagus-affeksjon) og ikke alle responderer godt på behandlingen (se også IMNM (immunmediert nekrotiserende myopati) (Kao HA, 2004)
- Mi-2 (anti-Nucleosome remodeling deacetyalse complex (NuRD)): Voksen og juvenil (hos barn) dermatomyositt (JDM). Forekommer hos 4-18% med myositt (totalt) og 31% med dermatomyositt (Ghiradello A, 2004)
- P-155/140 / TIF1-γ: (anti-Transcriptional intermediary factor 1 gamma). Assosiert med juvenil dermatomyositt og myopati med alvorlig hudaffeksjon hos voksne. Økt forekomst av kreft hos voksne (Muro Y, 2012). Juvenil DM med kalsinose
- SAE (anti-Small ubiquitin-like modifier activating enzyme). Voksne med dermatomyositt
- MDA-5 / Anti-CADM-140: (anti-Melanoma differentiation-associated gene 5). MDA-5 syndromet, amyopatisk dermatomyositt, ofte med alvorlig lunge-affeksjon
- TIF1Υ / P-155/140 cancer assosiert myopati / dermatomyositt
- NXP-2 (anti-nukleært matriks protein): cancer assosiert myopati / dermatomyositt (Fierotino DF, 2013)
- HMGCR (3-hydroxy-3-methylglutaryl-coenzym A reduktase): Statin-(kolesterolsenkende medikament) utløst myopati (men kan foreligge uten statin-bruk. Da assosiert med høy CK). Også assosiert med IMNM (immunmediert nekrotiserende myopati). Litt økt kreftrisiko tilsier generell undersøkelse
- Jo-1 (histidyl-antistoff): vanligste antistoff ved antisyntetase syndrom (Lungeaffeksjon + Myositt + antistoff. Ofte også hud: Gottrons papler/tegn, mekanikerfingre, sjal/V-tegn, artritt, Raynauds fenomen.)
- PL-7 (Theronyl-antistoff): antisyntetase syndrom
- PL-12 (Alanyl-antistoff): antisyntetase syndrom
- EJ (Glyceryl-antistoff): antisyntetase syndrom
- OJ (Isoleucyl-antistoff): antisyntetase syndrom
- KS (Asparaginyl-antistoff):antisyntetase syndrom
- Ha-YRS (Tyrosyl-antistoff): antisyntetase syndrom
- Zo (Phenylalanyl-antistoff): antisyntetase syndrom
- SSA antistoff (som ved Sjøgrens syndrom og SLE) forekommer også ved (dermato-) myositt og antisyntetase syndromet
- cN-1A (anti-cytosolic 5′-nucleotidase 1A ) kan foreligge ved Inklusjonslegeme-myositt (Pluk H, 2013)
- anti-Ku: Uspesifikt antistoff som forekommer også ved flere andre autoimmune sykdommer som RA, systemisk sklerose, myositt og overlappsyndromer (Hoa S, 2016)
Blodprøvers betydning for differensialdiagnoser er beskrevet i eget kapittel.
Urinprøver
Urinprøver er viktige ved undersøkelse av systemiske bindevevssykdommer. Urin stiks skal omfatte måling av erytrocytter (eller hemoglobin), protein, leukocytter, nitritt, glukose og PH. Ved aktuelle forandringer kan mengden proteinuri kvantiteres og protein/kreatinin eller albumin/kreatinin ratio beregnes. Under mikroskopi vurderes om celle-sylindre foreligger.
Vennligst les mer om urinundersøkelser i eget kapittel
Bildediagnostikk
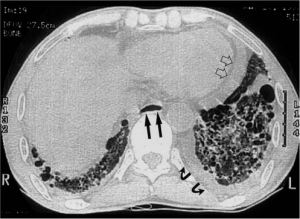
Systemisk sklerose, myositt, antisyntetase syndromet og Sjøgrens syndrom medfører ofte lungemanifestasjoner. Lungevevet vurderes best med HRCT som benytter mindre stråling enn konvensjonelle CT-undersøkelser. Ved oppfølging vurderes om lungefunksjonstester (LFT) kan erstatte gjentatte CT-undersøkelser for å redusere strålebelastningen. Dersom tumorer eller embolier ønskes vurdert må konvensjonell CT gjøres med tilsvarende protokoll. Vennligst se også eget kapittel om lungesykdommer. Ved svelgebesvær som ofte ses ved systemisk sklerose og ulike typer myositt, er dynamisk røntgen øsofagus aktuelt for å påvise eventuell øsofagusdysmotilitet.
Organspesifikke vevsprøver
Ved mistanke om SLE kan biopsi fra hud og nyrer vise tegn på sykdomstypiske immunkompleksnedslag. Hudbiopsi bør tas fra ikke-sol-eksponert område. Immunhistologisk undersøkelse gjøres på preparater lagt i saltvann (ikke formalin).
Biopsi fra små spyttkjertler i underleppen gjøres hovedsakelig for å diagnostisere Sjøgrens syndrom. For å definere sialoadenitt ved leppebiopsi kreves lymfocytt-infiltrasjon av betydelig grad med foci, evt. atrofi og destruksjon av kjertelelementer (Fokus score minst 1,0 hvor fokus defineres som ansamling av minst 50 mononukleære celler). Ultralyd av parotis- og submandibularis kan også benyttes. Differensialdiagnostisk kan biopsi fra store spyttkjertler (parotis, submandibularis) også være aktuelt ved tumorer, for eksempel for å avdekke IgG4 relatert sykdom. En må imidlertid være klar over risiko for fisteldannelse.
Tolkning av nyrebiopsi: Ved nyrebiopsi diagnostiseres nefritt og alvorlighetsgraden av denne. Dermed kan resultatet av nyrebiopsi bidra med informasjon om behandlingsbehov og prognose. Systolisk blodtrykk >160mmHg kan være kontraindikasjon.
-Halvmånedannelse er synonymt med ekstrakapillær proliferasjon. Cellene kommer fra det parietale epitel av Bowmans kapsel.
-Fibrinoid er et ekstracelluIært inflammatorisk eksudat (fibrin, serumproteiner, immun-aggregater og ekstracellulære matriks-proteiner som for eksempel fibronektin).
-Nekrose er neutrofile infiltrater med karyorrhexis (fragmenter av cellekjerner), fibrin eksudater og diskontinuiteter i basalmembranen.
-Hematoksylin-legemer er dannet av degenerert materiale fra cellekjernen. Sees hos bare 25 %, men er diagnostisk for SLE.
Ved nyrebiopsi bør det skilles mellom:
- Aktive lesjoner (glomerulær celleproliferasjon, leukocytt-eksudasjon,
- Fibrinoid nekrose, hyalin avleiring, cellulære halvmåner og interstitiell inflammasjon).
- Kroniske forandringer (glomerulær sklerose, fibrose halvmåner, tubulær atrofi og interstitiell fibrose).
Ved nyrebiopsi bør følgende has i mente: Hvis biopsien viser mindre grad av aktive lesjoner og samtidig akutt tubulo-interstitiell nefritt, må andre årsaker til nyresvikt enn SLE undersøkes.
Dårligst nyreprognose foreligger ved kroniske lesjoner. Funnene må tolkes i lys av hvor mange glomeruli som er funnet. Hvis 10 glomeruli gjenfinnes, er det en 35 % sjanse for at ingen affiserte glomeruli påvises, forutsatt at 10 % av alle er angrepet. Hvis man finner 20 glomeruli, er sjansen for å miste fokale forandringer redusert til 12%. Mange nefritt-pasienter har både proksimal og distal tubulus dysfunksjon. Segmentale forandringer betyr at bare en del av glomerulus er affisert og at heller ikke alle glomeruli har forandringer. Ved fokal nefritt er mindre enn 50% av glomeruli affisert. Hvis > 50% er angrepne, betegnes det som diffus. Ved immunhistokjemiske undersøkelser er det en tommelfingerregel at nedslag av flere typer IgG, C3 og C3 er LN inntil det motsatte er bevist. Vennligst les mer om nyrebiopsi under kapittelet om SLE.
Ved nyrebiopsi overvåkes pasienten i 24 timer på grunn av blødningsfare. Transistent hematuri sees hos 60-80%. Blødninger hos ca. 2%, hvorav mindre enn 50% trenger inngrep for å stanse blødning.
Lunger
| Interstitielle pneumonier i vevsprøver og bildediagnostikk |
||||
| Type | Interstitiell inflammasjon | Fibroblast proliferasjon | Intraalveol. Makrofager | CT-lunger: Bikake forandring |
| UIP (Usual interstitial p) | Minimal | Uttalt | ev. fokal | Flekket |
| DIP (Deskvamativ interstitial pneumoni) | Minimal | Ingen | Diffus | Ingen |
| DAD (Diffus alveolar damage) | Minimal | Diffus | Ingen | Ingen |
| LIP (Lymfocytær interst. pneumoni) | Uttalt | Ingen | Minimalt | ev. |
| NSIP (non-spesific interst. pneumoni) | Uttalt | ev. | Flekket | Sjelden |
Vennligst les mer om lunge-manifestasjoner ved revmatiske sykdommer i eget kapittel.
Litteratur
Pisetsky DS, 2023 (antistoff)
