ARTRITT (REV 006-REV 020)
35 Revmatoid artritt (RA), leddgikt (REV 006)
Øyvind Palm and Jan Tore Gran
Kjennetegn på revmatoid artritt (RA)
Revmatoid artritt (RA) kjennetegnes ved symmetrisk artritt, oftest i MCP- og PIP- og håndledd, samt tenosynovitt.
Diagnosen styrkes ved laboratorieprøver som viser lett-moderat forhøyet CRP og anti-CCP antistoff (ACPA).
Bildediagnostikk kan avdekke tidlige tegn til RA ved ultralyd og/eller MR-undersøkelser.
Diagnosekoder ICD-10: M05.8 (annen seropositiv); M06.0 (seronegativ)
Prosedyrekoder: Leddpunksjon/artrocentese (klikk for å spesifisere ledd:) TN_10. UL veiledet leddpunksjon: NXA10K. Mikroskopi av leddvæske: NXFT05. EKG FPFE15
ATC koder: Behandling med immunsuppressive legemidler: etanercept: L04AB01, adalimumab: L04AB04, triamcinolon (Lederspan): H02AB08, betametason (Celeston Chronodose): H02AB04, rituksimab: L01XC02, abatacept: L04AA24, tocilizumab: L04AC07, infliksimab: L04AB02. tofacitinib: L04AA29
Definisjon
Revmatoid artritt (RA) er en av de vanligste kroniske inflammatoriske artrittsykdommene som affiserer voksne. Sykdommen kjennetegnes av inflammasjon i synovialhinnen (synovitt) som er slimhinnen som kler innsiden av leddkapslene. Denne inflammasjonen manifesterer seg med smerte, stivhet og hevelse i de affiserte leddene. Ubehandlet kan den føre til gradvis ødeleggelse av leddbrusk og underliggende benvev, noe som resulterer i funksjonstap og deformiteter. Typisk angripes små og store ledd symmetrisk i både armer og ben, inkludert små ledd i fingre og tær (Smolen JS, 2016).
Diagnosen RA stilles av en lege, vanligvis en revmatolog og baseres på en helhetlig vurdering som omfatter kliniske symptomer, klinisk undersøkelse, supplerende blodprøver og bildediagnostikk (Schett G, 2012).
RA er en systemsykdom, noe som ofte medfører tretthet, tendens til feber og vekttap. I blodprøver påvises ofte forhøyede inflammasjonsparametere (SR, CRP). Biomarkørene anti-CCP (ACPA) og revmafaktor (RF) styrker mistanken om (seropositiv) RA, men den trenger ikke være til stede (seronegativ RA). Sykdommen kan også påvirke andre organer som hud, lunger, hjerte og blodårer (Hyldgaard C, 2017).
Behandlingen består vanligvis av en kombinasjon av medikamenter, inkludert sykdomsmodifiserende antirevmatiske legemidler (csDMARDs, bDMARDs, tsDMARDs), samt ikke-medikamentelle tiltak som fysioterapi og ergoterapi.
Nye legemidler har siden 1980-tallet forbedret prognosen for RA betydelig. I noen tilfeller kan medikamentene stanse sykdomsutviklingen helt. Optimalt behandlingsresultat krever innsikt i sykdommen og riktig håndtering fra både pasient og behandlere (Uhlig T, 2014; Smolen JS, 2016; Provan SA, 2020).
Historikk
Artrittsykdom er beskrevet i Ebers papyrus fra ca. 1500 f.Kr og i egyptiske mumier. Hippokrates beskrev artritt 400 år f.Kr, men uten å skille mellom ulike artritt-typer. Begrepet revmatisme ble innført av Galen (129 – 216 e. Kr.). Før år 1000 e. Kr. har vi imidlertid ingen rapporter som med sikkerhet beskriver den spesifikke RA-sykdommen.
Den antatt første RA-beskrivelsen kom i 1063, da Psellus beskrev en kronisk, invalidiserende RA-lignende sykdom hos Konstantin IX (980-1055). Den kjente flamske maleren Peter Paul Ruben (1577-1640) beskrev sine egne artritt-symptomer i 27 brev fra årene 1622-1640. På maleriet “The Holy Family with St. Anne” (se bildet nedenfor) ser det dessuten ut til at St. Anne har fingerleddsartritt med feilstillinger. Beskrivelsen av artritt i Rubens bilde er ofte referert til som RA, men ikke alle regner diagnosen som sikker (Scott DL, 2020). Augustin Jacob Landre Beauvais (1772-1840) beskrev RA i sin doktoravhandling 3. august 1800 “Goutte Asthenique Primitive” hos en kvinnelig pasient (Marguerite Garnier). Sir Alfred Baring Garrod (1819-1907) skilte sykdommen fra artrose og fra urinsyregikt i 1858. RA ble godkjent som spesifikk diagnose i England fra 1922 (Entezami P, 2011).
RA ser dermed ut til å ha dukket opp på den vestlige verdens historiske scene i middelalderen (ca. år 500-1500 e.Kr.). En aktuell hypotese er at RA er en infeksiøs lidelse som spredte seg fra pre-colombianske arkaiske indianere i USA (for 6.500 år siden) til Vest-Europa på 1700-tallet. Symmetrisk småledds-artritt som ved RA, har blitt funnet hos disse indianerne, som bodde på vestsiden av Tennessee River, et område uten kontakt med immigranter før midten av 1700-tallet.
Behandling med årelating var vanlig behandling i oldtiden. I fjerne Østen var behandling med akupunktur, kopping, varmebehandling og soneterapi vanligere. Etter at mange behandlingsforsøk mislyktes, begynte man å bruke tungmetaller mot sykdommer, inklusiv RA.
Epidemiologi
RA kan ramme personer i alle aldre, men er vanligere blant kvinner enn menn. Kvinner angripes oftest i alderen 30-40 år, mens menn oftere får RA i 60-80 årsalderen. Selv om genetiske faktorer spiller en rolle, er det relativt få som har nære slektninger med samme diagnose.

Den globale prevalensen av RA er estimert til å være ca. 0,24 %, basert på data fra “The Global Burden of Disease 2010”. Forekomsten er høyest i Vest- og Nord-Europa, Nord-Amerika og andre regioner med befolkning av europeisk avstamning, som Australia og New Zealand. I Mellom- og Sør-Amerika er forekomsten lavere, og den er enda lavere i Øst-Asia og Afrika (Cross M, 2013). I Norge er prevalensen av RA estimert til å være 0,5 % (Kvien TK, 2004). Nyere danske registerdata viser en prevalens på 0,6-0,8 % blant kvinner og 0,3 % blant menn, og at forekomsten har økt med 50 % mellom år 2000 og 2018 (Soussi BG, 2022). Dette tyder på at forekomsten av RA er økende igjen, noe som kan skyldes bedre behandling og økende antall eldre personer i befolkningen (Wang J, 2024).
Insidens og livstidsrisiko. Insidensen av RA er estimert til 25-50 nye tilfeller per 100 000 per år, og er høyest hos kvinner. Sykdommen kan debutere i alle aldre, men gjennomsnittlig debutalder er rundt 50 år for kvinner og noe lavere for menn. Livstidsrisikoen for å utvikle RA er 2,3-3,4 % for kvinner og 1,1-1,5 % for menn (Uhlig T, 2004; Soussi BG, 2022).
Sykdomsårsaker
RA er en kompleks sykdom med en multifaktoriell årsakssammenheng, hvor både genetiske og miljømessige faktorer spiller en rolle.
Alder, kjønn og genetiske faktorer: Både høy alder og forekomst av RA hos nære slektninger (særlig førstegrads slekt: foreldre, søsken eller barn) øker risiko for å utvikle sykdommen. Kvinner er generelt tre ganger mer utsatt enn menn, muligens på grunn av tilstedeværelsen av to X-kromosomer som kan øke risikoen for autoimmune sykdommer. Denne kjønnsforskjellen utjevnes imidlertid i høyere alder. Den genetiske disposisjonen utgjør omtrent 40-50% av risikoen for å utvikle RA. Sykdommen bestemmes imidlertid ikke av ett enkelt gen. Mange av de involverte genene er også assosiert med andre autoimmune sykdommer (Scherer HU, 2020). Studier har vist at det å ha en førstegradsslektning (foreldre, søsken, barn) med RA tredobler risikoen, mens en andregradsslektning dobler risikoen (Frisell T, 2013). Omtrent 10 % av førstegradsslektninger til personer med RA har også sykdommen.
Arveligheten kommer også tydelig frem i tvillingstudier. Kordansen (sannsynligheten for at begge tvillinger utvikler sykdommen) hos monozygote tvillinger er 15-30%, mens den er 5% blant søsken og dizygote tvillinger. Denne sammenhengen er sterkest (40-65%) hos personer med antistoffer mot sykliske citrullinerte peptider antistoff (anti-CCP / ACPA), mens den er ca. 20% ved seronegativ sykdom.
Genome-wide association studier (GWAS) har identifisert flere genetiske risikofaktorer for RA, inkludert HLA-DRB1-alleler (HLA-DRB1*04, HLA-DRB1*01 og HLA-DRB1*10) som inneholder en felles sekvens av fem aminosyrer (“shared epitope”) (Chauhan K, 2021). Andre gener som STAT4 og CD40 er også assosiert med økt risiko for RA og andre autoimmune sykdommer (Orozco G, 2014).
Epigenetiske faktorer som regulerer genekspresjonen uten å endre DNA-sekvensen, kan være en viktig kobling mellom genetisk disposisjon og miljøfaktorer som bidrar til sykdomsutvikling (Klein J, 2015).
Miljøfaktorer. Røking er en betydelig risikofaktor for RA, spesielt for anti-CCP-positive tilfeller. Røyking øker risikoen for RA med 1,4-2,2 ganger ved et forbruk på over 40 pakkeår (Costenbader KH, 2006). Mekanismene bak denne sammenhengen er ikke fullstendig klarlagt, men økt periodontal sykdom og lungesykdom kan være medvirkende faktorer (Deane KD, 2017). Både røking og peridontitis øker citrullinering av proteiner, en prosess som er viktig for autoantistoff-produksjon (a-CCP/ACPA) og sykdomsutvikling (Klareskog L, 2009; Hensvold AH, 2015).
Hormoner og svangerskap. Kvinner som har født har lavere risiko for å utvikle RA enn kvinner som ikke har født (RR 0,61) (Guthrie KA, 2010; Karlson EW, 2004). Bruk av p-piller er ikke assosiert med økt risiko for RA (Karlson EW, 2008). Siden beskrivelsen til Hench i 1938 har det vært kjent at mange med RA blir bedre i svangerskap (Hench P. 1938). Dette kan skyldes økt immunologisk toleranse under graviditet (Kaaja RJ, JAMA. 2005). Svangerskapsforløp ved RA er nærmere beskrevet nedenfor.
Mikrobiota (tarmflora). Mikrobiota. Tarmfloraen, også kalt mikrobiota, spiller en viktig rolle i menneskets helse og sykdom. Endringer i sammensetningen av bakterier i tarmen (dysbiose) har blitt knyttet til flere sykdommer, inkludert RA (Jetwa H, 2017).
Studier har vist at pasienter med RA har en mindre mangfoldig tarmflora enn friske personer. Dette betyr at det er færre ulike typer bakterier i tarmen hos RA-pasienter. I tillegg har man funnet en økt forekomst av visse bakterier, som Actinobacteria, Collinsella, Eggerthella og Faecalibacterium, hos personer med RA. Spesielt bakterien Collinsella har fått oppmerksomhet, da den kan påvirke tarmens permeabilitet (gjennomtrengelighet) og har blitt assosiert med økt sykdomsaktivitet og alvorlighetsgrad av RA. Forskning pågår for å undersøke om manipulering av tarmfloraen, for eksempel gjennom bruk av probiotika eller fekal transplantasjon, kan være en potensiell behandlingsstrategi for RA (Chauhan K, 2023).
Patogenese
Immunresponsen ved RA starter ikke primært leddene, men i perifere vev som lunger, munnslimhinne og mage-tarmkanalen (Klareskog L, 2020). Her produseres modifiserte proteiner, som for eksempel citrullinert protein som utløser en immunrespons og produksjon av antistoffer mot citrullinert protein antistoff (a-CCP/ACPA).
Miljø og CCP / ACPA. Miljøfaktorer, som for eksempel sigarettrøyking, kan over tid aktivere det medfødte (inate) immunsystemet og bidra til sykdomsutvikling. Bakgrunnen kan være at sigarettrøyk kan indusere uttrykk av enzymet peptidylarginin deiminase (PAD) i alveolære makrofager i lungene (Makrygiannakis D, 2008). PAD omdanner aminosyren arginin til citrullin, noe som fører til dannelse av såkalte “neoantigener”. Disse neoantigenene kan utløse en immunrespons og produksjon av Anti-CCP / ACPA (Derksen VFAM, 2017). Anti-CCP / ACPA er antistoff av IgG, IgM eller IgA isotyper som retter seg mot citrullinert protein. De kan binde citrullinerte rester av kroppens egne proteiner, som vimentin, fibronektin, fibrinogen, histoner og type II kollagen. Denne bindingen aktiverer komplementsystemet, en del av immunforsvaret, og forsterker betennelsesreaksjonen. Vennligst les mer om anti-CCP under laboratorieprøver ved artritt i eget kapittel.
Inflammasjon er en naturlig reaksjon på vevsskade og har som hovedoppgave å begrense skaden og reparere vevet. Akutt betennelse er vanligvis hensiktsmessig og avtar etter kort tid, ofte med etterfølgende arrdannelse. Kronisk inflammasjon, derimot, er ofte uhensiktsmessig og vedvarer over lengre tid. Den kjennetegnes av betydelig celleaktivitet, vevsvæske (ødem), og pågående vevsødeleggelse og reparasjon. Å dempe en inflammasjon er oftest kun symptomatisk terapi.
Leddskade. RA er karakterisert ved en kronisk inflammasjon i synovialhinnen (synovium). Denne betennelsen utløses av en autoimmun reaksjon, der kroppens eget immunsystem angriper leddvevet. Tidlig i sykdomsprosessen infiltreres synovialhinnen av immunceller fra både det medfødte og det adaptive immunforsvaret. Dette inkluderer monocytter, dendrittiske celler, mastceller, T-hjelperceller (Th1 og Th17), B-celler og plasmaceller. Disse cellene produserer cytokiner og kjemokiner, som tumornekrosefaktor (TNF) og interleukin-6 (IL-6), som aktiverer endotelceller og tiltrekker flere immunceller til synovialhinnen. Dette fører til en gradvis fortykkelse og hevelse av leddhinnen, samt dannelse av utvekster (villi) som vokser inn i leddhulen.
Det invaderende og prolifererende vevet i leddhinnen kalles pannus. Fibroblaster i pannus endres til en mer aggressiv form og stimulerer osteoklaster (celler som bryter ned beinvev) til å erodere og ødelegge leddbrusk og bein. Denne prosessen fører til de karakteristiske leddskadene (erosjoner eller usurer) som er typiske for RA (Lopez-Meijias R, 2019). Inflammasjonen fører dermed til erodering og destruksjon av periartikulært ben og brusk (Scott DL, Lancet. 2010).
Symptomer
Symptomene på RA varierer betydelig mellom individer. De kan oppstå akutt, men utvikler seg oftere gradvis over uker og måneder. Leddsmerter og stivhet, spesielt om morgenen og etter hvile, er typiske debutsymptomer. Disse kan forutgå klinisk påvisbar artritt med flere uker. Fordelingen av affiserte ledd, som ofte involverer metakarpofalangealleddene (MCP) og proksimale interfalangealledd (PIP) i fingrene på begge hender og metatarsofalangealleddene (MTP) i føttene, kan være en indikasjon på RA. Sannsynligheten for RA øker med antall affiserte ledd (Wassermann AM, 2011).
Debut-symptomer.
Allerede før sykdommen bryter ut, kan pasienter oppleve uspesifikke, prodromale symptomer som generell sykdomsfølelse og leddsmerter i opptil seks måneder.
I startfasen (tidlig RA) er de typiske symptomene:
- Morgenstivhet: Stivhet, spesielt om morgenen og etter hvile, som varer i minst én time før symptomene er på sitt mildeste.
- Leddsmerte og artritt. De oftest affiserte leddene i tidlig fase er MCP-, PIP- og håndledd i hender, MTP og ankler i føttene presentert med hevelser. Angrepet er ofte symmetrisk, det vil si at de samme leddene rammes på begge sider av kroppen. Typisk non-erosiv i tidlig fase.
- Tenosynovitt. Synoviale hevelser over sener og seneskjeder kan forekomme, potensielt med reduserte bevegelsesutslag, for eksempel i form av stenoserende tendovaginitt/”trigger fingre”. Dette kan føre til hevelse, smerte, friksjonsfenomener og redusert bevegelse.
- Generell sykdomsfølelse og utmattet (fatigue)
- Noen får nattesvette, lavgradig feber og vekttap etter hvert.
I enkelte tilfeller kan RA debutere med palindrom revmatisme. Dette er en type artritt som kjennetegnes av anfallsvis episoder med smerte og hevelse i leddene, ofte i håndledd og fingre. Anfallene varer vanligvis noen dager eller uker før de forsvinner helt. Personer med palindrom revmatisme har økt risiko for å utvikle RA senere i livet, og anti-CCP-antistoffer kan påvises i blodet flere år før den fullstendige sykdomsutviklingen (Smolen JS, 2016).
Etablert RA
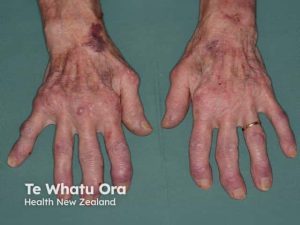
Ved etablert RA vil typiske revmatiske manifestasjoner over tid inkludere kronisk smerte, symmetrisk hevelse og redusert bevegelighet i MCP (meta-carpo-falangeal), PIP (proksimale inter-falangial-ledd) og MTP (meta-tarso-falangial), håndledd, ankler og albuer. Også kjeve- og nakkeledd kan affiseres. Hofter er oftest spart for primær affeksjon, og i columna affiseres primært nakkevirvlene.
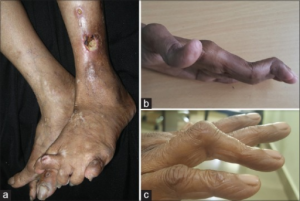
Hvis sykdommen progredierer ukontrollert, kan den medføre svekket seneapparat og ustabile ledd som fører til feilstillinger, deformiteter og muskelatrofi. Revmaknuter (noduli) ses hos ca. 20% av pasientene (Chauhan K, 2023). Hos mange kan de kroniske symptomene føre til sekundære komplikasjoner, som for eksempel depresjon (Matchham F, 2013).
De vanligste feilstillingene ved RA
- Svanehalsdeformitet: Karakteriseres av hyperekstensjon i PIP og fleksjon i DIP
- Knapphullsdeformitet (“Boutonniere”): Defineres av hyperekstensjon i MCP, fleksjon i PIP og ekstensjon i DIP-leddet.
- Ulnar deviasjon i grunneledd (MCP): Fingrene avviker mot lillefingersiden.
- Volar subluksasjon i MCP: Leddhodet glir ut av leddskålen på håndflatens side.
- Z-konfigurasjon (“skomakertommel”, “90-90 deformitet”): Innebærer fleksjon i tommelens MCP-ledd i tommelen kombinert med ekstensjon i tommelens DIP-ledd.
-
Illustrasjon for Kompendiet: Kari Toverud Radial deviasjon i håndledd: Håndleddet bøyes mot tommelsiden.
Jaccouds artritt er en type deformitet som primært affiserer hender og føtter med karakteristiske subluksasjoner og feilstillinger (f.eks. ulnar deviasjon i fingrene). Denne skyldes ikke primært erosjon av ben.
Andre manifestasjoner fra bevegelsesapparatet
- Prominerende capitulum ulnae: Fremstående spiss av spolebeinet ved håndleddet.
- Tendovaginitt/tendinopati; Senebetennelse eller seneskade.
- Revmatiske knuter/noduli: Subkutane knuter oppstår hos ca. 20% av pasientene: De er ofte lokalisert over trykkpunkter. Knuter over DIP-ledd kan også være Heberdens knuter ved artrose og må differensiaeres.
- Bakers cyste / Popliteal cyste: Benevnt etter William M. Baker (1839-1896), observeres hos ca. 50 % av pasientene. Dette er en væskefylt cyste i knehasen, forårsaket av væskeansamling fra kneleddet. Den er ofte asymptomatisk, men kan rupturere. Ruptur fører til at væske tømmer seg i leggen, noe som utløser en kraftig inflammatorisk reaksjon med varme, hevelse og erytem. Hevelsen kan forveksles med dyp venetrombose (DVT). Imidlertid koeksisterer Bakers cyste og dyp venetrombose hos opptil 25 %. Cysten påvises klinisk som en fluktuerende oppfylling i knehasen og bekreftes ved ultralyd. Behandlingen rettes mot eventuell kneledds-synovitt eller annen primær årsak, for eksempel ved artrocentese og injeksjon i kneleddet (Nakamura J, 2019).
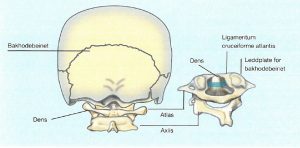
- Atlantoaksial nakkeaffeksjon. Artritt i leddet mellom første (atlas, C1) og annen nakkevirvel (aksis, C2) ses hos over 20% av pasientene allerede innen det første året etter RA-diagnosen. Risikofaktorer for atlantoaksial skade inkluderer høy sykdomsaktivitet, tilstedeværelse av anti-CCP-antistoffer og generell erosiv sykdomsutvikling (Carotti M, 2019). Initialt er ca. 50% av disse pasientene asymptomatiske.
![]() Hvis nakkeaffeksjonen progredierer, kan cervical myelopati oppstå, noe som er påvist hos 2,5% med RA etter et gjennomsnittlig sykdomsforløp på ca. 14 år. Anterior atlantoaksial subluksasjon er den vanligste formen (ca. 75%), mens subluksasjon mellom den bakre buen av C1 og dens aksis sees hos 7-20% (Manczak M, 2017). Vertikal subluksasjon er sjeldnere. Også virvler kaudalt for C1/C2 kan disloseres (subaksiale glidninger).
Hvis nakkeaffeksjonen progredierer, kan cervical myelopati oppstå, noe som er påvist hos 2,5% med RA etter et gjennomsnittlig sykdomsforløp på ca. 14 år. Anterior atlantoaksial subluksasjon er den vanligste formen (ca. 75%), mens subluksasjon mellom den bakre buen av C1 og dens aksis sees hos 7-20% (Manczak M, 2017). Vertikal subluksasjon er sjeldnere. Også virvler kaudalt for C1/C2 kan disloseres (subaksiale glidninger).
Typiske symptomer på cervikal manifestasjon er nakkesmerte med nevrogen utstråling til bakhodet. Andre symptomer er nummenhet i armene relatert til nakkebevegelse. I alvorlige tilfeller kan artritt med instabilitet medføre pareser og i ytterste konsekvens død. Vurdering av mulig atlantoaksial subluksasjon er obligatorisk før generell anestesi, fordi total muskelrelaksering medfører økt risiko for myelopati ved eksisterende instabilitet.
- Utover disse bevegelsesapparatmanifestasjonene kan RA også gi en rekke ekstraartikulære manifestasjoner som er omtalt i et eget avsnitt nedenfor.
Ekstra-artikulære manifestasjoner ved RA
Ekstraartikulære manifestasjoner er symptomer og tegn på RA som oppstår utenfor leddene. Disse manifestasjonene er et resultat av den systemiske inflammatoriske prosessen, hvor cytokiner i blodet spiller en sentral rolle i patogenesen. Deres tilstedeværelse er assosiert med økt sykelighet og dødelighet (Giles J, 2019).
Omtrent 40 % av RA-pasienter opplever ekstraartikulære manifestasjoner i sykdomsforløpet. Disse kan oppstå når som helst, fra tidlig i sykdomsforløpet til sent i forløpet, og indikerer ofte et behov for mer intensiv behandling (Turesson C, 2003).
Selv om revmatiske knuter (noduli) tradisjonelt har vært ansett som den vanligste ekstraartikulære manifestasjonen, er lungemanifestasjoner generelt mer alvorlige og prognostisk viktigere.
En bør være oppmerksom på at standardiserte måleinstrumenter, slik som spørreskjemaer brukt i rutinemessig revmatologisk praksis, ikke alltid fanger opp alle disse ekstraartikulære komplikasjonene. Dette understreker behovet for en grundig klinisk evaluering og systematisk screening for å identifisere og behandle disse manifestasjonene effektivt.
Hematologiske manifestasjoner
Anemi er den vanligste hematologiske manifestasjonen ved RA. Den kan skyldes gastrointestinal blødning på grunn av NSAID-bruk, eller hepcidin-mediert hemming av jerntransport på grunn av betennelse (Chen Y, 2021).
Andre hematologiske forandringer som kan sees ved RA inkluderer nøytropeni, eosinofili, trombocytopeni og trombocytose.
Feltys syndrom, en kombinasjon av leukopeni (lavt antall hvite blodceller) og splenomegali (forstørret milt), er en sjelden, men alvorlig komplikasjon ved RA. Litteratur: Cojocaru M, 2010; Turesson C, 2013.
Hjertemanifestasjoner
RA er assosiert med økt risiko for hjerte- og karsykdom. Dette er en viktig årsak til sykelighet og dødelighet hos RA-pasienter (Roman MJ, 2007), selv om prognosen er blitt bedre med moderne behandling (Provan SA, 2020). De kardiovaskulære manifestasjonene kan inkludere:
- Aterosklerose: Akselerert utvikling av aterosklerose er en sentral faktor. Den kroniske inflammasjonen ved RA bidrar direkte til endotelial dysfunksjon og plakkdannelse i arteriene. Risikoen for aterosklerose øker proporsjonalt med graden av sykdomsaktivitet i RA (Myasedova E, 2016).
- Arteriell stivhet: Økt stivhet i arterieveggene, som er en indikator på subklinisk aterosklerose og en uavhengig risikofaktor for kardiovaskulære hendelser.
- Koronararterie-arteritt: Inflammasjon i selve koronararteriene, selv om dette er sjeldnere enn aterosklerose.
- Hjertesvikt: Pasienter med RA har økt risiko for både systolisk og diastolisk hjertesvikt, uavhengig av iskemisk hjertesykdom. Dette kan skyldes en kombinasjon av kronisk inflammasjon, myokardfibrose og medikamentbivirkninger
- Sykdom i hjerteklaffer: Inflammatoriske prosesser kan føre til fortykkelse og dysfunksjon av hjerteklaffene.
- Perikarditt er den vanligste primære hjertemanifestasjonen ved RA (Roman MJ, 2007). Perikarditt kan gi brystsmerter, som ofte forverres når pasienten ligger på ryggen eller ved dyp inspirasjon. Den kan være asymptomatisk, men i alvorlige tilfeller kan perikardvæskeansamling føre til perikardtamponade, en livstruende tilstand som krever akutt drenering.
- Risiko for hjerteinfarkt. Pasienter med RA har generelt en 1,5-2,0 ganger økt risiko for hjerteinfarkt sammenlignet med den generelle befolkningen. Denne risikoen er sammenlignbar med den risikoen som ses ved diabetes mellitus, og understreker viktigheten av aggressiv risikofaktormodifisering. Imidlertid er denne risikoen observert å være redusert de siste årene, noe som trolig skyldes en kombinasjon av bedre sykdomskontroll av RA med effektive legemidler og et økt fokus på forebygging og behandling av tradisjonelle kardiovaskulære risikofaktorer (Schieir O, 2017; Alsing CL, 2023). Risikoen er imidlertid også assosiert med bruk av kortikosteroider når dosen tilsvarer prednisolon > 5mg/d over tid (So H, 2023). Dette understreker behovet for å titrere kortikosteroid-dosen ned til lavest mulig effektive nivå.
Ved mistanke om iskemisk koronar hjertesykdom hos en pasient med RA, bør symptomene vurderes i sammenheng med andre risikofaktorer som røking, diabetes, hypertoni og høyt kolesterol (Semb AG, 2020). En helhetlig risikovurdering og aggressiv behandling av disse risikofaktorene er avgjørende for å redusere den kardiovaskulære byrden hos RA-pasienter. Hos pasienter med høy risiko for hjerte-karsykdommer anbefales forsiktighet med JAK-hemmere (tsDMARDs). Dette skyldes at enkelte studier har tydet på at disse legemidlene kan øke risikoen for alvorlige kardiovaskulære komplikasjoner mer enn f. eks TNF-hemmere (Aymon R, 2024), selv om dette er et område under kontinuerlig forskning og diskusjon. Klinisk beslutningstaking bør alltid baseres på en individuell nytte-risiko-vurdering.
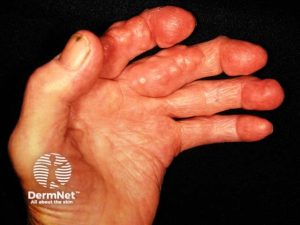
Hudmanifestasjoner
RA som en systemisk sykdom kan gi en rekke hudmanifestasjoner. Disse kan variere i alvorlighetsgrad og gi viktige diagnostiske og prognostiske holdepunkter.
Revmatoide knuter (noduli) er den vanligste hudmanifestasjonen ved RA med forekomst hos ca. 20% av pasientene. Eldre studier indikerte en høyere forekomst, men med nyere og mer effektive medikamenter i moderne medikamentell RA-behandling er forekomsten av revmaknuter trolig lavere nå enn tidligere.
Revmaknuter ses ofte på ekstensorsiden av albuer og fingre (trykkutsatte områder) hos pasienter med seropositiv RA. Revmaknuter er sterkest assosiert med seropositiv RA, det vil si tilstedeværelse av revmatoid faktor (RF) og/eller anti-CCP-antistoffer.
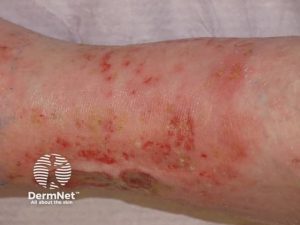
Andre hudsymptomer:
- Periungual inflammasjon: Betennelse i vevet rundt neglene kan observeres, ofte som erytem og hevelse.
- Ulcerasjoner og digitalt gangren ved iskemi. I mer alvorlige tilfeller av RA kan sirkulasjonsforstyrrelser føre til ulcerasjoner og i verste fall digitalt gangren grunnet iskemi (Cojocaru M, 2010).
- Revmatoid vaskulitt i huden kan forekomme ved langvarig og alvorlig sykdomsforløp, oftest hos pasienter med RF/anti-CCP-antistoffer (seropositiv RA).
- Vaskulitt i små kar kan gi hudblødninger, slik som petekkier (små) og purpura (større områder).
- Vaskulitt i større kar kan føre til mer omfattende og alvorlige vevsnekroser som krever umiddelbar medisinsk intervensjon (vennligst se også eget kapittel om iskemi).
Lungesykdom/revmatoide lungemanifestasjoner
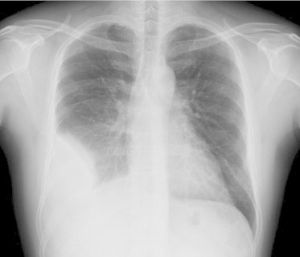
Lungemanifestasjoner ved Revmatoid Artritt (RA), ofte referert til som Revmatoid Lungesykdom, er en betydelig årsak til sykelighet og dødelighet hos pasienter. Sykdomsutviklingen kan være akutt eller gradvis over flere år.
Vanlige lungemanifestasjoner
- Pleuritt og pleuravæske: Inflammasjon i pleura med pleuravæske er relativt vanlig. Den er ofte ensidig og forårsaker smerter ved respirasjon. Pleuritt kan være det første symptomet på RA eller debutere samtidig med leddbetennelse (Yokosuka T, 2013).
- Interstitiell lungesykdom (ILD) er en alvorlig komplikasjon som kan debutere før RA-diagnosen (Hyldgaard C, 2017), men som oftest ses senere i forløpet. ILD ved RA er assosiert med flere risikofaktorer:
- Genetisk disposisjon (spesielt MUC5B-promotervarianten)
- Høy alder
- Mannlig kjønn
- Tobakksrøking
- Seropositivitet (tilstedeværelse av revmatoid faktor (RF) og/eller anti-cyklisk citrullinert peptid (aCCP) antistoffer) (Junge PA, 2018).
ILD er ofte asymptomatisk i tidlig fase, men symptomer som dyspné ved belastning og tørrhoste kan utvikles hos 7,7% ved RA (life-time risk) sammenlignet med 0,9% hos non-RA kontroller. Lungesykdommen begynner etter RA-debut hos over 80%, og eldre pasienter, menn og de med alvorlig RA er spesielt utsatt (Bongartz T, 2010; Kelly CA, 2014).
3. Revmaknuter (noduli) i lungene: Disse kan forekomme ved langvarig, aCCP-positiv RA, ofte samtidig med subkutane revmaknuter. I lungene er de typisk lokalisert i interlobære septa og subpleurale områder, og varierer i størrelse fra få millimeter til flere centimeter. Histologisk kjennetegnes de av sentral fibrinoid nekrose og palisade-dannende mononukleære celler. I sjeldne tilfeller kan knutene rupturere, føre til pleuravæske, bronkopleural fistel og infeksjon. Differensialdiagnostisk må sarkoidose, granulomatose med polyarteritt (GPA), bronkialcancer, pulmonalt lymfom, histiocytose og metastaser. vurderes.
4. Caplans syndrom: Et sjeldent syndrom som består av RA og pneumokoniose (lungesykdom forårsaket av innånding av støv, f.eks. kullstøv), ofte med lungenoduli på 0,5 cm eller større. Syndromet ble beskrevet blant kullgruvearbeidere i 1953 av den britiske legen Antony Caplan (Schreiber J. 2010).
5. Andre Lungesykdommer:
- Astmatisk tilstand med bronkial hyperreaktivitet.
- Bronkiolitt, inkludert follikulær bronkiolitt (HRCT viser sentrolobulære peribronkiale mikronoduli uten “honeycombing”, ofte relatert til kronisk infeksjon).
- Obliterativ bronkiolitt: En alvorlig tilstand med akutt start og raskt progredierende dyspné, oftest hos kvinner med aCCP-antistoffer og langvarig sykdom. Sulfasalazin kan være en utløsende faktor. HRCT viser sentrolobulært emfysem, bronkiektasier, bronkial veggfortykkelse og et mosaikk-mønster. Lungefunksjonstester viser obstruksjon med normal DLCO (diffusjonskapasitet for karbonmonoksid).
Diagnostikk av Revmatoid Lungesykdom
- Anamnese: Grundig kartlegging av symptomer som belastningsdyspné, tørrhoste og ubehag i brystet.
- Klinisk undersøkelse: Inkluderer auskultasjon av lungene, hvor krepitasjoner kan høres.
- Bildediagnostikk: Høyoppløselig CT (HRCT) av lungene er den foretrukne metoden for å påvise og kartlegge lungesykdom ved RA, da kun 5 % av tilfellene oppdages ved vanlig røntgen thoraks Ascherman DP, 2010). HRCT av lunger innebærer lav radiologisk stråling og bør benyttes for å kartlegge lunge-manifestasjoner hos pasienter med risikofaktorer (f.eks. aCCP-positivitet) og ved symptomer (Hyldgaard C, 2023). Vanlige mønstre på HRCT inkluderer (Kelly C, 2016):
- Usal interstital pneumonia (UIP): Vanligere og har generelt dårligere prognose.
- Nonspecific interstitial pneumonia (NSIP): Generelt bedre prognose enn UIP (Yunt ZX, 2017).
- Organized/organiserende pneumonia (OP): Sjeldnere.
| RA-ILD med fordeling av radiologiske kjennetegn (Kelly CA, 2014) | ||
| Subtype | % | Mønster |
| Usual interstitiell pneumoni (UIP) | 66% | Fibrose og bikake-mønster (honeycombing) |
| Non-spesifikk interstitiell pneumoni (NSIP) | 24% | Mattglass som tegn på variabel alveolitt |
| Kryptogen organiserende pneumoni (COP) | 4% | Multifokale perifere fortetninger |
| Overlapp syndromer | 6% | Blandet |
- Lungefunksjonstester: Flere målinger over tid er viktig for å vurdere progresjon.
- 6-minutters gangtest: For å vurdere funksjonell kapasitet.
- Lungelegevurdering: Spesialistvurdering er ofte nødvendig.
Ubehandlet er det risiko for at inflammatoriske, interstitielle lungemanifestasjoner progredierer og danner irreversibel fibrose med lungesvikt på sikt (Atzeni F, 2014).
Medikamentrelatert lungesykdom.
Det er viktig å skille revmatoid lungesykdom (se ovenfor) fra sjeldne medikamentutløste lungebivirkninger, men differensialdiagnostikken kan være utfordrende. Medikamentutløst lungesykdom ved RA er sjelden, noe som krever grundig vurdering av differensialdiagnoser.
- Blant DMARDs er hypersensitivitets-pneumonitt utløst av metotreksat og leflunomid (Arava) mest kjent, selv om prospektive studier har vist lav forekomst (Fragoulis GE, 2019). Typiske symptomer debuterer gjerne i løpet av det første behandlingsåret og omfatter dyspne, tørrhoste og pleurasmerter. Lungefunksjonstester viser nedsatt lungekapasitet og CT-undersøkelser viser ofte interstitiell lungesykdom med mattglass-fortetninger (NSIP) i begge lunger. Lungefibrose er ikke typisk og er neppe direkte relatert til metotreksat (Dawson JK, 2021).
- TNF--hemmere og leflunomid (Arava) kan i sjeldne tilfeller også utløse eller forverre lungesykdom. Spesielt utsatt er pasienter med preeksisterende lungesykdom, røkere, alder over 60 år og hypoalbuminemi. Per 2023 mangler kontrollerte studiedata, men forsiktighet med disse medikamentene ved kjent RA-ILD bør utvises i tråd med anbefalinger fra British Society for Rheumatology (Holroyd CR, 2019).
-Symptomer på metotreksat-pneumonitt
- Oftest innen første året fra behandlingsstart
- Lav feber hos 90%
- Ny hoste (akutt/subakutt)
- Dyspne
- Lungeforandringene går tilbake etter seponering av medikasjonen hos omtrent 50%.
Behandling og Monitorering
Behandlingen av RA med lungesykdom krever en individualisert tilnærming. Generelt kan den inkludere:
- Immunsuppressiva: Mykofenolat, azatioprin, rituksimab (Mena-Vazqueres N, 2022) eller cyklofosfamid (i alvorlige tilfeller) i kombinasjon med kortikosteroider.
- Biologiske legemidler: Tocilizumab er et alternativ (Johnson SR, 2024). Data fra studier av abatacept eller JAK-inhibitorer kan tyde på at stabilisering av lungemanifestasjonen er mulig (Tardella M, 2022).
- Metotreksat: Kan også benyttes (Kiely P, 2019). Til tross for bekymringer om lungebivirkninger (som kan være vanskelig å skille fra primære lungemanifestasjoner), har en vist at behandling med metotreksat kan bedre prognosen/overlevelsen ved lungemanifestasjoner ved RA (Rojas-Serrano J, 2017). Bruk av metotreksat bør derfor vurderes nøye og indikasjonen (der nytten overstiger risikoen) bør dokumenteres spesielt.
- Antifibrotisk terapi: Medikamenter som nintedanib (Ofev) kan redusere progresjonen av lungefibrose ved RA-ILD, men stanser ikke utviklingen fullstendig på lik linje med lungefibrose generelt (Matteson EL, 2022).
Monitorering: Kontroller må tilpasses det individuelle forløpet. Ved mistanke om progresjon utføres hyppigere klinisk vurdering (f.eks. hver 3. måned) og lungefunksjonstester minst én gang årlig. HRCT vurderes basert på klinisk bilde og eventuell forverring av lungefunksjon.
Muskler
- Myalgi: Muskelsmerter er vanlig ved RA.
- Muskelatrofi: Redusert muskelmasse, ofte relatert til inaktivitet, kronisk inflammasjon og medisinbruk (f.eks. kortikosteroider).
- Myositt: Sjelden, men ekte muskelbetennelse kan forekomme ved RA, selv om den er mer typisk for andre autoimmune sykdommer som polymyositt.
Nervesystemet
RA er primært en leddsykdom, men den kan også påvirke nervesystemet, spesielt det perifere nervesystemet.
En andel av RA-pasientene utvikler perifer nevropati med skade på nerver i armer og ben. Dette kan manifestere seg med symptomer som nummenhet, prikking, smerter og muskelsvakhet i de affiserte områdene.
-KarpaItunnelsyndrom. Den hyppigste formen for nevropati ved RA er karpaltunnelsyndrom. Dette oppstår når nervus medianus, som går gjennom karpaltunnelen i håndleddet, blir komprimert. Kompresjonen kan føre til smerter, nummenhet og prikking i tommel, pekefinger, langfinger og en del av ringfingeren.
-Andre nerver som kan rammes av kompresjon inkluderer:
- Nervus medianus kan også komprimeres proksimalt på underarmen, i området rundt muskelen pronator teres (pronator teres syndrom).
- Nervus tibialis kan klemmes av dorsalt for mediale malleol (ankelen), noe som forårsaker smerter i tær, hæl og fotsåle (tarsal tunnel syndrom).
- Nervus ulnaris kan komprimeres, oftest i albueområdet ved sulcus nervus ulnaris (cubitaltunnelsyndrom), noe som gir smerter og nummenhet i lillefingeren og halve ringfingeren, samt svakhet i hånden.
I tillegg bør en skille nevrogene smerter og nevrologiske utfall forårsaket av perifer nevropati fra de som skyldes cervikal myelopati assosiert med RA-affeksjon i nakkevirvlene (se eget avsnitt om dette) (Nadkar MY, 2001).
Sentralnervesystemet (CNS)
Generelt er sentralnervesystemet (hjerne og ryggmarg) vanligvis ikke direkte påvirket av RA. Imidlertid er det rapportert sjeldne tilfeller av alvorlige CNS-manifestasjoner, inkludert:
- CNS-vaskulitt: Inflammasjon i blodårene i hjernen eller ryggmargen.
- RA-noduli i hjernen: Dannelse av revmatiske knuter i hjernevevet.
- Meningitt: Betennelse i hjernehinnene.
- Demyeliniserende sykdom: Tilstander der myelinskjeden rundt nervefibrene skades, som kan være utløst av bruk av TNF--hemmere (Atzeni F, 2018).
RA og Alzheimers sykdom. Interessant nok har epidemiologiske studier vist en redusert forekomst av Alzheimers sykdom hos personer med RA. Årsaken til dette er ukjent, men mulige forklaringer inkluderer potensielle effekter av anti-revmatiske medikamenter som NSAIDS, DMARDs eller TNF-α hemmere (Policcchio S, 2017) eller en sammenheng med nivåer av proinflammatoriske cytokiner og GM-CSF i spinalvæsken. Dersom en sammenheng kan bekreftes, kan det åpne for nye behandlingsmuligheter for Alzheimers sykdom (Taipa R, 2019). (Vennligst se også eget kapittel om cerebral iskemi).
Nyremanifestasjoner
Mens primær nyreaffeksjon direkte forårsaket av revmatoid artritt (RA) er sjelden, kan nyrene likevel påvirkes på flere måter hos pasientene.
Vaskulitt. En sjelden, men alvorlig form for nyreaffeksjon kan oppstå som del av en systemisk vaskulitt assosiert med RA eller i sammenheng med nevropati (Nadkar MY, 2001). I slike tilfeller kan inflammasjonen i blodårene direkte skade nyrevevet.
Medikamentbivirkninger. Den hyppigste årsaken til nyrepåvirkning hos RA-pasienter er imidlertid bivirkning av medikamenter som brukes i behandlingen. Flere legemidler som er effektive mot RA, inkludert ikke-steroide antiinflammatoriske legemidler (NSAIDs), enkelte sykdomsmodifiserende antirevmatiske legemidler (DMARDs) og i sjeldne tilfeller biologiske legemidler, kan påvirke nyrefunksjonen eller forårsake nyreskade. Dette understreker viktigheten av regelmessig monitorering av nyrefunksjonen.
Nyreamyloidose (sekundær AA-amyloidose) er en sjelden, men alvorlig komplikasjon som kan utvikles ved langvarig utilstrekkelig behandlet RA (Shinichi IADA, 2002). Ved sekundær amyloidose avsettes et protein kalt serumamyloid A (SAA) i ulike organer, inkludert nyrene. Dette fører til progressiv skade på nyrenes glomeruli, som igjen kan resultere i proteinuri og i verste fall nyresvikt.
Gitt risikoen for både primær og sekundær nyrepåvirkning, er det viktig med grundig medikamentanamnese, regelmessig blodtrykksmåling og systematiske urinundersøkelser (f.eks. urinstix og/eller albumin/kreatinin-ratio) hos alle RA-pasienter. Dette bidrar til tidlig deteksjon av nyreproblemer, slik at passende tiltak kan iverksettes for å bevare nyrefunksjonen.
Skjelettaffeksjon
- Periartikulær osteopeni/osteoporose: Redusert bentetthet rundt de betente leddene, og systemisk osteoporose som øker risikoen for brudd, ofte forverret av langvarig kortikosteroidbruk.
- Aseptisk bennekrose (osteonekrose): Celledød i beinvev på grunn av manglende blodtilførsel, hyppigst i hofter og skuldre. Dette er en alvorlig komplikasjon som kan skyldes sykdommen selv eller bruk av kortikosteroider.
Øye-manifestasjoner
RA kan påvirke øynene på flere måter, og noen av disse manifestasjonene kan være alvorlige.
- Tørre øyne (keratoconjunctivitis sicca, xeroftalmi) (og munntørrhet, xerostomi) er den vanligste øyemanifestasjonen ved RA og forekommer hos ca. 10 % av pasientene. Dette er ofte en del av sekundært Sjøgrens syndrom. Ubehandlet tørre øyne kan føre til skade på hornhinnen og økt risiko for infeksjoner.
- Skleritt. Dette er en alvorlig øyemanifestasjon som kan forårsake smerter, lysskyhet, rødhet i øyet og i noen tilfeller redusert syn. Kronisk eller ubehandlet skleritt kan føre til tynning av sklera (skleromalacia perforans) og i verste fall perforasjon av øyeeplet med betydelig synstap på sikt. Det krever umiddelbar og ofte systemisk behandling.
- Episkleritt Dette er en mildere betennelse som rammer episkleralaget, det tynne laget mellom bindehinnen og sklera. Symptomer inkluderer rødhet og lett ubehag, men sjelden smerte eller synspåvirkning. Tilstanden er ofte selvbegrensende, men kan kreve lokal behandling med antiinflammatoriske øyedråper.
- Keratitt. Betennelse i hornhinnen (kornea) kan også forekomme. Dette kan gi symptomer som smerte, lysskyhet, tåreflod og redusert syn. Keratitt kan være en direkte konsekvens av tørre øyne, men kan også skyldes vaskulitt eller andre inflammatoriske prosesser relatert til RA (Giles JT, 2019).
Utredning
Ved undersøkelse av pasienter med artritt av mindre enn to ukers varighet, har ca. 10% RA, over 30% udifferensiert artritt, og resten har andre former for artritt, ofte infeksiøs artritt, reaktiv artritt, andre spondyloartritter, krystallartritt eller systemiske bindevevssykdommer (Mil A, 2006). Utredningen av RA omfatter anamnese, klinisk-, laboratorie- og bildediagnostiske undersøkelser. Biopsier er vanligvis unødvendige for diagnosen.
EULAR (European Alliance of Associations for Rheumatology) anbefaler at alle med artritt får revmatologisk vurdering innen seks ukers, og at sykdomsmodifiserende antirevmatiske legemidler (DMARDs) startes innen seks måneder ved RA (Combe B, 2016).
Utredning av RA omfatter anamnese, klinisk undersøkelse, laboratorieprøver og bildediagnostikk;
Anamnese.
Grunnlaget for diagnosen legges ved en grundig vurdering av aktuelle symptomer (se ovenfor), en målrettet anamnese (se eget kapittel om målrettet anamnese) og kartlegging av eventuelle risikofaktorer (arv, miljø, røking).
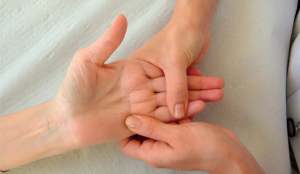
Klinisk undersøkelse
Den kliniske undersøkelsen fokuserer på leddsymptomer, ekstraartikulære manifestasjoner og differensialdiagnoser, samt en generell vurdering av pasientens helsetilstand. Ved sikker RA-diagnose er det nyttig å notere variabler som inngår i standardisert måling av sykdomsaktivitet.
Laboratorieprøver.
En standardisert laboratoriepakke ved utredning av RA kan omfatte: Akuttfase reaksjon: CRP (ev. også senkningsreaksjon, SR). Andre blodprøver: hemoglobin (Hb), hvite blodlegemer/leukocytter, med differensialtelling, trombocytter, ALP, ALAT, albumin, kreatinin, urinsyre (urat), gammaglobulin (IgG), s-elektroforese. Autoantistoffer: anti-CCP, RF, ANA. Infeksjonsserologi: Hepatitt B- og -C antistoff, IGRA-test (for tuberkulose), HIV hvis risikoadferd. Urin-stiks for å undersøke for protein og blod i urinen.
Tolkning av laboratorieprøver:
-Akuttfasereaktanter: Forhøyet CRP og SR skyldes endringer i plasmaproteinene. Akutt fase proteiner produseres av hepatocytter (stimulert av Interleukin-1 og -6) og har funksjoner som koagulasjon, fibrinolyse og fagocytose. CRP, serum amyloid protein A, fibrinogen, haptoglobin, C3 og gammaglobulin øker ved betennelsesreaksjoner, mens albumin og transferrin synker. Forhøyet CRP og SR (særlig kombinasjonen) predikerer erosiv sykdom og er nyttige for å vurdere behandlingsrespons og sykdomsaktivitet. Calprotectin korrelerer også med sykdomsaktiviteten og radiologisk progresjon (Jonsson MK, 2017).
-Celletellinger: Ved høy sykdomsaktivitet kan inflammasjons-anemi forekomme. Sykdomsaktivitet målt med CRP og SR vil samsvare med reduksjonen i Hb. Jernmangel-anemi kan diagnostiseres ved høy transferrin reseptor (> 2,5 mg/L) og lavt serum ferritin (< 50 mikrogram/L). I motsetning til ferritin er transferrin reseptor er uavhengig av inflammasjon. Årsaken til inflammasjons-anemi er delvis hepcidin-indusert påvirkning av jernmetabolismen og redusert produksjon av erythropoietin (EPO). Vennligst les mer om anemi i eget kapittel. Antall leukocytter måles for å utelukke leukopeni, særlig neutropeni ved differensialtellingen. Leukopeni kan forårsakes av Feltys syndrom , LGL-syndrom, medikamenter, benmargssykdom eller perifert i blodet (Gazitt T, 2017). Neutropeni øker risikoen for infeksjon. Leukocytose med neutrofili ses ved kortikosteroid-behandling og iblant ved sykdomsresidiv (økt mobilisering fra depoter i benmarg). Leukocytose med neutropeni kan indikere bakteriell infeksjon. Trombocytose følger ofte sykdomsaktivitet/inflammasjon, men bakenforliggende årsaker er mindre klare. Trombocytopeni ses ved Feltys syndrom og som bivirkning av noen medikamenter (Farr M, 1983).
-Lever-enzymer og hepatittantistoffer: Før behandling med metotreksat og andre medikamenter må tegn til leversykdom, inklusiv hepatitt B og -C utelukkes. Forhøyet ASAT kan også være et symptom på myositt, og supplerende måling av kreatin-kinase (CK) anbefales i slike tilfeller. Andre årsaker til høye leverenzymer er mange, og inkluderer alkohol, medikamenter og levermalignitet. Ved cholestase forventes spesielt høye verdier av alkalisk fosfatase og g-GT (Craig E, 2017).
-Kreatinin og nyrefunksjonsprøver: Kreatinin i blodet er et mål på nyrefunksjonen, og laboratoriet supplerer ofte med estimert glomerulær filtrasjonsrate (eGFR) for å gi et mer fullstendig bilde. Nyrefunksjonen er viktig for utskillelse av medikamenter, inkludert metotreksat. Ved nedsatt nyrefunksjon akkumuleres metotreksat rakt i blodet og kan medføre toksisitet. Ved glomerulonefritt, amyloidose eller annen nyresykdom kan store mengder protein (mest albumin) utskilles gjennom nyrer (urin). Dette fører til lavere albumin-nivået i blodet og kan medføre alvorlige komplikasjoner (Kapoor T, 2018).
-Andre undersøkelser: Urinsyre måles for å utelukke urinsyregikt som differensialdiagnose. CK (kreatin-kinase) måles ofte for å utelukke myositt/artritt-overlapp. Elektroforese og immunglobulin G (IgG) måles for å utelukke mangeltilstander med økt infeksjonsrisiko (eget kapittel om ervervet immunsvikt). Før immunsuppressiv behandling skal tegn til tuberkulose utelukkes (IGRA), røntgen thoraks.
Immunologiske undersøkelser
-Anti-CCP antistoffer og Revmatoide faktorer (RF): Disse proteinene inneholder endret arginin som via PAD-enzym blir omdannet til citrullin. En lignende prosess ses ved at lysin blir til homocitrullin via cyanat enzym. Disse prosessene fører til at immunceller ikke gjenkjenner proteiner som eget vev (selvtoleransen brytes), og aktive T- og B-celler angriper vevet i et autoimmunt angrep. Påvisning av polyklonalt antistoff rettet mot citrullinerte antigener i synovium (som inneholder bl.a. fibrin) benyttes i diagnostikken av RA. Dette antistoffet omfatter de tidligere spesifisiteter som anti-perinukleær faktor, anti-keratin antistoff og anti-Sa antigen.
- Anti-CCP (første- og annengenerasjons) kan påvises hos 50-60% av pasienter med tidlig RA (3-6 måneders sykdom), med høy spesifisitet (95-98%).
- Anti-CCP kan foreligge flere år før sykdomsdebut (pre-klinisk fase) og ved palindrom revmatisme. Kombinasjon med leddsymptomer gir betydelig høyere risiko for revmatoid artritt (Hensvold AH, 2015). Nye pasienter med denne kombinasjonen bør vurderes av revmatolog innen 2-4 uker, spesielt ved forhøyet CRP.
- Revmatoide Faktorer (RF) er ofte positive sammen med anti-CCP, men har en underordnet betydning. Sensitiviteten stiger til 70% hos pasienter med etablert RA. Anti-CCP kan også påvises ved sykdomsutbrudd og hos pasienter med palindrom revmatisme, der det er en indikator på senere utvikling av RA.
- Selv om anti-CCP har høy spesifisitet for RA, kan antistoffet også påvises hos enkelte med SLE (RA/SLE=”Rhupus”), Sjøgrens eller psoriasisartritt. Disse har da ofte erosive, RA-lignende leddforandringer. Anti-CCP antistoff ses også ved aktiv tuberkulose.
- Ved tidlig RA utvikler pasienter med anti-CCP oftere radiografisk progresjon enn CCP-negative. Høye verdier av serum IgA RF og a-CCP er assosiert med høy sykdomsaktivitet, ledd-destruksjon og forekomst av ekstra-artikulære komplikasjoner.
-Revmatoide Faktorer (RF) er autoantistoffer rettet mot kroppens egne IgG-antistoffer og påvises hos 80-90 % av pasienter med erosiv RA. De kan være av IgM, IgG eller IgA type. RF produseres lokalt i leddvæske og er assosiert med ekstraartikulære manifestasjoner. Slike autoantistoffer kan også produseres ved ulike infeksjoner, leversykdommer, sarkoidose m.m. 1-5% av friske personer, særlig eldre, har RF i lave titere. Høye titer defineres som 2-3 ganger over øvre referanseområde. Data tyder på at seronegativ RA (RF-) har bedre prognose enn seropositiv RA (RF+), som i større grad assosieres med ekstra-artikulære manifestasjoner i lunger, hud og RA-vaskulitt (Derksen VFAM, 2017).
-Anti-nukleære antistoffer: ANA påvises hos 25 % ved RA, men er uten spesiell betydning dersom det ikke også foreligger symptomer på systemisk bindevevssykdom. Dette gjelder overlapp mot systemisk lupus (“Rhupus”) eller ved myositt (Pipili C, 2009).
Bildediagnostikk
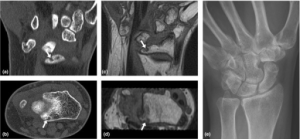
Ultralyd, computer tomografi (CT) og magnetresonanstomografi (MR) er etablerte metoder i diagnostikken av RA og har langt høyere presisjon enn konvensjonelle røntgenbilder (Aletaha D, 2010).
-Røntgen: Konvensjonelle røntgenbilder av begge hender og føtter brukes til å vurdere leddskader og gir et sammenligningsgrunnlag for å følge sykdomsutviklingen over tid. Røntgen thoraks utelukker åpenbar lungesykdom (CT er mer sensitiv og spesifikk), mens røntgenbilder av nakken i fleksjon og ekstensjon kan brukes til å undersøke for tegn på leddgikt i nakken hos asymptomatiske pasienter.
Røntgen kan påvise tegn på RA som leddnær osteoporose, avsmalning av leddspalten (tyder på brusksvinn) og erosjoner. Disse forandringene kan imidlertid være vanskelige å oppdage tidlig i sykdomsforløpet.
Larsens røntgengradering er en skala som brukes til å klassifisere alvorlighetsgraden av leddskade ved RA og baseres på røntgenbilder: (Larsen A, 1995)
0=Normalt ledd
- Bløtdelshevelse / osteoporose / avsmalning
- En eller to erosjoner
- Flere erosjoner, leddspaltereduksjon
- Store erosjoner, leddspalten er nesten borte
- Totalt destruert ledd
-CT-undersøkelser: CT viser i prinsippet de samme forandringene som røntgen, men gir mer detaljerte bilder og er mer spesifikt (se illustrasjon ovenfor). Ulemper med CT er at de bruker relativt mye ioniserende stråling, som kan skade DNA i cellene, og at undersøkelsen ikke fremstiller bløtvev like godt som MR og ultralyd (Døhn UF, 2007).
-Ultralyd-undersøkelser: Ultralyd bruker interaksjoner mellom vev og lydbølger for å lage bilder. Det kan påvise tidlige tegn på RA, som væskeansamling i leddet (hydrops) og betennelse i leddhinnen (synovitt), samt små erosjoner i bein og brusk, før disse forandringene kan sees på røntgen (Wakefield RJ, 2000). Ultralyd er et nyttig verktøy i utredningen av RA, men kan være tidkrevende ved rutinemessig oppfølging av pasienter med kjent diagnose (Haavardsholm EA, 2016; Hammer HB, 2012). Vennligst les om ultralydundersøkelse også i eget kapittel
| Ultralydundersøkelse av perifere ledd Ultralyd metode og atlas ved RA: Hammer HB 2011 | |
| Ledd | Leddenes posisjon |
| MCP 1-5 | Dorsal, longitudinal. Hånden hviler på et lite bord. Fingrene er ekstendert |
| Håndledd, radio-carpale og intercarpale ledd | Dorsal, longitudinal på nivå med lunatum capitatum |
| Håndledd, radio-ulnart | Dorsal, longitudinal på nivå med distale ulna. Hånden hviler på et lite bord |
| Albue | Anterior, longitudinal på nivå med distale humerus og proksimal radius |
| Kne | Anterior, longitudinal og lateral longitudinal av suprapatellar recess og den laterale recess. Pasienten hviler på benk med aktiv ekstendert kne |
| Ankel | Anterior, longitudinal over midtre del av leddet. Pasienten hviler med kneet flektert ca. 90 grader og foten hviler på benk |
| MTP 1-5 | Dorsal longitudinalt. Pasienten hviler med kne flektert ca. 90 grader og foten hviler på benken |
-MR-undersøkelser: MR gir detaljerte bilder av alle leddkomponenter og omkringliggende strukturer. Det er spesielt nyttig for å vurdere både inflammasjon og strukturell leddskade. MR gir informasjon for diagnostisering, prognostisering og monitorering av behandlingsrespons. MR er et viktig verktøy i utredningen av pasienter med tidlig udifferensiert artritt eller tidlig RA.
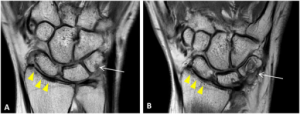
Studier har vist at MR kan identifisere pasienter med høy risiko for erosiv sykdom, da funn som erosjoner, synovitt og benmargsødem på MR er prediktorer for senere leddskade. Benmargsødem er en uavhengig risikofaktor for erosiv utvikling, påvist i to store MR-studier: en “inception-kohort” (Haavardsholm et al, ARD 2008), og en randomisert klinisk studie (Hetland et al, ARD 2009).
MR kan også brukes til å vurdere om ryggmargen og hjernestammen er påvirket ved RA. Supplerende CT er nødvendig før eventuell kirurgisk intervensjon (Manczak M, 2017).
Biopsi
Selv om biopsi sjelden er nødvendig for å diagnostisere revmatoid artritt (RA), kan det i noen tilfeller være aktuelt å ta en vevsprøve for å bekrefte diagnosen eller utelukke andre tilstander.
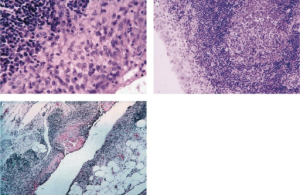
En synovialbiopsi, hvor en liten prøve av leddhinnen (synovium) tas ut, kan gi verdifull informasjon om sykdomsprosessen ved RA. Allerede tidlig i sykdomsforløpet kan man påvise inflammatoriske celler i synovialmembranen. Sykdommen kjennetegnes av økt antall monocytter og en fortykkelse av synovialhinnen med villøse utvekster (synovitt) som vokser inn mot leddhulen.
Vaskulitt i små kar kan påvises i revmatiske knuter (noduli) hos noen pasienter med RA. Biopsi av en slik knute kan vise tegn på vaskulitt, etterfulgt av kronisk granulomatøs betennelse.
Diagnose og klassifikasjonskriterier
Diagnosen RA stilles vanligvis når følgende fire punkter foreligger:
- Inflammatorisk artritt i tre eller flere ledd
- Positiv anti-CCP
- Forhøyet CRP
- Ikke funn forenelig med psoriasisartritt, viral polyartritt, krystallartitt eller systemisk lupus (SLE) (se også differensialdiagnoser nedenfor)
Mange bruker også klassifikasjonskriteriene for å diagnostisere i klinisk hverdag, hvorav 2010 ACR/EULAR kriteriene er mest aktuelle (se nedenfor).
ACR/EULAR 2010 kriterier
Forutsetning for bruk av kriteriene er minst ett sikkert artritt-ledd som ikke kan forklares ut i fra annen sykdom. Sum-score på minst 6/10 er nødvendig for klassifisering av RA
| A. Ledd-affeksjon | Score |
| -Ett stort ledd (skulder, albue, hofte, kne, ankel) | 0 |
| -2-10 store ledd | 1 |
| -1-3 små ledd (med eller uten affeksjon også av store ledd) | 2 |
| -4-10 små ledd (med eller uten affeksjon også av store ledd) | 3 |
| -mer enn 10 ledd (minst ett lite ledd) | 5 |
| B. Serologi (minst ett test-resultat: med lavt menes: ≤ 3 x øvre ref. område. Høyt > 3x referanseområdets øvre grense
-Negativ RF og negativ ACPA/anti-CCP |
0 |
| -Lav-positiv RF eller lav ACPA/CCP | 2 |
| -Høy-positiv RF eller ACPA/CCP | 3 |
| C. Akutt-fase reaktanter (minst en positiv test) | |
| -Normal CRP og SR | 0 |
| Unormal CRP eller SR | 1 |
| D. Varighet av symptomer | |
| -mindre enn 6 uker | 0 |
| -Mer enn 6 uker | 1 |
ACR 1988 (American College of Rheumatology). Krever minst 4 av følgende:
- Morgenstivhet minst en time
- Artritt i minst tre ledd observert av lege
- Artritt i håndledd, MCP eller PIP
- Symmetrisk artritt i håndledd, MCP, PIP el. MTP
- Revmatoide knuter
- Forandringer i håndledd eller fingre
- Revmatoide faktorer
Punktene 1-4 skal ha en varighet på minst 6 uker
Mål for sykdomsaktivitet
Det er utarbeidet standardiserte metoder. Vennligst les i eget kapittel om skåring av sykdomsaktivitet og organskade.
Andre typer revmatoid artritt (Atypisk RA)
-Preklinisk RA kan defineres som en tidlig fase, før artritt oppstår. Det kan diskuteres om pasienter med MR-funn tydende på (subklinisk) artritt eller med forhøyet CRP som tegn på systemisk inflammasjon tilhører denne gruppen eller om de representerer “tidlig RA”
-Tidlig RA
Definisjonen av tidlig RA varierer. En studie som inkluderte norske pasienter definerte tidlig RA som symptomvarighet under to år hos personer over 18 år, med revmatoid faktor eller anti-CCP-antistoffer, eller forhøyet CRP (Hetland LM, 2020). “Veldig tidlig artritt” kan defineres som sykdomsvarighet under 12 uker fra debut av første symptom. Begrepene “tidlig-” og “veldig tidlig artritt” er relevante fordi noen pasienter utvikler erosjoner og leddskade allerede innen denne tiden (Bosello S, 2010).
Typisk for tidlig RA er debut med smerte og stivhet eller hevelse i flere ledd (Singh JA, 2012). Diagnosen baseres på symmetrisk artritt i MCP-, PIP- og MTP-ledd, høye nivåer av anti-CCP og/eller revmafaktor (RF), samt økt CRP og senkningsreaksjon (SR) (Radu R-F, 2021).
Tidlig behandling er essensielt for å forhindre leddskader (Sundlisæter NP, 2018). Imidlertid kan det være forsinkelser i henvisning til revmatolog, noe som kan føre til at pasienten ikke får spesialistvurdering innenfor tidsrammen for tidlig artritt. Ventetider settes sammen av at pasienter venter før de kontakter fastlege. Fastlegen bruker tid på utredning og henvisning og sykehus/spesialist har ventetid. Uten spesielle tiltak kan den samlede ventetiden er overstiger tids-definisjonen på tidlig artritt (Palm Ø, 2004). Det er derfor opprettet “tidlig artritt-klinikker” uten ventetider for spesialist-vurdering (Nisar MK, 2019).
Klassifikasjonskriteriene for RA (2010) er ikke like gode for klassifisering av tidlig artritt som ved etablert sykdom (Mjaavatten MD, 2013), EULAR har derfor utarbeidet egne retningslinjer (Combe B, 2016).
-Seropositiv RA versus seronegativ RA:
Seropositiv RA, der anti-CCP eller RF er positive, er den vanligste formen og utgjør 80-90 % av alle RA-tilfeller. Seropositivitet har tradisjonelt vært ansett som et tegn på et mer alvorlig og destruktivt sykdomsforløp, men nyere forskning har vist at også seronegativ RA kan føre til erosjoner og leddskade, og at behovet for behandling er like stort (Norberg LG, 2018). Også når en vurderer pasientrapporterte utfall som inkluderer fysisk funksjon og redusert arbeidsevne er det ingen forskjell mellom seropositiv og seronegativ RA (Boer AC, 2018).
Diagnostiske kriterier for seronegativ RA
- Oppfyller de fire første ACR kriteriene (1-4)
- Radiologiske forandringer forenelige med RA
- Sykdomsvarighet i minst tre år hvor mange pasienter er testet negativ for RF x 3
- Eksklusjon av andre sykdommer som kan gi lugnende symptomer som sakroiliitt, psoriasis, symptomgivende IBD (Ulcerøs kolitt eller Mb. Crohn), andre artritt-sykdommer ekskluderes og psoriasis, IBD, ankyloserende spondylitt eller reaktiv artritt blant første grad slektninger.
Litteratur Gran & Husby J Rheumatol 1987, 14; 1079-81
-Non-erosiv RA:
Non-erosiv RA er en form for RA uten påviselige erosjoner etter flere års sykdom. Det er omdiskutert om dette i de fleste tilfeller faktisk er revmatoid artritt, og det er viktig å vurdere differensialdiagnoser. (se nedenfor).
-RA hos eldre personer (Senil RA eller LORA)
Senil RA kalles også LORA (Late Onset RA) (Korkmaz C, 2017)og debuterer etter 60-65 års alder. Opprinnelig beskrevet denne tilstanden beskrevet som en benign form, ofte med lite eksudativ og seronegativ sykdom. Imidlertid kan sykdomsforløpet være aggressivt med sen mer akutt debut, mer systemisk inflammasjon, polymyalgia revmatika-lignende symptomer, affeksjon av store ledd og dårligere prognose. Dette kan skyldes komorbiditet, polyfarmasi, kognitiv svikt, depresjon og falltendens. Dessuten kan inflammasjonsmarkørene IL-6 og CRP ofte være høyere hos personer med senil RA, mens TNF∝ og revmafaktorer er lavere (Serhal L, 2020). RS3PE (remittering seronegativ symmetrisk synovitis med pitting ødem), erosiv (azotemisk) osteoarthropati og polymyalgia revmatika er de vanligste differensialdiagnoser til senil RA/LORA..
-Malign eller Systemisk RA
Malign eller systemisk RA er en sjelden, men aggressiv form for RA som oftere rammer menn i alderen 60-70 år. Sykdomsbildet preges av lite eksudativ synovitt, hyppig serositt (pleuritt, perikarditt), vaskulitt og revmatiske knuter (noduli). Det kan også utvikles komplikasjoner som koronarangiitt, polynevropati, interstitiell Iungesykdom, glomerulonefritt, episkleritt og skleritt. Vekttap er vanlig (Lilleby V & Gran. Tidsskriftet 1997; 117: 4223-5).
Differensialdiagnoser
Mange tilstander kan etterligne RA, spesielt i tidlig fase og når anti-CCP er negativ (seronegativ RA) (Paalanen R, 2020). En mer presis diagnostisk vurdering kan gjøres basert på antall affiserte ledd og deres lokalisering, som kan klassifiseres som monoartritt (ett ledd), oligoartritt (2-4 ledd) eller polyartritt (5 eller flere ledd). For mer informasjon om disse artritt-typene, se eget kapittel om artritt-diagnoser.
For en revmatolog i spesialisering er det viktig å være kjent med “mimickers” for RA, slik at korrekt diagnose og behandling sikres:
| Forskjell mellom psoriasisartritt (PsA) og RA: Tabell tilpasset etter Coates LC, Clinical Medicine 2017 |
||
| Symptomer | PsA | RA |
| Antall affiserte ledd | 30-50% har oligoartritt | Polyartritt vanligst |
| Ledd-affeksjon | Hvilket som helst, inkludert DIP | Ikke DIP ledd |
| Entesitt | Klinisk hos 60-80% | Uvanlig |
| Daktylitt | Klinisk hos 30% | Uvanlig |
| Aksial affeksjon | Aksial fenotype | Erosiv cervikal affeksjon |
| Kutan / negle affeksjon | Psoriasis: 80% hud, 60% negler | Ikke økt forekomst |
| Serologiske antistoff | RF og CCP vanligvis negative | RF og CCP oftest positive |
| Bildediagnostikk | Peri-ostal ny benformasjon | Erosjoner og osteopeni |
- Artrose (CMC-1, PIP, DIP og MTP-1, normale inflammasjons-parametere). Degenerativ leddsykdom som primært rammer vektbærende ledd og ofte presenterer med smerter og stivhet, men uten systemisk inflammasjon.
- Kan ramme lignende ledd som RA, spesielt i hendene, men mangler typisk symmetrisk affeksjon og systemiske symptomer. Normale inflammasjonsparametere skiller den fra RA.
- Borrelia-artritt: Oftest ett kne noen uker etter bitt av skoglått, særlig der denne ikke ble fjernet raskt. Infeksiøs artritt forårsaket av Borrelia burgdorferi, ofte monoartikulær og assosiert med erythema migrans.
- Kan presentere med leddhevelse og smerter, men anamnese med flåttbitt og ensidig affeksjon skiller den fra RA.
- Erosiv osteopati (mixed arthritis/blandet artrose og artritt): En form for artrose med radiologiske tegn på både degenerasjon og inflammasjon som kan føre til erosjoner og ligne RA.
- IBD. Artritt ved inflammatoriske tarmsykdommer (IBD): Assosiert med Crohns sykdom eller ulcerøs kolitt, ofte perifer artritt eller aksial spondyloartritt.
- Kan medføre perifer artritt, men gastrointestinale symptomer og assosiasjon med IBD skiller den fra RA
- Infeksiøs/septisk artritt: Akutt artritt forårsaket av bakteriell infeksjon i leddet, preget av smerter, hevelse, rødhet og feber.
- Kan gi akutt leddinflammasjon, men feber, ensidig affeksjon, og purulent leddvæske skiller den fra RA.
- Kreftbehandling med sjekkpunkthemmere; Immunrelaterte bivirkninger av sjekkpunkthemmere, inkludert artralgi, artritt og myalgi
- Kan indusere inflammatorisk artritt, men anamnese med kreftbehandling og rask debut skiller den fra RA (Steven NM, 2019).
- Kryoglobulinemi syndromet: Systemisk vaskulitt forårsaket av kryoglobuliner, ofte assosiert med Hepatitt C.
- Kan presentere med artritt, vaskulitt og revmatoid faktor, men hudmanifestasjoner, systemiske symptomer og assosiasjon med Hepatitt C skiller den fra RA.
- Palindrom revmatisme: Episodisk artritt med selvbegrensende anfall av leddhevelse og smerter.
- Kan presentere med polyartikulær artritt, men den episodiske naturen og fravær av ledderosjoner skiller den fra RA. Anti-CCP kan være positiv ved begge tilstander.
- Paramalign artritt: Assosiert med malignitet, ofte presentere før, samtidig med, eller etter kreftdiagnose.
- Kan etterligne RA klinisk, men anamnese med malignitet og rask debut skiller den fra RA.
- Polymyalgia revmatika: Preget av smerter og stivhet i proksimale muskler, ofte hos eldre individer.
- Presenterer seg med stivhet og forhøyede inflammasjonsparametere, men affeksjon av proksimale muskler, fravær av synovial inflammasjon, og alder skiller den fra RA
- Psoriasisartritt: Assosiert med psoriasis, ofte asymmetrisk og affiserer DIP-ledd.
- Typisk med perifer artritt, men hudmanifestasjoner av psoriasis, negativ revmatoid faktor, og karakteristisk radiologisk bilde skiller den fra RA.
- Pyrofosfat-artritt (kondrokalsinose, pseudogikt, eldre personer): Akutt artritt forårsaket av krystaller av kalsiumpyrofosfat i leddet, ofte monoartikulær og rammer kneet.
- Ofte akutt leddinflammasjon, men karakteristisk radiologisk bilde med kondrokalsinose og identifikasjon av krystaller i leddvæsken skiller den fra RA.
- Reaktiv artritt: Inflammatorisk artritt utløst av en infeksjon i mage-tarmkanalen eller urogenitaltraktus.
- Kan presentere med perifer artritt, men anamnese med presederende infeksjon og karakteristiske ekstraartikulære manifestasjoner skiller den fra RA.
- Retikulohistocytose, multisentrisk: Sjelden systemisk sykdom med nodulære hudlesjoner og destruktiv artritt.
- Polyartikulær artritt og erosjoner, men hudlesjoner og systemiske manifestasjoner skiller den fra RA.
- RS3PE: Inflammatorisk sykdom preget av symmetrisk hevelse i hender og føtter, dactylitt og palmar erytem.
- Symmetrisk artritt i hender, men dactylitt, palmar erytem, og fravær av erosjoner skiller den fra RA.
- Sarkoidose: Granulomatøs inflammasjon i forskjellige organer, inkludert lunger, hud og ledd.:
- Kan presentere med artritt, men lunge- og hudmanifestasjoner, hiluslymfadenopati og forhøyet ACE-nivå skiller den fra RA.
- Løfgrens syndrom; Akutt form for sarkoidose med erythema nodosum, bilateral hiluslymfadenopati og artritt/artralgi.
- Artritt, men den akutte debuten, erythema nodosum, og hiluslymfadenopati skiller den fra RA.
- Systemisk lupus (SLE) og andre systemiske bindevevssykdommer: Autoimmune sykdommer med multiorgan affeksjon, inkludert artritt, hudutslett, renal involvering og hematologiske avvik.
- Kan presentere med artritt, men systemiske manifestasjoner, spesifikke autoantistoffer og karakteristiske kliniske funn skiller dem fra RA.
- Urinsyregikt: Inflammatorisk artritt forårsaket av urinsyrekrystaller i leddet, ofte monoartikulær og rammer stortåen.
- Ofte akutt leddinflammasjon, men den karakteristiske affeksjonen av stortåen, hyperurikemi og identifikasjon av krystaller i leddvæsken skiller den fra RA.
- Viral akutt polyartritt: Akutt artritt utløst av viral infeksjon, ofte polyartikulær og selvbegrensende.
- Polyartikulær artritt, men den akutte debuten, assosiasjon med viral infeksjon, og selvbegrensende forløp skiller den fra RA. Parvovirus B19, Hepatitt -B og -C, Alfa-virus inklusiv Chikungunya: reise-anamnese: Triade: feber, artritt, utslett, Rubella (Røde hunder blant ikke-vaksinerte)
- Whipples sykdom: Infeksjonssykdom med seronegativ varierende artritt som forutgår generelle symptomer på Whipples.
Behandling
Overordnede behandlingsprinsipper ved RA legger vekt på pasientmedvirkning i valg av behandling, og at behandlingen tilpasses sykdomsaktivitet, pasientsikkerhet, komorbiditet og sykdomsforløp. Revmatologer er spesialistene som vanligvis initierer og følger opp spesifikk medikasjon (Smolen JS, 2020).
Ikke-medikamentell behandling
- Kosthold/ Ernæring: Pasienter er ofte interessert i hvordan kosthold kan påvirke RA, men effekten av spesifikke kostholdsendringer er ikke godt dokumentert. Et sunt og balansert kosthold anbefales generelt (Gioa C, 2020).
- Mikrobiota. Tarmfloraen (mikrobiota) kan ha betydning for sykdomsaktivitet, men det er fortsatt uklart om RA kan behandles ved å påvirke mikrobiotaen (Zhao T, 2022).
- Tverrfaglig behandling: Revmatologisk behandling krever ofte samarbeid mellom ulike faggrupper, som fysioterapeuter, ergoterapeuter, sosionomer og sykepleiere (Steultjens EJM, 2002).
- Forebyggende tiltak. Det er lite dokumentasjon på effekten av forebyggende tiltak hos personer med risikofaktorer for RA. Røykeslutt anbefales på generelt grunnlag, og sunn kroppsvekt er et mål (Deane KD, 2017).
- Revmakirurgi omfatter synovektomi, artroskopi, osteotomi, artroser, metatarsal hode excision artroplastikker eller innsetting av totalproteser (Trieb K, 2009). Vennligst les om revmakirurgi i eget kapittel.
Medikamentell behandling
Behandlingsmulighetene for RA har utviklet seg betydelig de siste tiårene. Nyere behandlingsmetoder har ført til betydelig bedring i både fysisk funksjon og prognose for personer med RA. Sykdomsremisjon uten radiografisk skade eller progresjon er nå et realistisk mål.
Behandlingsmål: Målet med RA-behandling har endret seg fra å lindre symptomer til å oppnå remisjon, det vil si fravær av sykdomsaktivitet og progresjon, samt kontroll på leddsmerter og betennelse. Målet er også å forhindre varig leddskade.
Behandlingsstrategi: Den sykdomsspesifikke behandlingen starter vanligvis med et csDMARD, oftest metotreksat, så snart diagnosen er sikker. Kortikosteroid kan gis i tillegg for rask symptomlindring. Dersom metotreksat ikke gir tilstrekkelig effekt innen 3 måneder, eller remisjon ikke er oppnådd etter 6 måneder, velger en ofte å supplere behandlingen med et biologisk DMARD (bDMARD), som for eksempel en TNF-hemmer. Dersom biologisk behandling ikke tolereres, har utilstrekkelig effekt eller er kontraindisert, kan en JAK-hemmer (tsDMARD) være et alternativ. I noen tilfeller velger en å begynne tidligere med bDMARDs (Burgers LE, 2019). Samtidig vurderes på ny at diagnosen og behandlingsindikasjonene er riktige (Smolen JS, 2023). Behandlingsprosedyre er mer detaljert beskrevet i Metodeboken til Norsk Revmatologisk Forening.
Utfordringer: Utfordringer ved RA-behandling inkluderer å unngå bivirkninger, sikre at pasientene følger behandlingsanbefalingene og kontrollere kostnadene Studier har vist at pasientmedvirkning i behandlingsvalg (shared decision making) kan øke etterlevelsen av behandlingen.(Barton JL, 2020).
Pasientinformasjon. Det er viktig å gi pasienten grundig informasjon om sykdommen, behandlingsalternativer og mulige bivirkninger. Da kan uheldig auto-seponering eller manglende oppfølging fra pasientens side som årsak til behandlingssvikt unngås. Mange revmatologiske avdelinger tilbyr tilrettelagte kurs for pasienter og ledsagere og det arrangeres møter og kurs i samarbeid med pasientorganisasjonene. I tillegg ligger pasientinformasjon om sykdommer på Norsk Revmatikerforbunds hjemmesider. Informasjon om legemidler kan hentes fra Norsk Revmatologisk Forening/Legeforeningen. Når behandlingen styres av spesialist i revmatologi og etter anbefalte retningslinjer, viste norske data mellom 2000 og 2010 at remisjon oppnås hyppigere, noe som er avgjørende for god prognose (Aga AB, 2013).
Før behandlingen er det viktig å informere pasienten om hensikten med behandlingen og hvorledes medikamenter virker. Pasientinformasjon fra legeforeningen/Norsk Revmatologisk Forening kan gjerne brukes. Retningslinjer for behandling er et godt utgangspunkt for medikamentvalg. I tillegg gjøres individuell vurdering (tilpasset legemiddelbehandling) i forhold til alder og vekt, medikament-anamnese og komorbiditet, vaksinasjoner og svangerskap eller svangerskapsønske. Velger en behandling utenfor godkjent indikasjon / utprøvende behandling tas også spesielle hensyn.
Medikamentgrupper:
Analgetika: De fleste RA-pasientene trenger symptomatisk behandling med analgetika i tillegg til NSAIDs og DMARDs. Paracetamol er vanligvis førstevalget, men i noen få tilfeller kan opioider eller kombinasjonspreparater være nødvendig for kortvarig bruk. Langtidsbruk av opioider bør unngås på grunn risiko for avhengighet (NICE Guideline, 2018). Vennligst les mer om analgetika i eget kapittel.
NSAIDs (ikke-steroide antiinflammatoriske legemidler): Disse er blant de eldste medikamentene vi bruker mot smerte, feber og inflammasjon. De virker raskt ved at de hemmer prostaglandin-syntesen. NSAIDs påvirker imidlertid kun symptomene og ikke sykdomsprogresjonen, og brukes derfor vanligvis i kombinasjon med DMARDs ved aktiv RA. Ulike NSAIDs har omtrent samme effekt, men varierende halveringstid. (NICE Guideline, 2018). Vennligst les mer om NSAIDs i eget kapittel.
Kortikosteroider: Prednisolon eller tilsvarende kortikosteroid kan benyttes i tiden før respons på DMARDs (“bridging”), ved akutte eksaserbasjoner og ved noen ekstraartikulære manifestasjoner. En lav til moderat dose (10-30 mg/dag) med gradvis nedtrapping og avslutning innen få måneder er ofte tilstrekkelig. En sammenligning av initiale prednisolon-doser på 10mg og 60 mg/dag viste ikke bedre nytte av 60 enn av 10mg (Krause D, 2022). En må imidlertid ta høyde for individuelle sykdomsforløp og tilsvarende tilpasset behandling. Vennligst les mer om kortikosteroider i eget kapittel.
Intraartikulære injeksjoner: Injeksjoner med kortikosteroider (triamcinolon, Lederspan) direkte i betente ledd kan gi rask symptomlindring. Injeksjonene kan med fordel gjøres ultralydveiledet for å sikre presisplassering (Norberg LB, 2018). Teknikken læres under tjenestetiden som LIS-lege. Injeksjonsmetoder for noen av de vanligste leddene er vist i eget kapittel om leddpunksjon og injeksjonsbehandling.
DMARDs (Disease Modifying Anti Rheumatic Drugs): DMARDs kan deles inn i tre hovedgrupper:
- Konvensjonelle syntetiske DMARDs (csDMARDs): Metotreksat, sulfasalazin, leflunomid, azatioprin, ciklosporin, mykofenolat.
- Biologiske legemidler (bDMARDs): Eksempler: TNF-hemmere (etanercept, infliksimab, adalimumab, golimumab, certolizumab pegol), interleukinhemmere (IL-1-hemmer anakinra, IL-6-hemmer tocilizumab), B-cellehemmer (rituksimab).
- Målrettede (targeted) syntetiske molekyler (tsDMARDs) som omfatter Januskinase hemmere (JAK-hemmere): (tofacitinib, baricitinib, upadacitinib, filgotinib).
csDMARDs er grunnstammen i behandlingen av RA og har som mål å bremse sykdomsprogresjonen og forhindre leddskade. Metotreksat er ofte førstevalget og kan kombineres med biologiske legemidler (bDMARD) ved behov. csDMARDs settes inn med en gang en sikker diagnose med sykdomsaktivitet foreligger. Det er ønskelig at denne perioden ikke overstiger 4-6 uker. Det er en spesialistoppgave å beslutte oppstart med DMARDs.
Tester og vaksiner før oppstart av ethvert DMARD bør det utføres blodprøver. Disse kan omfatte hematologisk status, leverenzymer, kreatinin, antistoff mot hepatitt -B og -C, samt IGRA-test for tuberkulose. Pasienter med kronisk viral hepatitt har overhyppighet av hepato-toksisitet. Rtg thoraks tas for å ha et utgangspunkt dersom det under behandling med metotreksat skulle oppstå pulmonale symptomer. Pasientene bør også vurderes for vaksinering mot influensa og pneumokokker, samt hepatitt og andre hvis risiko for infeksjon foreligger. Den relativt nye “døde” herpes zoster-vaksinen, Shingrix, anbefales til utsatte grupper (Winthrop KL, 2022).
Metotreksat (MTX) er et csDMARD som først ble brukt mot RA i 1962 og ble mer utbredt fra 1980-tallet. Metotreksat men er fortsatt en hjørnesten i behandlingen av flere grunner.
- 25-40% har god effekt av metotreksat alene og kombinert med prednisolon oppnår nesten 50% lav sykdomsaktivitet eller remisjon ved tidlig RA (Bertrand D, 2024).
- Sammen med biologiske legemidler øker metotreksat behandlings-effekten.
- Metotreksat reduser utvikling av nøytraliserende antistoffer ved bruk av biologiske legemidler (se nedenfor).
- Vanligvis begynnes med metotreksat i doser opp til 25mg/uke.
Bivirkninger av MTX som kvalme, hårtap, stomatitt og hepato-toksisitet kan forebygges med profylaktisk folsyre 1mg/dag eller 10mg/uke. Omtrent 5% må likevel avslutte metotreksat på grunn av bivirkninger (Alethaha D, Smolen JS, JAMA 2018). Hypersensitivitetspneumonitt kan oppstå tidlig i behandlingsforløpet (oftest første 6 måneder), men er sjelden og responderer på kortikosteroider. Lungefibrose forventes ikke å være relatert til metotreksat (Turesson, 2024).
Blant kontra-indikasjoner er leversykdom, alvorlig nyresvikt (eGFR <30) og svangerskap eller planlagt svangerskap. Ved lavgradig nyresvikt (lett økt kreatinin eller litt lav eGRF må en være klar over at metotreksat kan akkumuleres og medføre toksisitet. Tilsvarende ved bruk av trimetoprim, trimetoprim-sulfa/Bactrim (mot infeksjon). Forsiktighet anbefales ved kjent lungesykdom.
Andre csDMARDs. Alternativer til metotreksat (se ovenfor) er sulfasalazin (Salazopyrin) og leflunomid (Arava) (Smolen JS, 2023). Andre DMARDs som azathioprin (Imurel), ciclosporin (Sandimmun Neoral) og mykofenolat (CellCept) har vanligvis mindre effekt mot artritt og brukes i dag fortrinnsvis ved ekstra-artikulære manifestasjoner. Vanligvis kombineres ikke de ulike csDMARDs (Kerrigan SA, 2020). Dersom pasienten er i vedvarende remisjon og supplerende behandling med kortikosteroider er avsluttet, vurderes om csDMARDs kan trappes ned og avsluttes (Smolen JS, 2023). Imidlertid vil en betydelig andel av pasientene oppleve tilbakefall av sykdomsaktivitet (Kjørholt KE, 2024). Vennligst ler mer om csDMARDs i eget kapittel.
Det forventes å ta 6-8 uker før behandlings-respons med csDMARDs inntreffer. Hvis det er behov for rask reduksjon av inflammatorisk aktivitet brukes Prednisolon 5-15 mg/dag i mellomtiden (“bridging”, se ovenfor). Kortikosteroider er beskrevet i eget kapittel.
Dersom csDMARDS ikke er tilstrekkelig eller bivirkninger gjør annen behandling nødvendig, kan en velge et biologisk legemiddel eller en JAK-hemmer (tsDMARDs). tsDMARDS er tabletter, noe som ofte foretrekkes og forventet effekt er minst like god som for biologiske legemidler. Imidlertid er risikoen for herpes zoster og antakelig kardiovaskulær sykdom økt, noe som tilsier forsiktighet, spesielt hos eldre pasienter (van de Laar CJ, 2024).
Biologiske legemidler (bDMARDs): Generell indikasjon er pasienter med aktiv sykdom som ikke har respondert med effekt eller remisjon på ett eller flere csDMARDs innen 3- 6 måneder.
- TNF-hemmere er mye brukt. Eksempler er etanercept, infliksimab, adalimumab, golimumab og certolizumab pegol (Wysocki T, 2022). Virkning på sykdomsaktivitet forventes i løpet av få uker.
- Interleukin-6-hemmere: Disse hemmer interleukin-6, et annet signalstoff involvert i inflammasjonen, f. eks tocilizumab og sarilumab.
- B-cellehemmere retter seg mot B-celler, f. eks. rituximab og ofatumumab.
- T-cellehemmere påvirker T-celler, f. eks abatacept.
- Anakinra (Kineret) er en IL-1 hemmer som har RA som indikasjon. Sammenlignet med andre bDMARDs er effekten imidlertid dårligere (Nikfar S, 2018), slik at den i praksis er lite brukt mot RA.
- B- og T-celler kan spesifikt og effektivt hemmes i utprøvende behandling med “bispecific T-cell engagers” (BiTE) med medikamenter som blinatumomab (Blincyto®). Det er i korttidsstudier vist lovende resultater, men flere data bl. a. på sikkerhet er nødvendige før metoden ev. kan tas i bruk i klinisk hverdag (Bucci L, 2024).
Blant bivirkninger ved biologiske legemidler er økt infeksjonsrisiko, blant annet oppbluss av latent tuberkulose (Zhang Z, 2017).
Dersom sykdommen er i vedvarende remisjon og supplerende behandling med kortikosteroider er avsluttet, vurderes om bDMARDs kan trappes ned og avsluttes, særlig hvis pasienten også bruker et csDMARD (Smolen JS, 2023). Slik som under behandling med csDMARDS vil imidlertid en betydelig andel av pasientene oppleve tilbakefall av sykdomsaktivitet (Kjørholt KE, 2024; Kedra J, 2024). (Vennligst les mer om biologiske legemidler i eget kapittel).
JAK-hemmere (tsDMARDs): Når biologiske legelider ikke har tilstrekkelig virkning eller ikke tolereres, kan JAK-hemmere være et aktuelt behandlingsvalg (Goll GL, 2020). Bruken forutsetter at risiko for potensielle bivirkninger er vurdert på forhånd. Disse omfatter kardiovaskulær sykdom, hudkreft (adjudicated nonmelanoma skin cancer) og infeksjoner (Ytterberg SR, 2022; Smolen JS, 2023 ). Generelt utvises forsiktighet blant pasienter over 65 års alder, ved kjent kardiovaskulære risikofaktorer (koronar hjertesykdom, aterosklerose og tidligere kardiovaskulær hendelse som myokardinfarkt, iskemisk slag, tromboembolier), røkere og ved høy kreft-risiko (Aymon R, 2024). Tofacitinib (Xeljanz), baricitinib (Olumiant), upadacitinib (Rinvoq) og Jyseleca (filotinib) er tabletter som intracellulært hemmer JAK-kinase (JAK1, 2 og 3, samt TYK2 / tyrosinkinase 2) i patogenesen av RA (Genovese MC, 2016). Effekten og indikasjonene kan sammenlignes med biologisk behandling (Combe B, 2021). Noen av bivirkninger er omtrent som for de biologiske legemidlene. Dette inkluderer økt infeksjonsrisiko, forhøyede leverfunksjonsprøver, neutropeni og hyperlipidemi. Mer spesifikk bivirkning er økt forekomst av herpes zoster (Taylor PC, 2019). Dersom sykdommen er i vedvarende remisjon og supplerende behandling med kortikosteroider er avsluttet, vurderes om tsDMARDs kan trappes ned og avsluttes, særlig hvis pasienten også bruker et csDMARD (Smolen JS, 2023 ). Vennligst les mer om JAK-hemmere i eget kapittel.
Statiner kan ha en gunstig effekt på RA-relatert hjerte- og karsykdom, både ved å senke kolesterolnivået og gjennom antiinflammatoriske og antioksidative effekter (Soulaidopoulos S, 2018).
Oppfølging under behandling
Regelmessig oppfølging hos revmatolog er viktig for å monitorere sykdomsaktivitet, vurdere behandlingsrespons og justere behandlingen ved behov. En ønsker gjerne å oppnå på forhånd avtalte behandlingsmål (“treat to target”). Slike behandlingsmål kan også omfatte reduksjon av utmattelse/fatigue. Oppnås reduksjon av høy sykdomsaktivitet, bedres ofte også fatigue. I enkelte tilfeller forløper imidlertid utmattelse uavhengig av andre symptomer og undersøkelsesfunn (Uhlig T, 2018) og kan i blant være betinget i depresjon (Michelsen B, 2017).
- Ved aktiv sykdom er kontroll hos en revmatolog eller spesialavdeling hver 1-3 måned nødvendig. Hensikten er å justere behandlingen etter sykdomsaktivitet og ev. komplikasjoner slik at en oppnår behandlingsmålet raskest mulig og med færrest mulige bivirkninger. Tett revmatologisk oppfølging under perioder med høy sykdomsaktivitet er vist å bedre prognosen (Burmeister GR, 2017). Kliniske undersøkelser av ledd (leddstatus) er i forløpet essensielt for vurdering av sykdomsaktivitet. Supplerende undersøkelse med ultralyd kan avdekke subkliniske forandringer, men er mer resurskrevende og fører ikke til bedre resultater (Sundin U, 2020).
- Når remisjon eller lav sykdomsaktivitet er nådd, kan sykdommen følges opp hver 3-12 måned, så lenge det er behov for sykdomsdempende behandling (Smolen JS, 2016, EULAR).
- Dersom RA er i vedvarende remisjon uten DMARDs eller annen sykdomsdempende behandling, velger en ofte å avslutte oppfølgingen hos spesialist.
- Før operasjon er det litt ulike prosedyrer. Tyske anbefalinger (Albrecht K, 2022) foreslår:
- Kortikosteroider som prednisolon forsøkes redusert 2-3 måneder før inngrepet, til lavest mulig dose, helst <10mg/døgn.
- Metotreksat-dosen bør være ≤ 15/mg/døgn
- Leflunomid (Arava) kan vaskes ut etter prosedyre, dersom spesiell høy infeksjonsrisiko foreligger.
- Azathioprin (Imurel, mykofenolat og ciclosporin A kan settes på pause 1-2 dager for inngrep
- Biologiske legemidler (bDMARDs) settes på pause i minst ett doseringsintervall (eller for TNF-hemmere anbefalt å stanse TNF-hemmere avhengig halveringstiden (stanse minst 2 ganger halveringstiden) for det enkelte medikament ihht norske prosedyrer)
- JAK-hemmer (tsDMARD) stanses 3-4 dager før større inngrep.
- Apremilast (Orencia) kan kontinueres
- Etter operasjoner gjøres re-startes biologiske legemidler i form av TNF-hemmer generelt 2 uker etter inngrepet, men avhengig av postoperativt forløp ihht norske prosedyrer.
Sykdomsaktiviteten vurderes ved en kombinasjon av anamnese, klinisk undersøkelse og blodprøver med CRP eller senkningsreaksjon (SR). I tillegg kan en bruke standardiserte verktøy som DAS 28, SDAI eller CDAI. Disse omfatter vurdering av antall hovne og ømme ledd, smerteskala, CRP og/eller SR, legens og pasientens vurdering. I den grad en anser sykdomsaktivitet for en objektiv størrelse, er det en ulempe at også subjektive mål inngår i skåringene. Spørreskjema der pasienten selv estimerer sin sykdom (patient-reported outcome measures = PROMS) som Rheumatoid Arthritis Impact of Disease (RAID) -score brukes også i økende grad (Holte K, 2018). En bør imidlertid være oppmerksom på at generalisert non-inflammatorisk smerte som er vanligere ved RA enn i befolkningen ellers (Ranzolin A 2009; Wolfe F, 2011) kan medføre høyere skår enn den inflammatoriske tilstanden tilsier (Pollard LC, 2010). Vennligst se også kliniske verktøy for skåring av sykdomsaktivitet og skade i eget kapittel. I regi av OMERACT er det utviklet et skåringssystem (RAMRIS) for resultater av MR-undersøkelser (Østergaard M, J Rheum 2017). Tilsvarende for ultralyd: Ultralyd metode og atlas ved RA: Hammer HB 2011.
Kardiovaskulær sykdom. EULAR anbefaler screening for kardiovaskulær sykdom regelmessig (minst hvert 5. år) ved revmatoid artritt. R Agca, et al 2016.
Cervikal manifestasjon. Ved ustabilitet i nakken kan en stiv nakkekrage være nødvendig. Smerter kan behandles med NSAIDs eller analgetika. Kirurgisk behandling (revmakirurgi/nevrokirurgi) vurderes ved glidning over 8 millimeter, og/eller symptomer på myelopati (kraftsvekkelse, smerter i bakhodet / parestesier). Kirurgisk stabilisering har vanligvis få komplikasjoner, de fleste oppnår mindre symptomer (Wolfs JF, Kloppenburg M, 2009). Ubehandlet er komplikasjoner assosiert med dødelighet (Riise T, 2001).
RA som er vanskelig å behandle
EULAR-definisjon (Nagy G, 2020)
- Behandling i henhold til European League Against Rheumatism (EULAR) sine anbefalinger og svikt ved ≥ 2 biologiske/målrettede syntetiske DMARDs (med forskjellige virkningsmekanismer)* etter svikt i konvensjonell syntetisk DMARD-behandling (med mindre kontraindisert).†
- Tegn som tyder på aktiv/progressiv sykdom, definert som ≥ 1 av følgende:
- Minst moderat sykdomsaktivitet (i henhold til validerte sammensatte mål, inkludert leddtelling, for eksempel DAS28-ESR>3,2 eller CDAI>10).
- Tegn (inkludert akuttfase-reaktanter og bildediagnostikk) og/eller symptomer som tyder på aktiv sykdom (leddrelatert eller annet).
- Manglende evne til å trappe ned glukokortikoidbehandlingen (under 7,5 mg/dag prednison eller ekvivalent).
- Rapid radiografisk progresjon (med eller uten tegn på aktiv sykdom).‡
- Godt kontrollert sykdom i henhold til ovennevnte standarder, men fortsatt med RA-symptomer som forårsaker redusert livskvalitet.
3. Håndteringen av tegn og/eller symptomer oppfattes som problematisk av revmatologen og/eller pasienten.
Alle tre kriteriene må være til stede ved vanskeligbehandlet RA.
Forklaringer: CDAI: klinisk sykdomsaktivitetsindeks; DAS28-ESR: sykdomsaktivitetsskår som vurderer 28 ledd ved hjelp av SR, DMARD: sykdomsmodulerende antirevmatisk medikament. *Med mindre begrenset av tilgang til behandling på grunn av sosioøkonomiske faktorer. †Hvis konvensjonell syntetisk DMARD-behandling er kontraindisert, er svikt ved ≥ 2 biologiske/målrettede syntetiske DMARDs med forskjellige virkningsmekanismer tilstrekkelig. ‡Rapid radiografisk progresjon: endring i van der Heijde-modifisert Sharp-skår ≥5 poeng på 1 år.
Svangerskap ved revmatoid artritt (RA)
Omtrent 60% av gravide med RA opplever redusert sykdomsaktivitet under svangerskapet (Jethwa H, 2019). Denne positive effekten kan tilskrives immunologiske mekanismer som reduserer inflammasjon under graviditeten, trolig for å øke toleransen for fremmede proteiner, slik som de fra fosteret (Østensen M, 2015).
Normalt forløp for de fleste: De aller fleste svangerskap og fødsler hos kvinner med RA forløper uten komplikasjoner. En norsk studie fant en lett økt risiko for spontanabort sammenlignet med friske kvinner, men ingen økt risiko for dødfødsler (RR 1,2 for tidlig spontanabort, RR 1,4 for sen spontanbart) (Wallenius M, 2015).
Forverring etter fødsel: Etter fødselen opplever dessverre 47% av kvinnene en forverring av RA (Jethwa H, 2019). Årsakene til denne forverringen er ikke fullstendig klarlagt.
Behandlingsbehov under svangerskap
Selv om mange opplever forbedring i svangerskapet, vil mer enn halvparten ha aktiv RA i siste trimester (de Man YA, 2008). For disse kvinnene er det viktig å gi korrekt informasjon om medikamentbruk under svangerskapet.
Medikamenter som ikke skal brukes i svangerskap
- Metotreksat: seponeres 1-3 måneder før unnfangelse.
- Mykofenolat: seponeres 1,5 måneder før unnfangelse
- Cyclofosfamid: seponeres 3 måneder før unnfangelse.
- Selektive COX II hemmere (mangler tilstrekkelig dokumentasjon på sikkerhet)
- NSAIDs (skal ikke brukes i tredje trimester; stoppes etter svangerskapsuke 28)
- Legemidler med utilstrekkelige sikkerhetsdata og som bør unngås til mer bevis er tilgjengelig inkluderer: apremilast, avakopan, baricitinib, bosentan, filgotinib, leflunomid, mepakrin, tofacitinib, upadacitinib og voklosporin.
- Leflunomid: bør seponeres 5 halveringstider (3,5 måneder) før graviditet eller en akselerert legemiddelselimineringsprosedyre (f.eks. kolestyramin) bør utføres.
Medikamenter som kan brukes i svangerskap
- Sulfasalazin: opptil 2 g/dag med tilskudd av folsyre.
- Hydroksyklorokin (Plaquenil) i dose ≤400 mg/d (2 tabl).
- Ciclosporin-A: bør brukes i laveste effektive dose
- Takrolimus: bør brukes i laveste effektive dose
- Azathioprin: opptil 2 mg/kg/dag for kvinner med normal tiopurinmetabolisme (sjekk TPMT i blodet)
- Kolkisin: 1mg til 2 mg/dag.
- Kortikosteroider (prednisolon, metylprednisolon) Prednison og prednisolon: bør trappes ned til en vedlikeholdsdose på ≤5 mg/dag der det er mulig. Høyere doser bør veies mot risikoen for maternell-føtale komplikasjoner.
- NSAIDs bør kun brukes intermittent og stoppes etter uke 28 av svangerskapet. Ikke-selektive NSAIDs med kort halveringstid (f.eks. ibuprofen) foretrekkes. Bør vurderes avsluttet ved vanskeligheter med å bli gravid.
- Immunglobuliner iv (IViG) i utvalgte tilfeller.
- Noen biologiske legemidler kan brukes på strenge indikasjoner:
- Alle TNF-hemmere (som abatacept, anakinra, belimumab, kanakinumab, iksekizumab, rituksimab, sarilumab, sekukinumab, tocilizumab og ustekinumab) kan brukes.
- Certolizumab passerer i placenta i liten grad (mindre enn 10%), noe som gjør at fosteret eksponeres i liten grad.
- Etanercept krysser placenta i 10-30 % som også er relativt gunstige verdier.
- Infliksimab og adalimumab: Oppnår høyere konsentrasjon i fosteret enn hos mor på grunn av aktiv transport over placenta, og bør kun brukes på strengere indikasjon etter første trimester.
- For anifrolumab, ekulizumab, guselkumab, mepolizumab og risankizumab er det svært begrenset eller ingen data om sikker bruk; de bør kun brukes under graviditet hvis ingen annen graviditetskompatibel medisin effektivt kan kontrollere mors sykdom.
- Non-TNFi bDMARDs (som abatacept, anakinra, belimumab, kanakinumab, iksekizumab, rituksimab, sarilumab, sekukinumab, tosilisumab og ustekinumab) kan brukes hvis nødvendig for å effektivt kontrollere mors sykdom. Disse ser ikke ut til å øke frekvensen av uønskede svangerskapsutfall. Bruk av anti-B-cellemidler (rituksimab, belimumab) i andre halvdel av graviditeten kan føre til forbigående B-celleutarming hos nyfødte, men uten alvorlige infeksjoner.
- Alle TNF-hemmere (som abatacept, anakinra, belimumab, kanakinumab, iksekizumab, rituksimab, sarilumab, sekukinumab, tocilizumab og ustekinumab) kan brukes.
Vaksinasjon av spedbarn utsatt for bDMARDs i utero: Ikke-levende vaksiner kan gis til alle spedbarn etter eksponering for bDMARDs under graviditet.
Levende vaksiner. Administrering av levende-svekkede vaksiner i de første 6 månedene etter fødsel er avhengig av tidspunkt for mors eksponering, transplacentar passasje av bDMARD og type vaksine:
- Rotavirusvaksine kan gis i henhold til vanlig vaksinasjonsplan for spedbarn som har vært utsatt for TNFi bDMARDs i utero.
- BCG-vaksine bør utsettes i 6 måneder for spedbarn eksponert for TNFi bDMARDs med transplacentar overføring i andre halvdel av graviditeten.
- Levende vaksiner bør utsettes i 6 måneder for spedbarn utsatt for non-TNFi bDMARDs i andre og tredje trimester på grunn av begrenset data.
Medikamenter som ikke skal brukes ved amming
Følgende legemidler bør unngås hos ammende kvinner, og alternative legemidler bør vurderes: apremilast, avakopan, baricitinib, cyklofosfamid, etoricoxib, filgotinib, iloprost, leflunomid, mykofenolat, tofacitinib, upadacitinib og voklosporin.
- Cyklofosfamid er kjent for å ha forårsaket beinmargsdepresjon hos spedbarn eksponert via morsmelk i sjeldne tilfeller.
- Unngåelse av de andre legemidlene skyldes utilstrekkelige data fremfor direkte bevis for skade på spedbarn.
Medikamenter som kan brukes ved amming
csDMARDs og andre legemidler som er forenlige med amming inkluderer: azatioprin eller merkaptopurin, celekoksib, klorokin, kolkisin, ciklosporin, hydroksyklorokin, IVIG, IV metylprednisolonpulser, ikke-selektive NSAIDs (f.eks. ibuprofen), prednison og prednisolon, sulfasalazin og takrolimus.
- For IV metylprednisolonpulser kan det å utsette ammingen i 2 til 4 timer etter dosen begrense barnets eksponering.
- Ibuprofen foretrekkes på grunn av svært lav utskillelse i morsmelk.
Alle bDMARDs (både TNFi og non-TNFi) anses nå som kompatible med amming. Dette skyldes minimal overføring til morsmelk og begrenset systemisk absorpsjon av barnet, da de er store proteinbaserte molekyler med ubetydelig oral biotilgjengelighet.
Mindre sikre medikamenter. Legemidler med begrenset eller ingen data, men svært lave nivåer i morsmelk og ingen tegn på skade hos spedbarn: bosentan, sildenafil og metotreksat ≤25 mg ukentlig kan vurderes hvis ingen alternative legemidler er tilgjengelige.
Mer informasjon
For mer informasjon om svangerskap og revmatisk sykdom, se eget kapittel og nettsidene til Nasjonalt kompetansesenter for svangerskap og revmatiske sykdommer (NKSR).
Prognose
Med effektiv behandling oppnår 75-80 % av pasientene med revmatoid artritt (RA) lav sykdomsaktivitet eller remisjon. Dette betyr at de fleste kan fortsette å delta i normale sosiale aktiviteter og arbeid (Burmeister GR, 2017). Imidlertid opplever en mindre del av pasientene et alvorlig sykdomsforløp, noe som understreker behovet for fortsatt forskning og utvikling av nye behandlingsalternativer. Remisjonen vedvarer så lenge behandlingen med DMARDs varer hos de fleste, mens vedvarende remisjon uten DMARDs kan oppnås hos ca 25% (Kjørholt KE, 2024; Kedra J, 2024).
Faktorer som påvirker prognosen
Det er utfordrende å forutsi det individuelle sykdomsforløpet ved RA, men flere faktorer kan gi en indikasjon på prognosen:
- Vedvarende høy sykdomsaktivitet: Pasienter med kontinuerlig høy sykdomsaktivitet har ofte dårligere prognose enn de som oppnår remisjon eller lav sykdomsaktivitet.
- Antall affiserte ledd: Pasienter med mange affiserte ledd ved sykdomsstart har ofte et mer aggressivt sykdomsforløp.
- Tidlig utvikling av erosjoner: Tidlig utvikling av leddskade på røntgen (erosjoner) er assosiert med dårligere prognose.
- Ekstraartikulære manifestasjoner: Forekomst av symptomer utenfor leddene, som for eksempel revmatoid lungesykdom eller vaskulitt, kan indikere et mer alvorlig sykdomsforløp.
- Høye nivåer av serum IgA RF og anti-CCP: Disse antistoffene er assosiert med økt risiko for leddskade og ekstraartikulære manifestasjoner.
- Høy alder: Eldre pasienter har ofte raskere funksjonstap, selv om leddødeleggelsen ikke nødvendigvis er mer uttalt enn hos yngre pasienter.
- Andre faktorer: Høyt antall hovne ledd, tidlige erosjoner, dårlig behandlingsrespons på to eller flere DMARDs, RA-vaskulitt og røyking er også forbundet med dårligere prognose.
Dødelighet
Dødeligheten er noe høyere hos pasienter med RA sammenlignet med normalbefolkningen (Standard Mortalitets Ratio, SMR 1,5-2). Dette skyldes hovedsakelig økt risiko for kardiovaskulære sykdommer, infeksjoner og i noen grad lymfom (Naz, SM, 2007). Tidligere studier har påvist en to ganger økt risiko for hjerteinfarkt hos RA-pasienter. Denne kardiovaskulære risikofaktoren er sammenlignbar med diabetes mellitus (van Halm VP, 2009). Denne risikoen ser ut til å være redusert de siste årene takket være mer effektiv behandling og økt fokus på forebygging av hjerte- og karsykdom.
Bedre prognose med moderne behandling
Moderne behandling med DMARDs og biologiske legemidler har ført til betydelig bedring i prognosen for RA-pasienter. Studier har vist at 5-års overlevelse etter år 2000 er blitt lik den i normalbefolkningen (Laicaille C, Ann Rheum Dis 2017). Dette skyldes sannsynligvis bedre kontroll av sykdomsaktivitet, redusert leddskade og forebygging av komplikasjoner.
Retningslinjer, anbefalinger og prosedyrer
EULAR anbefalinger (alle)
Her et et lite utvalg for RA:
- Behandling med DMARDS, EULAR: (Smolen JS, Ann Rheum Dis 2023)
- ACR/EULAR kriterier for remisjon (revidert), 2022 (Studenic P, 2022)
- EULAR definisjon av “difficult-to-treat RA” (Nagy G, 2020)
- Tidlig artritt EULAR: Combe B, 2016
- Kardiovaskulær risiko EULAR; Agcar, 2016
- Sykepleier-anbefalinger EULAR; Bech B, 2019
- Fysisk aktivitet EULAR: Rauch Osthoff, 2018
- EULAR points to consider for the use of antirheumatic drugs in reproduction, pregnancy and lactation; update 2024 (Förger F, 2024)
- ACR/EULAR klassifikasjonskriterier/ Aleta D, 2010)
Norsk Revmatologisk Forening / Legeforeningen
Litteratur
Smolen JS, 2023 (EULAR anbefalinger om behandling og oppfølging)
Kerschbaumer A, 2020 (behandling)
