BASISKOMPETANSE (REV 001-005)
3 Immunsystemets oppbygging og funksjon, immunologi. Autoimmune sykdommer, autoimmunitet og inflammasjon (REV 003)
Immunsystemet oppbygning
Jan Tore Gran and Øyvind Palm
Læringsmål REV 003. Revmatologen skal ha god kunnskap om immunsystemets oppbygning og funksjon, herunder osteoimmunologi, mekanismer for toleranse og autoimmunitet.
Immunologi er ofte grunnlaget for å forstå, diagnostisere og behandle revmatiske sykdommer. Revmatologer med solid kunnskap om immunologi er bedre rustet til å gi optimal behandling og omsorg til sine pasienter.
Immunsystemet; basale konsepter
Immunsystemet har som oppgave å beskytte oss mot infeksjoner forårsaket av invaderende mikrobielle agens (bakterier, virus, sopp og protozoer). Disse agens kalles antigener når de kan gjenkjennes av immunsystemet. Et velfungerende immunsystem er avhengig av et komplisert samspill mellom mange ulike celler og proteiner. Når immunsystemet i å bekjempe inntrengerne, sier vi at vi har overvunnet infeksjonen. Et velfungerende immunsystem styres av ulike typer leukocytter. Disse stammer fra to umodne forløpere (progenitorceller) i benmargen:
- Myeloide progenitor celler som gir opphav til cellene i det innate immunsystemet (se nedenfor); nøytrofile granulocytter, eosinofile, mastceller, makrofager, NK-celler og dendrittiske celler. Disse utløser den hurtige immunresponsen via det innate immunsystemet. Dette spiller en viktig patogenetisk rolle ved de autoinflammatoriske (feber-) syndromene og ved systemisk juvenil artritt.
- Lymfoide progenitor celler som igjen utløper fra hematopoetiske stamceller. De lymfoide (lymfocyttene) gir opphav til B- og T-cellene i det adaptive/ervervede immunsystemet (se nedenfor). Disse cellene utgjør den senere fasen i en immunreaksjon.
Immunsystemet har en viktig funksjon i å beskytte kroppen mot fremmede inntrengere, som bakterier og virus. Samtidig må immunsystemet tolerere kroppens egne proteiner, for å unngå å angripe friskt vev. Denne toleransen kalles immuntoleranse eller egentoleranse. Når immuntoleransen bryter sammen blir likevekten mellom egentoleranse og autoaggresjon forstyrret, immunsystemet kan ved en feil aktiveres og angripe vårt eget vev. Dermed oppstår autoimmune sykdommer (snl.no).
Kryssreaktive autoantigener. I noen tilfeller kan immunsystemet reagere på proteiner som ligner på kroppens egne proteiner. Dette kan føre til at immunsystemet angriper friskt vev i flere organer, noe som forklarer hvorfor mange autoimmune sykdommer rammer flere organsystemer (Yatim KM, 2015).
Nobelprisvinneren Paul Ehrlich beskrev autoimmunitet som “horror autotoxicus”, som betyr “selvforgiftningens gru”. Dette uttrykket illustrerer de alvorlige konsekvensene av ubehandlet autoimmun sykdom.
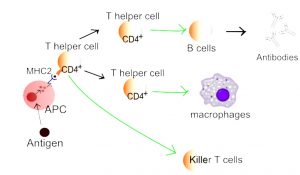
- De fleste immunreaksjoner starter med at et antigen (fremmed protein eller kroppens eget protein ved autoimmun sykdom) blir bearbeidet antigen-presenterende celler (APC). Disse cellene presenterer antigenet for T-celler, som deretter kan reagere på antigenet (figuren ovenfor). Først da kan T-cellene reagere på antigenet. De viktigste APC-ene er dendrittiske celler og makrofager. I noen tilfeller kan også B-celler fungere som APC (snl.no). En forutsetning for at en autoimmun reaksjon skal oppstå, er en nedsatt evne til å tolerere egne proteiner og vev (nedsatt selv-toleranse).
Den innate og den adaptive delen av immunsystemet
Immunsystemets reaksjon mot et invaderende agens kan inndeles i to ulike, men overlappende faser.
Fase I utløses av det medfødte, uspesifikke forsvaret, mens fase II involverer det ervervede, spesifikke forsvaret. Til det medfødte immunsystemet regnes også beskyttende barrierer som hud, flimmerhår, slim, magesyre, gallesyre og fordøyelsesenzymer.
Fase I: Det innate/medfødte immunsystemet (Janeway Jr, TR, 2002)
- Uspesifikt forsvar: Dette er den første, hurtige fasen og er den samme uansett hvilket agens som invaderer kroppen.
- Beskyttende barrierer: Hud, flimmerhår, slim, magesyre, gallesyre og fordøyelsesenzymer er alle en del av det medfødte immunsystemet.
- Aktivering: Aktiveres av et lite antall konserverte mikrobiologiske strukturer.
- Uendret respons: Reagerer på samme måte hver gang det eksponeres for et agens.
Fase II: Det adaptive immunsystemet
- Spesifikt forsvar: Denne fasen er mer kompleks og gjenkjenner og angriper spesifikt agens.
- Hukommelse: Danner hukommelsesceller som gjør at immunsystemet reagerer raskere og mer effektivt ved neste eksponering for samme agens.
- Effektivitet: Tar 7-10 dager å bli fullt aktiv, men gir en kraftigere og mer målrettet respons.
Forskjeller mellom de to fasene:
- Spesifisitet: Det adaptive immunsystemet er mer spesifikt og gjenkjenner en distinkt del av et agens.
- Hukommelse: Det adaptive immunsystemet danner hukommelsesceller som gir raskere og mer effektiv respons ved neste eksponering.
- Effektivitet: Det adaptive immunsystemet tar lengre tid å bli aktivt, men gir en kraftigere respons.
| Tabell. Man kan dele en del sykdommer inn etter om de hovedsakelig aktiveres av det innate immunsystemet (autoinflammatorisk) eller det adaptive immunsystemet (autoimmune sykdommer) (Shimuzu J, 2023). | |
| Familiær middelhavsfeber (FMF), TRAPS | Autoinflammatoriske. Sjeldne monogene sykdommer/febersyndromer |
| Crohns sykdom (CD), ulcerøs kolitt (UC) | Autoinflammatoriske polygenetiske sykdommer |
| Behcets sykdom, ankyloserende spondylitt/Bekhterevs | Blandet autoinflammatorisk og autoimmunt mønster |
| Revmatoid artritt, systemisk lupus (SLE) | Klassiske autoimmune sykdommer |
| Autoimmunt lymfoproliferativt syndrom (ALPS), immun dysregulert, polyendokrinopati enteropati, X-bundet syndrom (IPEX) | Autoimmune, sjeldne monogene sykdommer |
Hvordan dannes en immunrespons?
For at immunforsvaret skal reagere på et antigen, må antigenet først passere kroppens fysiske barrierer. For eksempel må en tarmpatogen bakterie passere magesyre, slim og tarmens epitel før den møter immunsystemets celler.
De første cellene som møter antigenet er innate celler, ofte makrofager og dendrittiske celler. Disse cellene har reseptorer (toll-like reseptorer, TLR) som gjenkjenner strukturelle komponenter i bakterier og virus. Når TLR binder seg til bakterien, aktiveres cellen. Den aktiverte cellen tar opp og bryter ned bakterien og produserer cytokiner som tiltrekker seg andre leukocytter og starter en lokal inflammasjon.
Dendrittiske celler presenterer antigenet til T-celler: Etter aktivering av bakterien gjør den dendrittiske cellen to ting:
- Den viser fram peptider fra bakterien bundet til HLA klasse II molekyler på celleoverflaten.
- Den beveger seg via lymfesystemet til nærmeste lymfeknute.
I lymfeknuten møter den en naiv T-celle som gjenkjenner komplekset av HLA klasse II og bakteriepeptid. Denne T-cellen aktiveres og deler seg i mange nye celler. Noen av de nye T-cellene blir til hukommelses T-celler, mens de fleste blir effektor celler som beveger seg tilbake til den betente tarmslimhinnen. Der kan de reaktiveres av bakterie-epitopen. De aktiverte T-cellene produserer cytokiner som aktiverer B-celler, dendrittiske celler, endotelceller og flere.
T-celletyper: Aktiverte T-celler grupperes ofte etter hvilke cytokiner de produserer:
- Th-1 celler: Produserer betennelsesfremmende cytokiner (interferon).
- Th2 celler: Produserer B-celle hjelpende cytokiner (interleukin-4).
- Regulatoriske T-celler: Demper og kontrollerer immunresponsen (produserer IL-10 og TGF-β)(Burzyn D, 2013).
B-celler produserer antistoffer: I lymfeknuten finnes det også spesialiserte dendrittiske celler som viser fram hele proteiner fra bakterien til naive B-celler. Noen av disse B-cellene blir til hukommelses B-celler, mens andre, med hjelp fra T-celler, blir til plasmaceller som produserer antistoff rettet mot bakterien. Ved den primære immunresponsen er antistoffene av typen IgM.
Hukommelsesrespons: Ved fornyet eksponering for et antigen aktiveres hukommelses B-celler. Avhengig av miljøet og T-cellene, kan det dannes antistoffer av typen IgG, IgA eller IgE. Alle isotypene kan binde og nøytralisere antigen, men de har ulike virkningsmekanismer. For eksempel kan subtyper av IgG aktivere komplementsystemet, mens IgE kan bindes til mastceller og aktivere dem.
Immunregulering
Det spesifikke immunsystemet er basert på gjenkjennelse av proteiner. For å unngå at immunsystemet angriper kroppens egne proteiner, er det av avgjørende betydning at det finnes mekanismer for å hindre dette (Long A, 2023).
-Sentral toleranse: Den viktigste mekanismen er å fjerne T-celler som gjenkjenner peptider fra kroppens egne proteiner (autoreaktive T-celler). Denne prosessen, kalt negativ seleksjon, skjer under T-celle modningen i thymus (Sprent J, 2005).
-Perifer toleranse: Kontrollen i thymus er ikke perfekt, og noen autoreaktive T-celler dannes. Det er derfor nødvendig med ytterligere mekanismer for å holde disse cellene i sjakk. Dette kalles perifer toleranse, og mekanismene er ikke fullt ut forstått, men involverer trolig regulatoriske T-celler.
-Kontroll av B-celler: Kontrollen av autoreaktive B-celler er mindre streng enn for T-celler. Dette skyldes at autoreaktive B-celler er ufarlige så lenge de ikke får hjelp fra T-celler til å bli plasmaceller som produserer autoantistoffer.
Autoantistoffer kan noen ganger dannes hos friske personer, for eksempel ved infeksjoner, vevsskader eller iskemi (Long A, 2023; Kono H, 2008).
Autoimmune sykdommer: Flere revmatologiske sykdommer er karakterisert ved:
- T-celle infiltrasjon i affiserte organer
- Forekomst av autoantistoffer
- Mangel på kjent, utløsende miljøfaktor
Denne gruppen av sykdommer (inkludert revmatoid artritt, ankyloserende spondylitt/Bekhterevs/AxSpA, alle systemiske bindevevssykdommer og vaskulittene og flere andre) omtales ofte som autoimmune sykdommer.
Komponenter i immunsystemet
Det innate immunsystemet består av hud, magesyre, enzymer i tårevæske, fuktighet i huden og slimhinner, men også komplementsystemet. Sammen med andre kjemiske deler som interferon og interleukin-1 (IL-1) kan svært sterke immunreaksjoner utløses.
Det ervervede, adaptive immunsystemet består av en rekke celler og organer.
-Leukocytter (hvite blodlegemer) er en del av det adaptive immunsystemet og identifiserer og eliminerer antigen. Leukocytter omfatter makrofager som sammen med neutrofile- og dendrittiske celler kan fagocytere antigen.
–Makrofager utvikler seg fra monocytter og gjenfinnes i nærmest alt vev. Det finnes flere forskjellige sub-typer med ulike spesialiserte funksjoner. Makrofagene kan produsere cytokiner og er av betydning i det inate immunsystemet, men har også andre viktige funksjoner. I det adaptive immunsystemet presenterer de antigen (sammen med dendrittiske celler) for T-celler slik at antistoffer kan dannes.
–Mastceller, eosinofile og basofile leukocytter har også spesielle oppgaver. Lymfocyttene er beskrevet nedenfor. Illustrasjon: Blausen Medical via Wikimedia / CC BY 3.0
–Lymfocytter er også undergrupper av leukocytter. De to typene lymfocytter, B-celler og T-celler, er viktige deler av immunsystemet. I likhet med andre blodceller utvikles de fra stamceller i benmargen. B-cellene og T-cellene gjennomgår en seleksjons og modningsprosess før de kommer ut i sirkulasjon som naive celler. B-cellene selekteres og modnes i benmargen, mens T-cellene selekteres og modnes i tymus. Benmarg og tymus omtales derfor som primære lymfoide organ.
B-celler. Når B-celler kommer i kontakt med et antigen (eksternt agens eller egne proteiner ved autoimmun sykdom), modnes de til plasmaceller som produserer antistoffer og immunglobuliner (se nedenfor). Disse skal angripe bakterier og toksiner. Antistoff er spesifikke slik at de reagerer med ett bestemt antigen. Ved en del revmatiske sykdommer (RA, SLE, Sjøgrens, MCTD, myositt, Systemisk sklerose og ANCA-vaskulitt) påvises karakteristiske antistoff uten at sykdomsmekanismene er eksakt klarlagt. På B-cellenes overflate sitter ulike reseptorer (CD19, CD20, CD22, BAFFR og andre) som er viktige i inflammasjonsprosessen og dermed målrettet behandling (Wu F, 2021).
T-celler har en regulerende, koordinerende funksjon i immunsystemet. De samarbeider med B-cellene og kan destruere infiserte celler og kreft-celler. Killer-T-celler (Natural Killer-cells= NK-celler) er en subgruppe som dreper infiserte og skadede celler. Hjelpe-T-celler (hjelper-celler) bidrar til å bestemme immunresponsen mot spesifikke antigen. Hjelpe-T-cellene har CD4 reseptorer på overflaten og kalles også CD4+ T-celler. Andre overflatestrukturer er T-cellereseptorer, cytokinreseptorer og interferon-alfa reseptor. Ved de autoimmune revmatiske sykdommene rettes viktig immunsuppressiv behandling mot overaktive B- og T-celler og deres reseptorer (Sun L, 2023).
Benmargen produserer leukocytter (se mer nedenfor) og stamceller som begge er essensielle deler av immunsystemet.
Thymus. I thymus modnes T-celler slik at organet kan stimulere eller vedlikeholde produksjon av antistoff. Ved myastenia gravis produserer thymus patogene antistoff mot acetylkolin reseptorer i nervene.
Lymfoide organer
Immunsystemet vårt er organisert i lymfoide organer, som kan deles inn i to hovedtyper:
Primære lymfoide organer:
- Benmarg: Her produseres alle typer blodceller, inkludert lymfocytter.
- Thymus: Her modnes T-celler og får sin funksjonelle identitet.
Sekundære lymfoide organer:
- Milt: Filtrerer blodet og fjerner gamle blodceller og patogener.
- Lymfeknuter: Fanger opp og filtrerer lymfevæske for patogener.
- Mucosa-assosiert lymfatisk vev (MALT): Beskytter slimhinner i luftveiene, mage-tarmkanalen og andre steder. MALT inkluderer tonsiller, adenoider, appendiks og Peyerske plakk i tynntarmen.
-Funksjon: De sekundære lymfoide organene har en viktig funksjon i å samordne og koordinere adaptive immunresponser og sikre effektiv dannelse av hukommelsesceller mot patogener.
Immunglobuliner
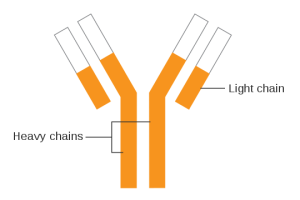
Immunglobuliner, også kalt antistoffer, er proteiner laget av B-celler i immunsystemet. De spiller en viktig rolle i det adaptive eller ervervede immunforsvaret. Immunglobuliner brukes også til behandling av enkelte revmatiske sykdommer. Her er det viktigste å huske om immunglobuliner:
- Gjenkjenner og nøytraliserer inntrengere: Immunglobuliner kan feste seg til spesifikke molekyler på overflaten av virus, bakterier eller andre inntrengere. Dette hjelper immunsystemet med å gjenkjenne og fjerne dem.
- Hukommelse: Når kroppen har blitt utsatt for et inntrengende agens tidligere, kan B-cellene lage hukommelsesceller som produserer immunglobuliner spesifikt mot dette agens ved senere eksponeringer. Dette gir en raskere og mer effektiv immunrespons.
- Flere typer: Det finnes fem hovedtyper av immunglobuliner, hver med litt forskjellige egenskaper og funksjoner: IgM, IgG, IgA, IgE og IgD, hvorav IgM, IgG, IgE og IgA er av størst betydning i revmatologi.
-IgM er den første typen som produseres ved en infeksjon. De dannes før IgG ved antigen-stimulering. Fertile kvinner har noe høyere IgM. Ved høy IgM skiller en polyklonal, oligoklonal og monoklonal økning. Poly- eller oligoklonal høy IgM ses ved leversykdommer, infeksjoner (tidlig respons) og autoimmune sykdommer. Monoklonal økning gir mistanke om makroglobulinemi (Waldenstöms), AA amyloidose og MUGS (monoklonal udefinert gammopati av usikker signifikans). Lav IgM ses ved primær og sekundær immunsvikt.
-IgG er det viktigste og vanligste immunglobulinet i beskyttelse mot infeksjoner. Det utgjør 75-80% av de sirkulerende immunglobulinene og har en halveringstid på 23 døgn. IgG dannes senere i sykdomsforløpet enn IgM ved infeksjoner. IgG kan i svangerskap passere placenta. Mange TNF-hemmere (biologiske legemidler) som brukes mot revmatoid artritt og andre revmatiske sykdommer, består av IgG, noe som er av betydning ved behandling i svangerskap. IgG er ofte polyklonalt forhøyet ved Sjøgrens sykdom. IgG inndeles i subklasser IgG1, IgG2, IgG3, IgG4 med flere som har ulike funksjoner (Salmon JE, 2001). Ved IgG4 relaterte sykdommer er IgG4 ofte forhøyet i serum eller i vevet. Behandling med det biologiske legemiddelet rituksimab (mot revmatoid artritt, ANCA-vaskulitt som GPA, MPA, EGPA og andre) kan redusere IgG og øke infeksjonsrisiko. Monoklonal IgG ses i serum-elektroforese ved MUGS (se nedenfor) og myelomatose.
-IgE øker ved allergiske reaksjoner, parasitt-sykdommer og enkelte revmatiske sykdommer slik som EGPA (eosinofil granulomatose med polyangiitt / Churg-Strauss vaskulitt og eosinofil fasciitt).
-IgA finnes i slimhinner og kroppsvæsker som spytt og tårer, der den beskytter mot mikroorganismer. IgA avleires i nyrene ved IgA nefritt og i blodårer ved IgA-vaskulitt (Henoch-Scönleins purpura). IgA mangel ses hos 0,3% av befolkningen og disponerer blant annet for alvorlig forløp av systemisk lupus (SLE).
-IgD: Funksjon ukjent, finnes i små mengder i blodet.
Paraproteiner, monoklonale komponenter og MUGS. Hos 2% av alle personer over 50 års alder påvises monoklonal gammopati. De fleste tilfellene er ikke assosiert med sykdomstegn og er av usikker betydning (Monoclonal gammopathy of undetermined significance = MUGS) (Ørstavik R, 2002). Ved MUGS er mengden paraprotein mindre enn 30g/L, og plasmacellene utgjør mindre enn 10% ved undersøkelse av benmargen. Man påviser ikke relaterte skader i skjelettet, for høyt kalsium i blod, anemi, trombocytopeni eller redusert nyrefunksjon, og det er ikke tegn til annen B-celle proliferativ sykdom/lymfom. Ofte anbefales å gjenta blodprøve med protein elektroforese årlig. Dersom mengden monoklonalt protein øker, anbefales henvisning til spesialist i blodsykdommer (hematolog).
Autoimmunitet, antistoff og antigen
Autoimmune sykdommer angriper 3-5% av verdens befolkning og omtrent 80% er kvinner. Man har til nå kartlagt ca. 100 ulike spesifikke autoimmune sykdommer. Noen av sykdommene angriper bare ett organ (for eksempel primær biliær cholangitt, psoriasis, cøliaki, thyreoiditt og multiple sklerose (MS)), mens andre er multiorgansykdommer, slik som systemisk lupus erythematosus (SLE) og revmatoid artritt (RA). Sykdomsårsaken er ikke godt kartlagt, men en konkordans på 12-67% blant eneggede tvillinger tyder på at både genetikk og miljøfaktorer er avgjørende (Wang L, 2015). Autoimmune sykdommer kjennetegnes immunologisk ved at kroppens eget immunsystem er for aktivt og ved en feil angriper kroppen selv (autoimmunitet). I den prosessen dannes revmatisk betennelse (inflammasjon) som skilles fra infeksjon ved at det ikke er bakterier, virus, parasitter, sopp eller andre mikrober til stede. I noen tilfeller viser blodprøver tegn på betennelse med forhøyet CRP (C-reaktivt protein) og høy SR (senkningsreaksjon). Ved mange autoimmune sykdommer reagerer immunsystemet med å danne spesielle proteiner, såkalte antistoff.
Polyautoimmunitet foreligger når flere autoimmune sykdommer koeksisterer i samme pasient. Oftest er autoimmun thyreoiditt en av disse tilstandene (Bliddal S, 2017).
Autoimmunt syndrom. Ved tre eller flere slike autoimmune sykdommer snakker vi om multippelt autoimmunt syndrom. Årsakene er felles genetisk disposisjon innen HLA-klasse II og klasse I og XX-kromosom (kvinner), men også miljøfaktorer som røking og mikrobiota. De vanligste polyautoimmune sykdommer er autoimmun thyreoiditt og Sjøgrens syndrom (Roja-Villarraga A, 2012). Også uten antistoff (seronegative) forekommer overhyppighet av ulike sykdommer hos samme pasient. Eksempler er Bekhterevs/ankyloserende spondylitt, inflammatorisk tarmsykdom (IBD), psoriasis og psoriasisartritt (David T, 2018).
Antigen kan defineres som “alt” som kan stimulere produksjonen av antistoff.
Antistoff er veldig spesifikke, naturlig utviklede immunglobuliner som binder seg til antigen eller patologiske celler for å fjerne sykdom. Mange autoimmune sykdommer kjennetegnes ved mer eller mindre spesifikke antistoff som kan måles i blod og andre kroppsvæsker. Eksempler er anti-DNA (SLE), anti-CCP (RA), anti-gluten (cøliaki) og anti TPO eller TRAS (thyreoiditt). Andre tilstander er uten kjente antistoff (psoriasis, inflammatoriske tarmsykdommer, Bekhterevs/ankyloserende spondylitt). Biologiske legemidler er monoklonale antistoff (mAbs) er enkelt-molekylære strukturer som er aktive mot et enkelt antigen-mål.
Inflammasjon
Definisjon. Inflammasjon er en reaksjon fra organismens side overfor enhver vevsskade. Den har som hovedoppgave å begrense skaden, samt å sørge for reparasjon. Komplementsystemet og prostaglandiner er viktige mediatorer i inflammasjonsprosessen. Ved autoimmune revmatiske sykdommer aktiveres inflammasjonsprosessen ved en feil og vev- og organskader kan oppstå (Long A, 2023). Hensikten med immunsuppressiva medikamenter (kortikosteroider, DMARDs, JAK-hemmere, biologiske legemidler) er da å hemme inflammasjonsprosessen.
Akutt inflammasjon. Skade eller sykdom kan nesten umiddelbart utløse en akutt, kortvarig inflammasjon. Smerte, rødhet, redusert funksjon, hevelse og økt varme er klassiske symptomer, men kan være mer eller mindre fraværende (“silent inflammation”). Utmattelse, feber og kvalme kan også foreligge. Akutt inflammasjon varer få dager, subakutt inflammasjon 2-6 uker. Immundempende medikamenter, inklusiv biologiske legemidler og kortikosteroider, reduserer symptomene, noe som initialt kan vanskeliggjøre diagnostikken.
Akutt fase reaksjon. Inflammasjonen forårsaker er rekke endringer av plasmaproteinene som kalles akutt fase reaksjonen, slik en kan se ved serum-elektroforese. De fleste akutt fase proteiner produseres av hepatocytter som stimuleres hovedsakelig av Interleukin-1 (IL-1) og IL-6 og har en rekke biologiske funksjoner slik som koagulasjon, fibrinolyse, fagocytose m.m. Følgende substanser øker ved en betennelsesreaksjon: CRP, serum amyloid protein A, fibrinogen, haptoglobin, C3 og gammaglobulin. Albumin og transferrin synker.
Inflammatorisk reaksjon kan deles inn i tre faser
- Vaskulær reaksjon
- Eksudativ eller cellulær fase
- Proliferativ (reparasjon) fase
Vaskulær reaksjon. Straks etter skaden eller tilsynekomst av et fremmed agens frigir mastceller og makrofager (det inate immunsystemet) kjemiske substanser som histamin, TNF og IL-1, IL-6). Disse stimulerer utvidelse av først venuler, deretter arterioler. Samtidig nedsettes gjennomblødningen i skadestedet med følge at blodvæske (plasma) siver ut i det skadede stedet.
Eksudativ eller cellulær fase. Neste skritt er en opphopning av leukocytter på skadestedet. Adhesjonsmolekyler på endotel i blodkar stimuleres slik at neutrofile granulocytter og monocytter fra blodet lettere kan passere gjennom blodåreveggen og infiltrere vevet. Monocyttene i vevet modner til makrofager som sammen med monocyttene fagocyterer og eliminere agens. Også plasmaproteiner som komplement og fibrinogen infiltrerer vevet og angriper patogene agens.
Proliferativ eller reparativ reaksjon. Reparasjonsprosessen skjer ved hjelp av celler som kan nydanne visse strukturer. Angioblaster vil for eksempel kunne danne nye blodkar, mens fibroblaster danner selve grunnsubstansen i arret. (Vaskulogenese – dannelse av kar fra progenitor-celler, Angiogenese – dannelse av kar fra preeksisterende kar “knoppskyting”).
Kronisk inflammasjon.Når immunsystemet ikke reparerer akutt inflammasjon, utvikles kronisk inflammasjon som kan vare i måneder og år. Årsaker kan være autoimmune revmatiske sykdommer (artritt-sykdommer, bindevevssykdommer, vaskulitt, autoinflammatoriske sykdommer) eller vedvarende sensitivitet for eksterne utløsere som fremmedlegemer og medikamenter.
Cytokiner og Interleukiner
Cytokiner er signalmolekyler i form av proteiner som kan være pro-inflammatoriske eller hemme inflammasjonen (anti-inflammatoriske).
-Proinflammatoriske cytokiner er viktige mediatorer i det inate immunsystemet. De produseres bl.a. av T-hjelper-celler, makrofager og dendrittiske celler og omfatter interleukin-1 (IL-1), IL-6, IL-12, IL-15, IL-17, IL-18, IL-23, TNF-alfa, interferon gamma og granulocytt-makrofag koloni stimulerende faktor (GM-CSF) (Liu S, 2022). Dersom det inate immunsystemet ikke fjerner stimulerende agens, øker inflammasjonen ved utskillelse av proinflammatoriske cytokiner, og det spesifikke, adaptive immunsystemet aktiveres. Dendrittiske celler (inate immunsystem) kan aktivere naive T-celler (adaptive immunsystem) via binding på T-celle-reseptorer og gjennom kostimulerende signaler. En kortvarig og hensiktsmessig inflammasjon etterlater ofte et arr, men ellers blir prosessen avsluttet.
-Anti-inflammatoriske cytokiner som IL-10, TGF-beta og IL-4 utskilles av ulike celler. Hemming av pro-inflammatoriske cytokiner er viktige mekanismer i behandling av inflammatoriske revmatiske sykdommer (Liu S, 2022).
En kronisk betennelse er prinsipielt av to typer. Ved den ene typen oppstår en feil i prosessen underveis, og reaksjonen tar uhensiktsmessig lang tid. Den andre typen er kronisk fra starten av, og det er denne typen vi ser ved de revmatiske sykdommene. Kronisk inflammasjon kjennetegnes ved et betydelig engasjement av celler og relativt lite opphopning av vevsvæske. Dessuten sees samtidig destruksjon og reparasjon.
Komplementsystemet
Komplementsystemet er i evolusjonen en av de eldste delene av det innate immunsystemet og er essensielt i eliminering av patogene agens, men uhensiktsmessig aktivering blant annet ved autoimmune sykdommer kan medføre alvorlige skader på vev og organer. Ved aktivering av komplementsystemet blir en serie plasmaproteiner aktivert og inngår i komplekser med hverandre. Under serie-reaksjonen dannes stadig mediatorer som hver for seg har spesifikke funksjoner. Komplement C4b vil for eksempel virke virusnøytraliserende, mens C8 og C9 har cytolytiske effekter.
-Den klassiske aktiveringsveien starter med at C1q reagerer med et antigen-antistoff kompleks. Så følger de andre komplement-faktorene på rad og rekke.
-Den alternative aktiveringsveien består av at C3 aktiveres direkte også lektin- og alternativ aktiveringsveiene ender via C3 og C5 med sluttproduktene som måles med TCC (Terminalt Complement Complex).
At komplementsystemet er aktivert, kan også måles med bestemmelse av komplement-aktiveringsprodukt, og mer direkte ved å bestemme serumkonsentrasjonene av C3 og C4 som forventes lave når komplement forbrukes.
- Vedvarende aktivering av komplementsystemet er kjennetegn ved mange inflammatoriske revmatiske sykdommer, slik som systemisk lupus erythematosus (SLE), katastrofalt antifosfolipid syndrom (CAPS), revmatoid artritt (RA) og vaskulitt.
Ved SLE er komplement på den ene siden en viktig patogenetisk del av inflammasjons-kaskaden. For det andre forekommer kjente genetiske defekter for deler av komplement-systemet (C1q mangel) som disponerer for (alvorlig) SLE. Spesielt ved SLE påvises nedslag av komplement i nyrer, hud og annet affisert vev. Måling av komplement C3 og C4 kan være nyttig i vurderingen av sykdomsaktivitet.
Behandlingsmessig har pasienter med C1q mangel vist god effekt av det biologiske legemiddelet eculizumab som hemmer komplement C5 (Pickering MC, 2015; Coppo R, 2015). Mot ANCA-vaskulitt har utprøving av avacopan som hemmer C5a reseptor vist lovede resultater (Jayne D, 2019).
Apoptose
Definisjon. Ordet kommer fra gresk og karakteriserer kronbladenes fall fra blomsten. En aktiv prosess som fører til organisert ødeleggelse av cellen (programmert celledød). Dette er i utgangspunktet en normal prosess og dermed et viktig ledd i balansen mellom celleproliferasjon og celledød. En antar at 90 av cellene dør i apoptose, mens resten dør av nekrose (celleskade). Til forskjell fra nekrose skjer det ved apoptose lite utslipp av intracellulært materiale, og prosessen ledsages ikke av inflammasjon. Tvert imot, apoptoptiske celler frigjør anti-inflammatoriske metabolitter (via panneksin 1-kanaler) (Medina CB, 2020).
Patogenese. Apoptose i en celle induseres ofte ved at Fas (“døds-reseptor”) på overflaten av cellen bindes til sin ligand Fas (FasL). Bindingen mellom Fas og FasL fører til aktivering av flere intracellulære signalveier, bl.a. en som involverer aktivering av ulike kaspaser. Kaspasene aktiverer endonukleaser (DNAser) og stimulerer til endringer av celleoverflaten. Kaspasene påvirkes av celledød-faktorer, fravær av overlevelses-faktorer, celleskade og skade på DNA. Ved ikke-reparativ skade av DNA vil p53 (genomets vokter) indusere dannelse av heterodimeren bcl-bax med apoptose av cellen til følge. BcI2 som er lokalisert til mitokondriemembranen, hemmer kaspasene og beskytter dermed mot apoptose. IL-1, TGF-beta og alfa- hemmer også apoptose. Fas-antigenet er et overflateprotein som tilhører TNF familien og er viktig for destruksjon av aktiverte T-Iymfocytter.
Ved SLE er det påvist økte mengder apoptotiske celler i perifert blod. Dette er sannsynligvis et tegn på nedsatt evne til å fjerne slike celler. Hvis slike celler med tiden isteden destrueres ukontrollert, kan intracellulære antigener frigis. Mot slike antigener er det ikke utviklet immunologisk toleranse. På denne måten kan autoimmunitet induseres.
NETs (Neutrophil Extracellular Traps)

Definisjon. NETs er viktige når neutrofile leukocytter dreper bakterier. NETS består av store garn-lignende strukturer som blant annet inneholder myeloperoksydase (MPO) og proteinase 3 (PR3) (jfr. ANCA-vaskulitt der antistoffer mot disse proteinene er sentrale i patogenesen).
Patogenese. NETs brer seg ut i det ekstracellulære rom. Studier viser at NETs også er av betydning for utviklingen av autoimmune sykdommer ved at NETs leverer multiple autoantigener til immunsystemet slik at en inflammasjons-prosess utløses. Antakelig kan NETs også øke den inflammatoriske responsen (He Y, 2018).
Ekstracellulære vesikler
Definisjon. Ekstra-cellulære vesikler (EV) er viktige mediatorer i kommunikasjonen mellom alle typer celler. EV transporterer proteiner, mRNA, MiRNA og lipider. Tre typer EV er identifisert: eksosomer (< 100 nm.), mikrovesikler (100–1000 nm.) og apoptotiske legemer (1000–5000 nm.) som klassifiseres etter deres størrelse og funksjon.
Revmatiske sykdommer. EV er blitt isolert ved flere revmatiske sykdommer, inklusiv Sjøgrens sykdom
Prostaglandiner
Definisjon. Cellene som deltar i inflammasjonen, påvirker også produksjonen av en rekke mediatorer som kalles prostaglandiner. De ulike prostaglandinene har ulike virkninger, til dels motsatt rettede virkninger på cellene (Wojcik P, 2021).
Patogenese. Først skjer en frigivelse av arakidonsyre fra celleveggen etter aktivering av fosfolipase A2. Ved hjelp av enzymer, som bl.a. cyklooksygenase (COX), dannes så prostaglandin E2 (PGE2), prostaglandin D2, prostacyclin PGI2 og leukotrien B-F4. Feber medieres ved at PGE2 påvirker neuroner i det preoptiske området, dorso-mediale hypothalamus og nucleus raphe pallidus (en samling av nevroner) i medulla oblongata. Deretter aktiveres det sympatiske nervesystemet som gir muskelskjelvinger og vasokonstriksjon i huden. PGE2 aktiveres av pyrogener, enten endogent (IL-1, IL-6 og TNF-a) eller eksogent (lipopolysakkarider fra bakterienes cellevegg). Smerte oppstår på grunn av prostaglandinenes effekt. Disse mediatorene virker ikke bare inflammasjonsfremskyndende, men også hemmende på den inflammatoriske reaksjonen.
COX- og COX-2. De fleste av NSAIDs hemmer syntesen av prostaglandiner enten ved å hemme Cox eller lipoksygenase. Det finnes to isomere former av førstnevnte, Cox-1 og Cox-2. Cox-1 medierer dannelsen av prostaglandiner som opprettholder normale fysiologiske funksjoner, mens Cox-2 medierer produksjonen av prostaglandiner ved inflammasjon. COX-2 finnes i få vev, men kan induseres av pro-inflammatoriske cytokiner, som f. eks. IL-1. Synovialhinnen har både COX-1 og COX-2.
Konklusjon for kliniske forhold
Inflammasjon er naturlig, hensiktsmessig og nødvendig. Kronisk inflammasjon er som oftest uhensiktsmessig. Å dempe en inflammasjon er oftest kun symptomatisk terapi, men kan holde den autoimmune sykdommen i sjakk så lenge behandlingen vedvarer. Å fjerne antigenet som utløste reaksjonen vil være kurativ behandling, forutsatt at antigenet er identifisert. Det er få revmatiske sykdommer med kjent antigen: urinsyregikt, kolesterol-embolier, kreft-utløst dermatomyositt, avstøtningsreaksjon (GVHD), infeksjoner som septisk artritt, borreliose og Whipples sykdom. Revmatologien har som må å helbrede revmatiske sykdommer, men veien dit er lang. Med økende kjennskap til immunsystemets funksjoner har vi oppnådd medikamenter som kontrollerer inflammatoriske revmatiske sykdommer effektiv på en måte vi ikke har sett maken til tidligere. Enda mer kunnskap på dette område antas å kunne forbedre behandlingsmulighetene ytterligere.
Litteratur
Scherer HU, 2020 (etiologi ved revmatoid artritt)
Zimmermann KA, 2018 (Immune system, Lifescience)
Murphy, Travers & Wa/port. Janeway’s Immunobiology. Garland Science.
