BEHANDLING (REV 015, REV 033, REV 050, REV 055, REV 078, REV 079)
237 Høydose kjemoterapi med autolog stamcellestøtte (HMAS) for diffus systemisk sklerose i Norge (REV 031)
Ragnar Gunnarsson
Definisjon
Høydose kjemoterapi med autolog stamcellestøtte (HMAS), som også kalles autolog hematopoietisk stamcelletransplantasjon (AHSCT), har siden slutten av 1980-tallet vært etablert rutinebehandling ved myelomatose, lymfomer, testis-cancer og enkelte leukemier. Det gjennomføres på nåværende tidspunkt, årlig ca. 130 HMAS behandlinger på indikasjonen malign sykdom ved Oslo universitetssykehus.
Metoden
Hensikten med HMAS ved autoimmune sykdommer er å nullstille immunforsvaret med å utslette autoreaktive hvite blodlegemer. Ved autolog stamcelletransplantasjon får pasienten tilbake sine egne stamceller i motsetning ved allogen stamcelletransplantasjon der pasienten får tilbake stamceller fra en annen person. Ved autolog stamcelletransplantasjon vil man på forhånd høste hematopoietiske stamceller (CD34+) fra pasientens egen benmarg via blodbanen etter medisinsk stimulering. Stamcellene føres tilbake til blodbanen etter høydose cellegiftbehandlingen og finner veien tilbake til benmargen. T-celleantistoffer brukes ikke når man behandler hematologiske eller onkologiske lidelser, men brukes som regel når man benytter HMAS som behandling for immunologiske sykdommer som; systemisk sklerose, Crohns sykdom og multiple sklerose (1, 2). Der anvendes T-celleantistoffer, enten fra kanin eller hest, som medfører både immunologiske reaksjoner og øker infeksjonsrisiko, men uten denne behandlingen vil HMAS gi utilstrekkelig effekt på den underliggende immunologiske aktiviteten.
HMAS behandlingen består av tre faser. Fase 1 «forberedelse», Fase 2 del 1 «mobilisering av stamceller», Fase 2 del 2 «høsting av stamceller» og Fase 3 «høydosebehandling og tilbakeføring av stamceller». Det går som vanlig ca. 1 uke mellom del 1 og del 2 i fase 2. og noen uker til Fase 3. (Figur 1)
Figur 1
De tre fasene i behandling med høydose kjemoterapi med autolog stamcellestøtte (HMAS) ved diffus systemisk sklerose.
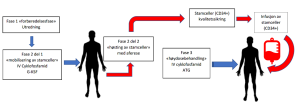
G-KSF: granulocytt-kolonistimulerende faktor (filgrastim). ATG: antihuman thymocytt-immunglobulin (Thymoglobuline® kanin)
Avdeling for revmatologi, hud- og infeksjonssykdommer, Oslo universitetssykehuset (OUS) er referansesenter for komplisert revmatologi i Helse Sør Øst med lokalfunksjon for Oslo. Seksjon for Revmatologi og har over tid bygd opp kompetanse på bl.a. på multiorgan autoimmune systemiske bindevevssykdommer og vaskulittsykdommer. Det foreligger funksjonsavtale med Diakonhjemmet sykehus som har ansvar for inflammatoriske leddsykdommer og artrose. Revmatologisk seksjon OUS mottar et stort antall pasienter til vurdering fra alle de øvrige tre norske helseregioner. Per dags dato vil fleste pasienter med alvorlige systemiske bindevevssykdommer i Norge vil på ett eller annet tidspunkt blir henvist til OUS. Pasientene har som oftest utviklet eller er i en stor fare for å utvikle en alvorlig organaffeksjon med bl.a. hjerte-, lunge– og/eller nyresvikt. OUS Rikshospitalet landsfunksjon på organtransplantasjoner. Det er tett samarbeid innenfor behandling og forskning med bl. a. Hjerte-, lunge- og karklinikken, OUS og Avdeling for blodsykdommer, Kreftklinikken, OUS som innebærer Seksjon for stamcellebehandling ledet av dr. med Tobias Gedde‐Dahl.
Systemisk sklerose (SSc) er en sjelden og sammensluttet sykdom der man foreløpig ikke har tilgjengelig helbredene eller en effektiv sykdomsmodifiserende behandling. Ut fra estimert antall nye tilfeller (insidens) i Norge er estimert at det er mellom 30-55 ny-diagnostiserte SSc pasienter og 1/3 av disse, eller 10-18 pasienter, har diffus form av systemisk sklerose (dcSSc). Vi har estimert at rundt 25-35 % av disse ville være aktuelle for HMAS behandling. Det totale
Metodevurdering og Beslutningsforum
Våren 2015 ble en «minimetodevurdering» utført i regi av undertegnet i regi av Seksjon for revmatologi og Avdeling for blodsykdommer, Oslo universitetssykehus. I juni 2015 ble det gitt grønt lys for oppstart av behandling hos pasienter med dcSSc. Forutsetningene var av at det skulle være likeverdig tilgang for pasienter fra hele landet til HMAS behandlingen og at det skulle utføres en fullstendig «metodevurdering». Denne ble avsluttet i august 2018 (3). Konklusjonen av metodevurderingen var at til tross for dødeligheten ved HMAS var høy, da var risiko for organsvikt og død, uansett årsak, likevel mindre fra to års oppfølging og utover sammenliknet med standard cyclofosfamid behandling i ett år. Sammenlignet med standard behandling, var i tillegg var reduksjon av hud affeksjon og bedret lungefunksjon målt ved forsert vitalkapasitet. Kostnadsnytte vurdering var utfordrende der pasienter med SSc er svært heterogen og har varierende bruk av helsetjenester. Pasientene med indikasjon for HMAS behandling er alvorlig syke, ofte med affeksjon i ett eller flere organer, og krever utredning og behandling på tvers av flere medisinske spesialiteter. Kostnad ved immunsuppresjon, ved nyresvikt med evt. dialysebehandling og eventuelle kostnader ved behandling av pulmonal hypertensjon som oftest innebærer samtidig behandling med 2-3 medikamenter, gir medikamentutgifter på opp mot og over 3000 Nkr dagen. I tillegg kommer andre direkte og indirekte kostnader som for eksempel gjentatte sykehusinnleggelser, sårstell, surstoffapparater og evt. pacemakerinnleggelser og evt. kostnad ved evt. lunge eller nyretransplantasjon. Det er foreløpig uklart i hvilken grad bruk av helsetjenester etter gjennomgått HMAS endres. Det var derfor umulig å gjennomføre en pålitelig sammenlignende analyse av disse behandlingsalternativene. Estimert kostnaden ved HMAS er engangskostnad på NOK 408.000 (august 2018) i tillegg kommer til kostnad ved forundersøkelser og kontroller som oftest er lik og tilsvarende pasient som ikke går til HMAS (3). [https://www.fhi.no/en/publ/2018/Autologous-hematopoietic-stem-cell-transplantation-for-Diffuse-Systemic-Sclerosis] På dette grunnlag bestemte Beslutningsforum den 27.8.18. å innføre i norsk helsevesen HMAS som behandlingstilbud til pasienter med dcSSc med rask sykdomsutvikling etter de kriteria som vi har brukt som er knyttet tett opp til inklusjonskriteria i de tre randomiserte studiene (4-6). Det vil si at: (I) sykdomsvarighet skal være under eller lik to år, eller (II) at det foreligger progressiv alvorlig organaffeksjon de siste seks måneder med sykdomsvarighet under eller lik fire år. Det ble også formidlet krav at kliniske data blir registrert og fulgt opp både i et nasjonalt register og i det europeiske multisenterregisteret. Beslutningsforum konkluderte at HMAS behandlingen på dcSSc i Norge skal sentraliseres. Behandlingstilbudet ble lagt til OUS etter standard søknadsprosedyre for nasjonal behandlingstjeneste.
Pasientseleksjon
Pasientseleksjon for HMAS behandling eller en annen immunsuppressiv behandling er svært viktig. Til tross for at HMAS ikke er helbredende behandling for dcSSc er det den mest effektive behandlingen for å bremse og evt. reversere sykdomsutvikling og redusere mortalitet. En grundig forhåndsutredning for å minimalisere risikoen for potensielle bivirkninger av HMAS og sikre at «de rette» pasientene får behandling på tidlig tidspunkt og unngå unødvendig HMAS behandling. Grunnleggende forutsetninger er å ha tilstrekkelig med pasientvolum, tilstrekkelig med kompetanse og erfaring på sykdommen, internasjonale kontakter og tverrfaglig kompetanse innen andre kliniske spesialiteter i tillegg til revmatologi og hematologi så som spesialister innen hjerte-, lunge-, nyre- og intensivmedisin, og spesialister i bildediagnostikk, gastroenterologi og hudsykdommer. Revmatologisk seksjon OUS har over tid hatt kontakt med University Medical Center Utrecht i Nederland ledet av professor van Laar samt med Division of Immunotherapy and Autoimmune Diseases (DIAD) Northwestern Memorial Hospital, ledet av Richard Burt i Chicago, IL, USA. Vi har i samråd med disse sentrene utviklet og oppdatert detaljerte prosedyrer for forhåndsundersøkelser og rutiner og observasjoner under behandlingen. I tillegg har man også inkludert anbefalinger fra Joint Accreditation Committee of the International Society for Cellular Therapy (JACIE) og European Society for Blood and Marrow Transplantation (EBMT) Autoimmune Disease Working Party (ADWP) (7).
Revmatologisk seksjon vil således ha et optimalt grunnlag for å kunne identifisere og velge ut pasienter som kan være aktuelle for HMAS behandling. Det er per dags dato sendt felles søknad fra Revmatologisk seksjon og Avdeling for blodsykdommer OUS via Helse Sør-Øst til Helsedirektoratet om formelt nasjonalt behandlingssenter på HMAS ved dcSSc på OUS Rikshospitalet.
Pasienter med dcSSc med rask sykdomsutvikling har vært prioritert til rask utredning. Fra man startet opp med behandlingen i 2015 har man lagt opp til at indikasjonene for HMAS behandlingen skal legges tett opp mot det som er dokumentert i randomiserte kliniske forsøk der konvensjonell behandling er sammenlignet med HMAS behandling (4-6). Det innebærer at pasienter som skal være aktuelle for HMAS må ha dcSSc i tillegg til (i) sykdomsvarighet under eller lik to år eller (ii) progressiv alvorlig organaffeksjon de siste seks måneder med sykdomsvarighet under eller lik fire år fra vi igangsette behandlingen som er i grunn i samsvar ved en nylig konklusjon fra Beslutningsforum. Nærmere om inklusjon og eksklusjon ved HMAS og dcSSc i Norge vises til Tabell 1 og 2. Det er også utformet tilpasset pasientinformasjonsskriv om behandlingen. Det er en utfordring å gi en balansert spesialtilpasset pasientinformasjon både muntlig og skriftlig.
- Vennligst se også Tabell 1 nedenfor
Risiko
HMAS behandling ved dcSSc er forbundet med risiko (8) og viktig å velge ut de dcSSc pasientene som har størst sjanse for å få effekt av behandlingen i form av økt overlevelse og minsket fare for organsvikt. Sentralisering av HMAS tilbudet ved systemisk sklerose i Norge er forutsetningen til å få erfaring med bedre seleksjon og økt erfaring i HMAS behandlingen hos denne pasientgruppen får å få minsket behandlingsrelatert mortalitet. Utvikling av et stort internasjonalt kontaktnett og deltakelse i nye multisenter internasjonale studier vil trolig være enklere å få gjennomført i regi av en nasjonal tjeneste. I de fleste tilfellene der pasientene har et stormende forløp og alvorlige sykdoms-manifestasjoner er HMAS beste behandlingsalternativet, og det er viktig å komme i gang med behandlingen før omfattende irreversible vitale organskader forekommer. I tvilstilfeller kan man velge en annen primærbehandling, som per dags dato er som oftest per oral mykofenolat eller intravenøs cyclofosfamid til tross effekt av behandlingen ut fra randomiserte studier er dessverre svært moderate (9-11). Da har man valgt tette kontroller på effekt og forløp og revurdere om det er indikasjon for HMAS. Det er lagt opp til at pasienten får en grundig informasjon om behandlingen og man legger opp til delt beslutningstaking («shared decision making»). Alle publiserte studier, samt egen erfaring ved OUS gjennom tre år med HMAS behandling for dcSSc, viser at det er store utfordringer knyttet til behandlingsrelatert mortalitet og morbiditet. Det er flere årsaker til dette, systemisk sklerose er en komplisert multiorgan sykdom med fibroseutvikling i hjerte, lunger, tarmkanal, hud og nyrer. Pasientene får i forbindelse med høydose cyklofosfamid behandlingen som brukes i nåværende protokoll (200mg/kg over 4 dager) i fase III en betydelig væskemengde som mange pasienter med systemisk sklerose tåler dårlig. Pasientene med de alvorligste form av dcSSc kan ha hjerteaffeksjon av grunnsykdom, og høydose cellegiftbehandling kan gi akselerert hjerteaffeksjon og hjertesvikt. Det er relativ vanlig å ha karforandringer «gastric antral vascular ectasia» (GAVE) i tarm som gir mikroblødninger som er særlig farlig i aplasifasen av HMAS behandlingen som medfører pancytopeni. Pancytopeni-fasen etter fase III varer vanlig i 10-14 dager og i denne fasen er pasienten bl.a. utsatt for bakterielle-, sopp- og virusinfeksjoner.
Til sammen (pr 2020) har elleve pasienter vært behandlet i Norge; syv (64%) fra Helse Sør-Øst, tre (27%) fra Helse Vest og en (9%) fra Helse Nord gjennomført HMAS behandling for dcSSc fra 2015 til dags dato (31.1.19) ved OUS, derav fikk fem pasienter utført behandlingen i fjor (2018). Dette samsvarer med omtrent med befolkningsfordelingen innen de aktuelle helseforetagene. Det er tre menn og åtte kvinner som har gjennomført behandlingen. Første to behandlingene i 2015 var uttalt suksess men neste to ble knyttet til alvorlige komplikasjoner og dødsfall. Dette medførte at man gikk igjen grundig igjennom rutiner og forundersøkelser og de siste 7 behandlingene, derav fem i 2018 har vært uten uforventete komplikasjoner.
Det er at paradigmeskifte at det innføres et nytt behandlingsprinsipp for revmatologisk sykdom som inkluderes i det offentlige helsetilbudet i Norge. Man har sett siste to tiårene en utrolig utvikling i behandling innen revmatologien. Dette har revolusjonert prognose og livskvalitet til et stort antall pasienter med inflammatoriske leddlidelser. Dessverre har de pasientene med de mest aggressive formene av systemisk sklerose til nå hatt svært begrenset glede av denne utviklingen. Dessverre er effekten svært moderat av langvarig cyklofosfamid behandling og «off label» mykofenolat behandling som er per dags dato de best dokumenterte sykdomsmodifiserende behandlingene (9-11). Det har vært smertefullt å se pasientene gradvis utvikle livstruende organaffeksjon som inntil nå har vært umulig å reversere. Hvis tilbudet om HMAS ikke hadde vært opprettet her i Norge ville dette ha forårsaket en ukontrollert helseturisme til utlandet.
Beslutningsforums konklusjon i august 2018 er i tråd med flere internasjonale instanser. HMAS behandling er anbefalt av den nå tre år gamle Europeiske revmatologiforeningens (European League against Rheumatism (EULAR)) behandlingsanbefalinger for SSc fra 2016. Der står at «HMAS bør vurderes for behandling av utvalgte pasienter med raskt progressiv SSc med risiko for organsvikt. I lys av den høye risikoen for behandlingsrelaterte bivirkninger og tidlig behandlingsrelatert dødelighet, er nøye utvalg av pasienter med SSc for denne typen behandling og erfaringen fra behandlere av avgjørende betydning» (12). Ytterligere studier inklusiv SCOT studien som ble publisert i januar 2018 styrker den konklusjonen (4). Basert på publiserte randomiserte kontrollerte studier og metaanalyser anbefalte American Society for Blood and Marrow Transplantation (ASBMT) arbeidsgruppen HMAS som standard behandling for pasienter med alvorlig systemisk sklerose i 2018 (13).
Det er flere utfordringer som gjenstår vedrørende pasientseleksjon og tiltak til å få ned behandlingsrelatert mortalitet og morbiditet av HMAS behandling. En stor utfordring er for eks. at interstitiell lungesykdom (ILD) er den vanligste årsaken til dødelighet i systemisk sklerose som står for ca. 35% av dødsfallene. Selv om immunsuppresjon er for tiden valgt som første linje terapi for sklerodermi-relatert ILD (SSC-ILD), er effekten beskjeden med bekymringer for toksisitet og infeksjoner ved langvarig bruk (9-11, 14). Foreløpig mangler randomiserte studier på HMAS behandling på pasienter med alvorlig progressiv lungeaffeksjon med begrenset skleroderma hudaffeksjon og ved skleroderma spekter sykdommer.
Tabell 1
Pasienter med diffus systemisk sklerose som er aktuelle for høydose kjemoterapi med autolog stamcellestøtte (HMAS) for av HMAS behandling.
- Alder 18 tom 65 år
- Etablert diagnose for diffuse systemisk sklerose (dcSSc) etter ACR-kriteria (1980) og/eller etter 2013 ACR/EULAR klassifikasjonskriteria for systemisk sklerose (15, 16).
- Diffuse systemisk sklerose med hudmanifestasjon (a. og/eller b.):
- ≤ 2 år fra utvikling av hudfortykkelse i tillegg mRSS ≥ 15.
eller - ≤ 4 år fra utvikling av hudfortykkelse, i tillegg mRSS ≥ 15 samt major organ affeksjon (med dokumentert oppstart eller klinisk signifikant forverring de siste 6 månedene) som er definerte med (i, ii):
- Lungeaffeksjon: bekreftet interstitial lungesykdom ved HRCT. DLCO og/eller (F)VC ≤ 80% (av ventet) og/eller signifikant reduksjon på ≥ 10%
- Hjerteaffeksjon: Ett av følgende; (a) Irreversible kongestiv hjertesvikt. (b) Tilbakevendende atrial eller ventrikulære hjerterytmeforstyrrelser som; atrial fibrillasjon, atrial flutter, paroksysmal atrial- eller ventrikulær tachykardi. (c) Andre eller tredje grads AV-blokk. (d) Perikarditt/perikard effusjon, der som andre årsaker en dcSSc har vært utelukket.
- Mottatt informasjon om forventet effekt og evt. komplikasjoner av behandlingen.
- ≤ 2 år fra utvikling av hudfortykkelse i tillegg mRSS ≥ 15.
mRSS = «modified» Rodnan hud score
Kontraindikasjoner
Tabell 2
Absolutte og relative kontraindikasjoner for høydose kjemoterapi med autolog stamcellestøtte (HMAS) for diffus systemisk sklerose.
- Alder > 65 år
- Pågående graviditet eller uvillighet å bruke adekvat kontrasepsjon.
- Manglende evne til å gi informert samtykke til behandlingen.
- Alvorlige psykiske sykdommer og/eller avhengighet og vedvarende misbruk av alkohol eller rusmidler.
- Alvorlig organaffeksjon:
- Alvorlig lungesykdom: Karbonmonoksid diffusjonstest, DLCO < 40% og/eller funksjonell vital kapasitet, FVC < 65% av forventete verdier.
- Alvorlig nyresvikt: Kreatinin clearance < 40 ml/min/1,73 m2 (målt eller estimert) eller gjennomgått skleroderma nyrekrise (SRC) de siste 6 måneder
- Alvorlig hjertesykdom: (a) Redusert venstre ventrikkel funksjon LVEF < 45%, (b) Pulmonal hypertensjon med mPAP >25mmHg uten og/eller mPAP >30 mmHg etter intravenøs væskeutfordring. (c) «D-sign» eller «septal bounch» ved MRI hjerte. (d) Konstruktivt perikarditt. (e) Hjerte tamponade med hemodynamisk signifikant perikard effusjon. (f) Signifikant aterosklerotisk sykdom. (g) Arytmier som ikke kan kontrolleres farmakologisk, ved cardioversjon eller ablasjon.
- Vedvarende blødninger fra karforandringer i tarm «gastric antral vascular ectasia» (GAVE).
- Alvorlig leversvikt: Vedvarende to ganger økning i lever-transaminaser eller bilirubin. Manglende syntetisk funksjon eller bevis på skrumplever.
- Vedvarende kreftsykdom eller myelodyspastisk sykdom.
- Benmargssvikt: Definert som; leukocytopeni < 4.0 x 109/L, trombocytopeni < 50 x 109/L, anemi < 8 g/dL, CD4+ T lymfocytopeni < 200 x 106/L.
- Ukontrollert akutt og/eller kronisk infeksjon: HIV, HTLV-1,2 positivitet, HBV, HCV, CMV, Parvovirus B19, EBV.
- Tidligere behandling med total lymfoid stråling, helkropps stråling eller tidligere utstrakt bruk av alkylerende medikamenter (relativ kontraindikasjon).
- Nåværende storrøyker som nekter eller klarer ikke å slutte (relativ kontraindikasjon)
Referanser
- Burt RK, Balabanov R, Burman J, Sharrack B, Snowden JA, Oliveira MC, et al. Effect of Nonmyeloablative Hematopoietic Stem Cell Transplantation vs Continued Disease-Modifying Therapy on Disease Progression in Patients With Relapsing-Remitting Multiple Sclerosis: A Randomized Clinical Trial. JAMA. 2019 Jan 15;321(2):165-74. PubMed PMID: 30644983.
- Hawkey CJ, Allez M, Clark MM, Labopin M, Lindsay JO, Ricart E, et al. Autologous Hematopoetic Stem Cell Transplantation for Refractory Crohn Disease: A Randomized Clinical Trial. JAMA. 2015 Dec 15;314(23):2524-34. PubMed PMID: 26670970.
- Giske L. S-SA, Håheim L.L., Juvet L.K., Gunnarsson R., Gedde Dahl T., Hafstad E., Fure B. Autolog hematopoietisk stamcelletransplantasjon (AHSCT) ved diffus systemisk sklerose. En fullstendig metodevurdering. Oslo: Område for helsetjenester i Folkehelseinstituttet; 2018. p. 68 (116 inklusiv vedlegg).
- Sullivan KM, Goldmuntz EA, Keyes-Elstein L, McSweeney PA, Pinckney A, Welch B, et al. Myeloablative Autologous Stem-Cell Transplantation for Severe Scleroderma. New England Journal of Medicine. 2018;378(1):35-47. PubMed PMID: 29298160.
- van Laar JM, Farge D, Sont JK, Naraghi K, Marjanovic Z, Larghero J, et al. Autologous hematopoietic stem cell transplantation vs intravenous pulse cyclophosphamide in diffuse cutaneous systemic sclerosis: a randomized clinical trial. JAMA. 2014 Jun 25;311(24):2490-8. PubMed PMID: 25058083.
- Burt RK, Shah SJ, Dill K, Grant T, Gheorghiade M, Schroeder J, et al. Autologous non-myeloablative haemopoietic stem-cell transplantation compared with pulse cyclophosphamide once per month for systemic sclerosis (ASSIST): an open-label, randomised phase 2 trial. The Lancet. 2011;378(9790):498-506.
- Farge D, Burt RK, Oliveira MC, Mousseaux E, Rovira M, Marjanovic Z, et al. Cardiopulmonary assessment of patients with systemic sclerosis for hematopoietic stem cell transplantation: recommendations from the European Society for Blood and Marrow Transplantation Autoimmune Diseases Working Party and collaborating partners. Bone Marrow Transplant. 2017 Nov;52(11):1495-503. PubMed PMID: 28530671. PMCID: PMC5671927.
- Burt RK, Farge D. Systemic sclerosis: Autologous HSCT is efficacious, but can we make it safer? Nature reviews Rheumatology. 2018 Mar 8. PubMed PMID: 29515186.
- Tashkin DP, Elashoff R, Clements PJ, Goldin J, Roth MD, Furst DE, et al. Cyclophosphamide versus placebo in scleroderma lung disease. New England Journal of Medicine. 2006 Jun 22;354(25):2655-66. PubMed PMID: 16790698.
- Tashkin DP, Roth MD, Clements PJ, Furst DE, Khanna D, Kleerup EC, et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. The lancet Respiratory medicine. 2016 Jul 25. PubMed PMID: 27469583.
- Volkmann ER, Tashkin DP, Li N, Roth MD, Khanna D, Hoffmann-Vold AM, et al. Mycophenolate Mofetil Versus Placebo for Systemic Sclerosis-Related Interstitial Lung Disease: An Analysis of Scleroderma Lung Studies I and II. Arthritis & rheumatology (Hoboken, NJ). 2017 Jul;69(7):1451-60. PubMed PMID: 28376288. PMCID: PMC5560126.
- Kowal-Bielecka O, Fransen J, Avouac J, Becker M, Kulak A, Allanore Y, et al. Update of EULAR recommendations for the treatment of systemic sclerosis. Ann Rheum Dis. 2017 Aug;76(8):1327-39. PubMed PMID: 27941129.
- Sullivan KM, Majhail NS, Bredeson C, Carpenter PA, Chatterjee S, Crofford LJ, et al. Systemic Sclerosis as an Indication for Autologous Hematopoietic Cell Transplantation: Position Statement from the American Society for Blood and Marrow Transplantation. Biology of blood and marrow transplantation : journal of the American Society for Blood and Marrow Transplantation. 2018 Jun 25. PubMed PMID: 29953945.
- Solomon JJ, Olson AL, Fischer A, Bull T, Brown KK, Raghu G. Scleroderma lung disease. European Respiratory Review. 2013 March 1, 2013;22(127):6-19. PubMed PMID: 23457159.
- Masi AT, Subcommittee For Scleroderma Criteria of the American Rheumatism Association D, Therapeutic Criteria C. Preliminary criteria for the classification of systemic sclerosis (scleroderma). Arthritis and Rheumatism. 1980;23(5):581-90.
- van den Hoogen F, Khanna D, Fransen J, Johnson SR, Baron M, Tyndall A, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative. Arthritis Rheum. 2013 Nov;65(11):2737-47. PubMed PMID: 24122180. PMCID: 3930146.
