VASKULITT (REV 034-052)
88 Goodpasture syndrom (GPS) eller anti-glomerulær basalmembran (anti-GBM) sykdom (REV 034)
Ragnar Gunnarsson
Kjennetegn på Goodpasture sykdom
Anti-GBM sykdom er en sjelden alvorlig autoimmun sykdom, som karakteriseres med antistoff mot α3-kjeden i type kollagen type IV som finnes i basale membraner i nyrenes glomeruli (GBM) og i lungenes alveoler (ABM).
Kliniske manifestasjonen er raskt progressiv glomerulonefritt hos nesten alle med lungeaffeksjon oftest i form av alveolare blødninger i 20-30% tilfelle.
Diagnosen er basert på påvisning av anti-GBM antistoff i serum og/eller lineært nedslag i nyrebiopsi.
Behandlingen baseres på plasmaferese, høydose steroid behandling og cyklofosfamid.
I den tiende versjon av den internasjonale statistiske klassifikasjonen av sykdommer og beslektede helseproblemer i regi av Verdens helseorganisasjon (WHO ICD10) er Goodpasture syndrom (GPS) eller anti-glomerulær basalmembran syndrom (anti-GBM syndrom) registrert som ICD-10 M31.0† Hypersensitivitetsangiit med nyreaffeksjon M08.5*.
Prosedyrekoder: EKG: FPFE15
ATC koder (for legemiddelstatistikk): Prednisolon: H02A B06 Immunsuppressive legemidler: L04A A.
Definisjon
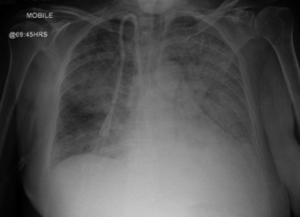
Goodpasture syndrom/sykdom (GPS) er småkarsvaskulitt med auto-antistoffer rettet mot basalmembraner (BM) som dekker nyrenes glomeruli (GBM) og lungenes alveoler (ABM). Sykdommen har fått navnet anti-glomerulær basalmembran (anti-GBM) syndrom/sykdom som brukes stort sett nå i medisinsk faglitteratur.
Historikk
Ernest Goodpasture beskrev i 1919 en ung mann med en dødelig sykdom preget av hemoptyse, alveolær blødninger med proliferativ glomerulonefritt (1). I 1958 brukte Stanton og Tange for første gang Goodpastures syndrom i beskrivelse av pasientkasuistikk med lungeblødning og nekrotiserende glomerulonefritt (2). Ni år senere, i 1967 publiserte Lerner og kolleger bevis på anti-GBM-antistoffer fra mennesker kunne forårsake glomerulonefritt når de ble injisert i andre primater (3).
Patogenese og patologi
Anti-GBM antistoffer er oftest polyklonal av IgG1 eller IgG3 type og er rettet mot NC1 domenet av alfa-3 kjeden av kollagen type IV, som er mest uttalt i basalmembraner i glomerulær og alveolær vev. Immunfluorescensmikroskopi fra nyrebiopsi viser lineær avsetning av anti-GBM IgG, mens i sjeldne tilfeller IgA eller IgM, langs glomerulære kapillærer eller distale tubuli. Lysmikroskopi viser oftest halvmåne glomerulonefritt.
Genetiske faktorer har utvilsom innvirkning på utvikling av anti-GBM sykdom. Det er sterk positiv assossiasjon mellom anti-GBM sykdom og vevstyper HLA-DRB1*1501 og DRB1*0401, men negativ assosiasjon til HLA-DRB1*07 (4).
Omgivelsesfaktorer som er assosierte til anti-GBM syndrom. Det er assosiasjon med skade i lunge eller nyrevev parallelt med annen pågående sykdomstilstand, kjemisk affeksjon med evt. røyking, inhalering av røyk eller gass. Anti-GBM sykdom kan komme når det er annen underliggende nyresykdom. Ofte ser det ut til å være anti-nøytrofilt cytoplasma antistoff (ANCA) assosiert vaskulitt (AAV), men mye sjeldnere assosiert membranøs nefropati. Det er påfallende stor andel, ca. 1/3 av anti-GBM pasienter som også er ANCA positive og del av disse tilfredsstiller både AAV og anti-GBM diagnosene. Andre faktorer assosiert til anti-GBM sykdom er medikamentet alemtuzumab/Lemtrada®, som er nå kun registrert for behandling av multiple sklerose (MS), men var tidligere brukt for behandling av kronisk lymfatisk leukemi (KLL). Det er et humanisert monoklonalt antistoff rettet mot CD52 som er på overflaten av modne lymfocytter og kan samtydig redusere immunologisk toleranse og indusere flere autoimmune sykdommer deriblant anti-GBM sykdom.
Kriterier for klassifikasjon og mål på sykdomsaktivitet
Det finnes ikke klassifikasjonskriterier for anti-GBM sykdom, og det finnes ikke mål for sykdomsaktivitet.
Epidemiologi
Sykdommen er svært sjelden (5) og nylig publisert studie fra Irland så fant at insidens av anti-GBM sykdom over 11 år (2003-2014) var 1,6 per million per år.
En studie fra professor Jennette fra delstaten Nord-Carolina viste at rundt 15% av pasienter at av totalt 632 pasienter med biopsidokumentert halvmåne glomerulonefritt og det var konstant i tre aldersgrupper hos pasienter 1-20 år, 21-60 år og hos de som var over 61 år. Mens det var økt andel av pauciimmune halvmåne glomerulonefritt med økt alder på hhv. 42%, 48% og 79%, mens fallende andel av immune-kompleks glomerulonefritt med økt alder på hhv. 45%, 35% og 6% (6).
Klinikk
De aller fleste pasienter med anti-GBM sykdom har alvorlig nyreaffeksjon med raskt progressiv glomerulonefritt. I en nylig publisert nasjonal irsk studie hadde 77% hadde isolert nyreaffeksjon.
I alt 22% hadde både nyre og lungeaffeksjon med alveoler blødninger. Det svært få kun 1% hadde isolert lungeaffeksjon (5), som er i tråd med andre kohortundersøkelser. De aller fleste som får lungeblødning har en underliggende lungesykdom, er røykere eller har blitt utsatt for andre omgivelsesfaktorer.
Undersøkelser
Antistoff. Ved mistanke om anti-GBM sykdom er det svært viktig å få analysert anti-GBM antistoffer som er en ø.hj. hjelp us. som man kan få med kort varsel som hurtigtest på Oslo universitetssykehus (OUS) sammen med hurtigtesting for ANCA (både PR3 og MPO). Det er viktig med nyrebiopsi med immunhistokjemi for å bekrefte diagnosen og estimere skade som indikerer prognose.
Blod og urinprøver inklusiv nyrefunksjon (kreatinin, eGFR og karbamid) samt hematologiske parametere.
Diagnosen
Diagnosen baseres på mønstergjenkjenning med vanligvis rask innsettende nyre- og/eller lungeaffeksjon og påvisning av anti- GBM antistoffer i serum og/eller lineær anti-GBM antistoff nedslag i nyrebiopsi.
Differensialdiagnoser
Andre årsaker for glomerulonefritt med lungeblødninger med det som anføres som «pulmonary renal syndrom». Der i fremste rekke er ANCA vaskulitter, men andre årsaker er kan være akutt antifosfolipid syndrom. Dette sykdomsbilde kan ses ytterst sjelden ved aktiv IgA vaskulitt (Henoch-Schönlein purpura) eller blandet kryoglobulinemi.
Behandling
Plasmaferese. Det er unison anbefaling at komme i gang med plasmaferese (PLEX) ved diagnose av anti-GBM sykdom. Vitenskapelig dokumentasjon av PLEX ved anti-GBM sykdom er tynn. I den store randomiserte PEXIVAS studien på AAV med 704 pasienter, var pasienter med anti-GBM ekskluderte (7). PLEX behandling ved anti-GBM sykdom gis daglig i 2-3 uker og i visse tilfeller lenger og i tilfelle lungeblødning da gis fersk frosset plasma.
Kortikosteroider. Oppstart av høydose steroid behandling er innledet med intravenøs metylprednisolon (SoluMedrol®) 15-30 mg/kg opp mot 1000 mg x1 som man gir da som oftest i 3 dager etterfulgt av steroider. Deretter gis per oral steroider vanligvis Prednisolon i nedtrappende dosering, men like potente doseringer av andre per oral steroider som har mindre mineralkortikoid effekt kan brukes ved høye doseringer som metylprednisolon og deksametason.
Cyclofosfamid. Det er mest vanlig å bruke per oral cyklofosfamid 2 mg/kg med nedtappede dosering etter nyrefunksjon (kreatinin clearance) og alder, med maksimal dosering 200 mg/d. En nylig fransk studie viste merkbar men ikke statistisk signifikant bedre prognose hos de som fikk per oral versus intravenøs cyklofosfamid (8).
Rituksimab. Dessverre har man ingen randomiserte studier på bruk av anti-CD20 antistoff behandling som rituksimab. Det finnes kun enkeltkasustikker ved bruk på anti-GBM sykdom (9, 10). Det er vanskelig å konkludere ut fra publiserte kasuistikker, og generelt innebærer dette vanligvis positiv publikasjonsbias i tillegg er det gitt i flere faser i sykdomsprosessen. Samtidig behandling med PLEX medfører at RTX blir filtrert bort sammen med andre antistoffer, derfor anbefales å vente med PLEX i 48 timer etter RTX behandling basert på farmakokinetikk. Nylig oversikt av Jain i New York, USA og Uematsu-Uchida og kollegaer fra Japan anfører at det er totalt publisert 23 pasienter med anti-GBM sykdom som har fått RTX der aller fleste fikk det som tillegg ved cyklofosfamid og PLEX. Rituksimab har vært gitt i svært varierte doseringer. Kun 17% (4/23) fikk reumatoid artritt (RA) dosering som er 1.000 mg IV med 2 ukers intervall, der halvdelen (2/4) fikk kun den første doseringen. Fleste fikk rituksimab den såkalte lymfom doseringen som doseres etter overflate, dvs. 375 mg/m2 ukentlig i 4 ganger. Aller fleste fikk denne 57% (13/23), mens 13% fikk 375 mg/m2 x2 (3/23) og 13% (3/23) fikk andre doseringer (9, 10).
Konsentrasjon av anti-GBM er ofte målt ukentlig første 4-6 ukene og deretter hver 2. uke neste 6-8 uker. Hvis vedvarende eller stigende anti-GBM titer bør man vurdere andre tiltak som rituksimab behandling evt. mykofenolat eller azathioprin behandling.
IdeS. IgG-nedbrytende enzym fra streptokokker (IdeS) er utviklet i Lund i Sverige av professor Mårten Segelmark og kolleger (11, 12) og kan muligvis bli et alternativ hos pasienter med anti-GBM sykdom og teoretisk andre immunglobulin medierte sykdommer. I en observasjonsstudie så man at behandling med IdeS hos tre pasienter med anti-GBM sykdom, førte til en rask reduksjon i sirkulerende anti-GBM antistoffer og dette var bekreftet med tilbakegang av anti-GBM i nyrebiopsi. Pasientene ble behandlet sent i forløpet som sannsynligvis har ført til irreversibel nyreskade. Det foregår en randomisert studie på effekt av IdeS som har fått akronymet GOOD-IDES (EudraCT number: 2016-004082-39) som vi må vente på.
Prognose
Nyreprognose er avhengig av grad av nyreaffeksjon når diagnose og behandling igangsettes. Hvis pasienten er dialyseavhengig ved diagnose er nyreprognosen dårlig. Pasienter med kreatinin > 500 µmol/L og/eller halvmåneutvikling i > 50% av glomeruli ved nyrebiopsi ved behandlingsstart, har dårlig nyreprognose. I tillegg er det også negativ prospektiv faktor å ha ANCA (MPO eller PR3) samtidig (14).
Fordypningslitteratur
Referanser
- Goodpasture EW. The significance of certain pulmonary lesions in relation to the etiology of influenza. American Journal of the Medical Sciences. 1919;158:863-70.
- Stanton MC, Tange JD. Goodpasture’s syndrome (pulmonary haemorrhage associated with glomerulonephritis). Australas Ann Med. 1958;7(2):132-44.
- Lerner RA, Glassock RJ, Dixon FJ. The role of anti-glomerular basement membrane antibody in the pathogenesis of human glomerulonephritis. The Journal of experimental medicine. 1967;126(6):989-1004.
- McAdoo SP, Pusey CD. Antiglomerular Basement Membrane Disease. Semin Respir Crit Care Med. 2018;39(4):494-503.
- Canney M, O’Hara PV, McEvoy CM, Medani S, Connaughton DM, Abdalla AA, et al. Spatial and Temporal Clustering of Anti-Glomerular Basement Membrane Disease. Clin J Am Soc Nephrol. 2016;11(8):1392-9.
- Jennette JC. Rapidly progressive crescentic glomerulonephritis. Kidney Int. 2003;63(3):1164-77.
- Walsh M, Merkel PA, Peh CA, Szpirt WM, Puechal X, Fujimoto S, et al. Plasma Exchange and Glucocorticoids in Severe ANCA-Associated Vasculitis. N Engl J Med. 2020;382(7):622-31.
- Huart A, Josse AG, Chauveau D, Korach JM, Heshmati F, Bauvin E, et al. Outcomes of patients with Goodpasture syndrome: A nationwide cohort-based study from the French Society of Hemapheresis. J Autoimmun. 2016;73:24-9.
- Uematsu-Uchida M, Ohira T, Tomita S, Satonaka H, Tojo A, Ishimitsu T. Rituximab in treatment of anti-GBM antibody glomerulonephritis: A case report and literature review. Medicine (Baltimore). 2019;98(44):e17801.
- Jain R, Dgheim H, Bomback AS. Rituximab for Anti-Glomerular Basement Membrane Disease. Kidney Int Rep. 2019;4(4):614-8.
- Segelmark M, Björck L. Streptococcal Enzymes as Precision Tools Against Pathogenic IgG Autoantibodies in Small Vessel Vasculitis. Frontiers in immunology. 2019;10:2165.
- Soveri I, Mölne J, Uhlin F, Nilsson T, Kjellman C, Sonesson E, et al. The IgG-degrading enzyme of Streptococcus pyogenes causes rapid clearance of anti-glomerular basement membrane antibodies in patients with refractory anti-glomerular basement membrane disease. Kidney Int. 2019;96(5):1234-8.
- Segelmark M, Hellmark T. Anti-glomerular basement membrane disease: an update on subgroups, pathogenesis and therapies. Nephrol Dial Transplant. 2019;34(11):1826-32.
- van Daalen EE, Jennette JC, McAdoo SP, Pusey CD, Alba MA, Poulton CJ, et al. Predicting Outcome in Patients with Anti-GBM Glomerulonephritis. Clin J Am Soc Nephrol. 2018;13(1):63-72.
