BINDEVEVSSYKDOMMER (REV 021-033)
53 Antifosfolipid syndrom (APS) / APLS og katastrofalt APS, CAPS (REV 021, REV 029)
Antifosfolipid syndrom
Øyvind Palm and Jan Tore Gran
Kjennetegn på antifosfolipid syndrom
Diagnosekoder ICD-10: D68.8 Prosedyrekoder: EKG FPFE15
Definisjon
Antifosfolipid syndrom (APS) er blant de vanligere årsaker til tromboembolier og alvorlige svangerskapskomplikasjoner (Petri M, 2020).
APS er en autoimmun sykdom som kjennetegnes av gjentatte tromboser og/eller svangerskapskomplikasjoner (spontanabort, dødfødsel, prematur fødsel) i kombinasjon med tilstedeværelse av antifosfolipid-antistoffer (APL). APS kan deles inn i to kategorier:
- Primært APS: Forekommer som en isolert autoimmun sykdom (ca. 40% av tilfellene) og behandles ofte av hematologer.
- Sekundært APS: Forekommer i forbindelse med en annen autoimmun sykdom (ca. 60% av tilfellene), vanligvis systemisk lupus erythematosus (SLE). Tilstanden behandles ofte av revmatologer, spesielt når assosiert med underliggende revmatisk sykdom. Et samarbeid med hematologer kan også være aktuelt.
Diagnosen APS er basert på:
- Kliniske manifestasjoner med tromboser/embolier og/eller svangerskapskomplikasjoner.
- Antifosfolipidantistoffer*:
- Lupus antikoagulant (LAC)
- Anti-kardiolipin (aCL) IgG og IgM
- Anti-β2-glykoprotein 1 (β2GP1) IgG og IgM
*Høye titere (≥40 enheter eller ≥99 persentil) av aCL IgG og/eller β2GP1 IgG/IgM anses som signifikante. “Trippel positivitet” (positive tester for LAC, aCL IgG og β2GP1 IgG/IgM) er assosiert med høyest risiko.
CAPS (katastrofalt APS) er en spesielt alvorlig undergruppe av APS som progredierer raskt (timer-dager) og omfatter flere organer (vennligst les om CAPS nedenfor i dette kapittelet). Mikroangiopatisk og seronegativ APS er også beskrevet (Gomez-Puerta JA, 2014).
Historie
Antifosfolipid syndrom ble fullstendig beskrevet så sent som i 1980 årene av E. Nigel Harris og Aziz Gharavi (Ruiz-Irastoza G, 2011). Syndromet var imidlertid kjent under et annet navn, “Hughes syndrom”, oppkalt etter Graham R.V. Hughes ved St. Thomas Hospital i London som bidro til den tidlige beskrivelsen av sykdommen i 1983 (Huges G, 1983). På 1990-tallet ble de internasjonale klassifikasjonskriteriene for APS ble etablert. I løpet av 2000-tallet har vår forståelse av APS-patogenesen økt og vi har fått forbedrede diagnostiske verktøy.
Kunnskapen om APS har økt mye siden den første beskrivelsen, og forskere fortsetter å arbeide for å forbedre diagnosen, behandlingen og prognosen for pasienter med denne komplekse sykdommen.
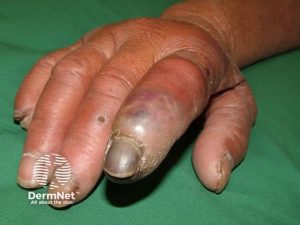
Patogenese
Patogenesen ved APS er ikke fullstendig kartlagt, men tilstedeværelse av antistoffer i serum rettet mot negativt ladede fosfolipider er sentrale. Fosfolipider finnes på nesten alle cellemembraner. Dette kan føre til flere patologiske prosesser (Knight JS, 2022):
- Aktivering av koagulasjonssystemet: Antifosfolipidantistoffer kan binde seg til koagulasjonsproteiner og aktivere dem unødvendig. Aktiverte endotelceller, trombocytter og celler fra myeloid-linjen, samt forstyrrelser i koagulasjonssystemer, øker risikoen for trombose.
- Nøytrofile ekstracellulære feller (NETs) og komplementsystemet påvirkes og kan utløse APS-trombose
- Hemming av fibrinolyse: Antifosfolipidantistoffer kan hemme nedbrytningen av blodpropp, noe som forverrer trombose.
- Utover akutt trombose kan pasienter med APS også utvikle en okklusiv vaskulopati, en langsiktig konsekvens av APS karakterisert ved celleproliferasjon og infiltrasjon som gradvis utvider intima og fører til organskader.
- Forstyrrelse av placentafunksjonen: Hos gravide kvinner kan antifosfolipidantistoffer forstyrre blodstrømmen til morkaken og føre til svangerskapskomplikasjoner.
Genetisk predisposisjon: Visse genetiske varianter er assosiert med en økt risiko for å utvikle APS.
Miljømessige faktorer: Infeksjoner, bruk av visse legemidler og hormonelle endringer kan utløse eller forverre APS hos personer med genetisk predisposisjon.
Epidemiologi
Forekomsten av APS varierer avhengig av populasjon og definisjonskriterier.
- En studie fra Rochester, USA, rapporterer en årlig insidens 2,1 per 100.000 og en prevalens på 50 per 100.000 (Duarte-Garcia A, 2019).
- Kjønnsfordelingen (kvinner : menn) er ved primær APS nær 1:1, mens ved SLE assosiert sykdom dominerer kvinner (10:1) (Dabit JE, 2021).
- APLS er sjelden blant barn. Gjennomsnittlig alder ved diagnose er ca. 50 år, men med store variasjoner (Dabit JY, 2022).
-
APS-antistoffer påvises hos en betydelig andel av pasienter med visse tromboemboliske hendelser og ved svangerskapskomplikasjoner (Gomez-Puerta J, Cervera R, 2014):
- Ca. 13% av pasienter med hjerneslag
- Ca. 11% av pasienter med myokardinfarkt
- Ca. 9,5% av pasienter med dyp venetrombose
- Ca. 6% av pasienter med svangerskapskomplikasjoner
Antistoff hos friske personer: Det er viktig å merke seg at tilstedeværelsen av APS-antistoffer ikke alltid betyr at en person har APS. Lave (uspesifikke) titere av antikardiolipin antistoff ar rapportert hos opp til 10% hos friske individer. Lupus antikoagulant som er mest spesifikk for tilstanden, ses derimot bare hos mindre enn 1% (Dabit JY, 2022).
-
Andre faktorer, som kliniske manifestasjoner og risikofaktorer, må også tas i betraktning ved diagnosen.
Sekundært APLS
Sekundært antifosfolipid antistoff syndrom ses ved:
Autoimmune sykdommer, hovedsakelig SLE der APS ble beskrevet først (Huges GR, 1983). SLE, ca. 40% har APS-antistoff, hvorav 50% to 70% utvikler APS over tid (Lim W, 2013). Mellom 7 og 15% med SLE antas å utvikle APS (Sayar Z, 2021). Andre assosiasjoner er sjeldnere og har ofte lavere og mindre signifikante titre:
-Infeksjoner assosiert med antifosfolipid antistoffer: Lues, HIV, Epstein-Barr virus, Borreliose, tuberkulose, febris rheumatica, malaria, hepatitt-C.
-Malignitet og antifosfolipid antistoff: Tromboembolier opptrer generelt hyppigere ved cancer og forekomst av antifosfolipid antistoff øker risikoen både ved hematologisk malignitet og solide tumorer (Gomez-Puera JA, 2016).
-Medikamenter og antifosfolipid antistoffer: Prokainamid, orale prevensjonsmidler.
–Diverse tilstander hvor antifosfolipid antistoff er beskrevet å forekomme (med ulike insidens):
- -Budd-Chiaris syndrom gir abdominalsmerte, ascites og leversvikt på grunn av tromboser i portalvenen og levervenene.
- -CAPS (Katastrofalt antifosfolipid syndrom) multiple arterielle tromboser i flere organsystem samtidig. Meget alvorlig med opp mot 50 % letalitet (vennligst les mer nedenfor i dette kapittelet),
- -Diabetes
- -Dialyse
- -Crohns sykdom
- -Evans syndrom utgjøres av trombocytopeni og hemolytisk anemi. Noen av disse pasientene har antifosfolipid antistoff. HELLP syndrom (svangerskap): hemolyse, forhøyde leverenzymer, trombocytopeni og antifosfolipid antistoff, revmatoid artritt, Sjøgrens syndrom,
- -Sneddons syndrom som består av multiple cerebrovaskulære katastrofer, hypertensjon og utbredt livedo reticularis. Genmutasjonen som foreligger er identisk med CECR1 som også forårsaker et lignende sykdomsbilde (med slag og hudforandringer) blant barn (DADA2, juvenil PAN), svangerskap (vennligst les mer nedenfor), thyreoiditt, ulcerøs kolitt, vaskulitt (systemisk).
Sykdomsmanifestasjoner
Antifosfolipidsyndrom (APS) kan manifestere seg på en rekke måter, og de vanligste symptomene er tromboser og embolier, kutane manifestasjoner, nyreproblemer, lungeproblemer og revmatiske symptomer (Cervera R, 2002).
Dyp venetrombose (DVT) er relativt vanlig, oftest i en underekstremitet. Symptomer kan inkludere:
- Smerter, hevelse, rødhet og varme i det berørte beinet
- Følelse av tyngde eller ubehag i beinet
- Hudforandringer i det berørte beinet, som kan bli rødt eller blått
- Feber i noen tilfeller
Tromboemboli er en alvorlig tilstand der en trombe løsner fra sitt opprinnelsessted og reiser gjennom blodomløpet til et annet sted der den kan blokkere blodstrømmen. Dette kan føre til alvorlige og potensielt livstruende komplikasjoner. Hvor tromben havner avgjør symptomene (Biggioggero M, 2010):
-Lungeemboli: Den vanligste typen, der tromben havner i lungene. Symptomer kan inkludere:
- Plutselig tungpustethet
- Brystsmerter (kan være skarpe eller knugende)
- Hoste, ofte med blodig oppspytt
- Rask hjertefrekvens
- Svimmelhet eller besvimelse
–Myokardinfarkt. Blodpropp blokkerer en blodåre i hjertet. Symptomer kan inkludere:
- Brystsmerter (kan være skarpe, knugende, brennende eller føles som ubehag)
- Smerter i armer, skuldre, nakke, kjeve eller mage
- Kvalme eller oppkast
- Kortpustethet
- Svette
- Følelse av angst eller dødsangst
-Hjerneslag/apopleksi: Blodpropp blokkerer en blodåre i hjernen. Symptomer kan inkludere:
- Plutselig nummenhet eller svakhet i ansikt, arm eller ben, vanligvis på én side av kroppen
- Forvirring eller vansker med å snakke eller forstå tale
- Problemer med å se med ett eller begge øyne
- Gangproblemer
- Hodepine (kan være alvorlig)
- Svimmelhet eller besvimelse
-Tromboser og embolier kan også ramme andre organer:
- Aortabuen (vertigo, slag, klaudikasjon)
- Armer (subklavia, aksillær)
- Cerebrale sinus (hodepine)
- Binyrer (binyreinfarkt)
- Ekstremiteter (okklusjoner i ekstremiteter; klaudikasjon)
- Huden (se nedenfor)
- Lever (levernekrose)
- Nyrer (nyreinfarkt, hypertoni)
- Tarmarterier (postprandiale abdominale smerter (abdominal angina))
- Vena cava (Budd-Chiari syndrom)
- Vena cava inferior (ødemer i begge underekstremiteter)
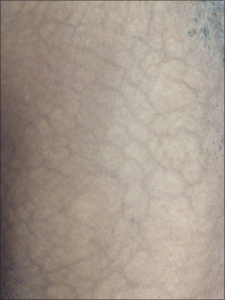
Hudmanifestasjoner forekommer hos opptil 50 % av pasientene og kan være tilstede ved sykdomsdebut hos 30 %.
- Livedo reticularis er den vanligste hudlesjonen, spesielt hos kvinner og presenterer seg som et fiolett og retikulært utslett. Noen mener at livedo reticularis oftere forekommer hos pasienter med cerebrale og okulære arterielle manifestasjoner.
- Livedo reticularis skilles fra cutis marmorata som likner, men opptrer som et generalisert utslett og ikke relatert til sykdom.
- Overfladisk tromboflebitt er sjelden (<2%) (Pinto-Almeida T, 2013).
Nyrene kan rammes av trombotisk mikroangiopati, nyrevenetrombose, nyreinfarkt, nyrearteriestenose og malign hypertensjon (Turrent-Cariles A, 2018).
Lungeblødning (kapillaritt) er en sjelden komplikasjon. Lungeemboli og/eller pulmonal hypertensjon må alltid vurderes ved dyspne. Pumonale mikrotromber er ikke uvanlige og kan være vanskelige å diagnostisere. Lungemanifestasjonene kalles ofte APL lungesyndrom (Stojanovich L, 2006).
Revmatiske symptomer.
Leddsmerter (artralgi) forekommer hos ca. 10%, men er vanligere når antifosfolipidsyndrom er sekundært til SLE (artralgi hos ca. 30%). Artritt ses hos ca. 3% med primært antifosfolipid syndrom, men hos 30% ved assosiert SLE.
Undersøkelser
Undersøkelsene har som mål å bekrefte diagnosen, kartlegge sykdommens omfang og risiko for tromboemboliske hendelser.
Anamnesen etterspør tidligere tromboembolier, venetromboser og svangerskapskomplikasjoner (spontanabort, dødfødsel, prematur fødsel), samt tegn på systemisk lupus og andre aktuelle symptomer (se ovenfor). Risikovurdering for tromboemboliske hendelser: alder, kjønn, røyking, hyperkolesterolemi, diabetes mellitus, hypertensjon, type og titer av antifosfolipidantistoffer
Klinisk gjøres en grundig generell undersøkelse med tanke på tromboser og eventuelle assosierte sykdommer.
Laboratoriediagnostikk
Rutineprøver kan omfatte: Hb, trombocytter, leukocytter, koagulasjonsstatus (D-dimer), nyrefunksjon (kreatinin, eGFR), leverfunksjon, thyreoideafunksjon, autoimmune antistoffer (ANA, RF) og urin-stiks.
- Trombocytopeni vanlig (20-50%), men er oftest moderat (75-100 000) og uten signifikant klinisk betydning (Artim-Esen B, 2015).
- Leukopeni ses hos ca. 2%, vanligere ved samtidig SLE (14%).
- Hemolytisk anemi er sjelden (<2%) ved primært antifosfolipid syndrom.
Immunologiske prøver
- Lupus antikoagulant (Hematologisk laboratorium) er forhøyet.
- Anti-kardiolipin IgG og IgM, hvorav signifikant forhøyet IgG tillegges mer vekt enn IgM.
- Anti-B2 glykoprotein 1, IgG og IgM.
- Antistoffene må påvises 2 ganger med 12 ukers intervall
- D-dimer øker ved trombose, emboli og DIC (> 0,4 μg/ml)
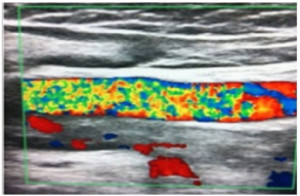
Bildediagnostikk:
- Ultralyd av vener og arterier
- CT eller MR-angiografi
- Ekkokardiografi
Vurdere behov for ytterligere utredning:
- Nevrologisk utredning: Ved mistanke om cerebrale tromboser
- Kardiologisk utredning: Ved mistanke om koronare tromboser eller pulmonal emboli
- Nefrologisk utredning: Ved mistanke om nyretromboser eller nefropati
- Psykososial vurdering: For å håndtere den psykiske belastningen ved en kronisk sykdom
Klassifikasjonskriterier
ACR/EULAR- 2023-kriterier (Barbhaiya, M, 2023):
- Minst et dokumentert klinisk kriterium som listet opp nedenfor (domene 1-6)
Pluss
- Positiv antifosfolipid antistoff (apL) test (en lupus antikoagulant test eller moderat-høyt-titret antikardiolipin eller anti-ß-glykoprotein-I-antistoff[IgG eller IgM]) innen tre år fra oppfylte kliniske kriterier.
Hvis ovenfor nevnte er fraværende skal en ikke mistenke ApLs. Hvis kriteriene foreligger, skal en anvende tilleggskriterier.
- Tilleggskriterier (kliniske og laboratorium): Ikke legg vekt på kliniske kriterier hvis en annen forklaring enn ApLs er minst like sannsynlig. Innen hvert domene skal bare det høyest vektede kriterium telles.
Totalskår: Klassifiser ApLs (for forskning) dersom det foreligger minst 3 poeng fra klinisk domener OG minst 3 poeng fra laboratoriedomener.
| Kliniske domener | vekting | vekting | |
|
D1. Makrovaskulær (venøs tromboemboli, VTE) |
D2. Makrovaskulær (arteriell trombose, AT) | ||
|
VTE med høy-risiko VTE profil |
1 | AT med høy-risiko CVD profil | 2 |
| VTE uten høy-risiko VTE profil | 3 | AT uten høy-risiko CVD profil | 4 |
| D3. Mikrovaskulær | D4 Obstetrisk | ||
| Mistenkt (en eller flere av følgende): Livedoid vaskulopati, akutt/kronisk aPL-neforpati, pulmonal blødning, myokardsykdom, binyreblødning | 2 | ≥3 påfølgende pre-føtale død (<10 uke) og/eller tidlig føtal død (10. uke og 0 dager eller -15 uker og 6 dager) | 1 |
| Etablert (en eller flere av følgende): Livedoid vaskulioapti, pulmonalblødning, Myokardsykdom, binyreblødning | 5 | Føtal død (16. uke og 0 dager- 33 uker og 6 dager i fravær av pre-eklampsi med alvorlige symptomer eller placentainsufficiens med alvorlige funn. | 1 |
| Pre-eklampsi med alvorlige funn (<34 uke og 0 dager) eller placentainsuffisiens med alvorlige funn (<34 uke og 0 dager) med eller uten føtal død. | 3 | ||
| Pre-eklampsi med alvorlige funn (<34 uke og 0 dager) og placentainsuffisiens med alvorlige funn (<34 uke og 0 dager) med eller uten føtal død. | 4 | ||
| D5. Hjerteklaffer | D6. Hematologi | ||
| Fortykket | 2 | Trombocytopeni (lavest 20-130 x 109/L | 2 |
| Vegetasjoner | 4 |
| Laboratorie /aPL) domener og kriterier | vekting | Vekting | |
| D7. aPL test ved koagulasjonsbasert funksjonell assay (lupus antikoagulant test, LAC) | D8. aPL test ved “solid phase assay” (anti-cardiolipin antistoff (aCL) ELISA og/eller anti-ß2-glykoprotein-I antistoff, aß2-GPI ELISSA (persisterende) | ||
| Positiv LAC (en enkelt gang) | 1 | Moderat eller høy positiv (IgM) (aCL og/eller aß2-GPI) | 1 |
| Positiv LAC (persisterende) | 5 | Moderat positiv (IgG) (aCL og/eller aß2-GPI) | 4 |
| Høy positiv (IgG) (aCL eller aß2-GPI) | 5 | ||
|
Høy positiv (IgG) (aCL og aß2-GPI) |
7 |
- Vaskulær trombose
- En eller flere episoder med arterielle eller venøse eller små tromboser i hvilket som helst vev eller organ. Tromboser må påvises objektivt validerte ved kriterier. Ved histopatologisk påvist trombose skal det ikke foreligge tegn til inflammasjon i blodåreveggen.
- Svangerskapskomplikasjoner
- Uforklart foster-død en eller flere ganger av morfologisk normalt foster (ultralyd eller direkte undersøkelse) i svangerskaps-uke 10 eller senere eller
- En eller flere uforklarte premature fødsler av morfologisk normale nyfødte før svangerskapsuke 34 på grunn av 1) eklampsi eller alvorlig pre-eklampsi definert etter gjeldende standard, eller 2) påvist placenta-insuffisiens eller
- Tre eller flere uforklarte spontanaborter fortløpende før 10. svangerskapsuke uten at materne anatomiske eller hormonale unormale forhold foreligger. Kromosomale maternale eller paternale defekter skal ikke foreligge.
- Lupus antikoagulant i plasma ved to eller flere anledninger med minst 12 ukers avstand (men innen 5 år).
- Anti-kardiolipin antistoff IgG eller IgM i serum eller plasma i signifikant titer (ELISA >40 GPL eller MPL eller >99 persentil) ved minst 12 ukers avstand (men innen 5 år).
- Anti-beta2-glykoprotein IgG eller IgM i serum eller plasma (ELISA: i titer >99% persentil) ved to eller flere anledninger med minst 12 ukers avstand (men innen 5 år).
Differensialdiagnoser
Falsk positive anti-fosfolipid (APL) antistoff-tester forekommer hos opptil 9,4% av blodgivere. Diagnosen antifosfolipid syndrom (APLS) stilles derfor ikke bare basert på blodprøveresultater, og testen skal vise forendringer over tid. Test igjen etter tre måneder. Falsk negative tester (ingen utslag i testen selv om APLS foreligger) kan også foreligge, men antas å være sjelden: antistoff mot phosphatidylserin, phosphatidylinositol og prothrombin kan være årsaker.
Felles for differensialdiagnosene er at de kan gi tromboemboliske hendelser som er et sentralt trekk ved APS:
Venøs trombose
- Koagulopatier: Faktoranalyser: Medfødte eller ervervede mangler på koagulasjonsfaktorer kan gi økt blødningstendens, men noen kan også øke risikoen for trombose, som ved APS.
- Defekter i trombolysesystemet: Nedsatt fibrinolyse kan øke risikoen for trombose, som ved APS, men gir vanligvis ikke de samme autoantistoffene.
- Cancer/myeloproliferative sykdommer: Kreft og myeloproliferative sykdommer kan øke risikoen for trombose, og noen kan gi autoantistoffer som ligner på APS.
- Nefrotisk syndrom med proteintap: Tap av antitrombotiske proteiner i urinen kan øke risikoen for trombose, som ved APS.
Arteriell tromboemboli
- Atrieflimmer; Øker risikoen for tromboemboli, spesielt hjerneslag, og kan forveksles med APS hvis pasienten også har autoantistoffer.
- Myksom: En hjertetumor som kan gi emboliser, som kan ligne på tromboemboliske hendelser ved APS.
- Endokarditt: Betennelse i hjerteklaffene som kan gi emboliser og trombose, som kan forveksles med APS.
- Kolesterolemboli: Kolesterolkrystaller kan løsne fra aterosklerotiske plakk og forårsake emboliser, som kan ligne på tromboemboliske hendelser ved APS.
- Myokardinfarkt med ventrikulær trombose: Trombose i venstre ventrikkel etter hjerteinfarkt kan gi emboliser, som kan forveksles med APS.
- Dekompresjonssykdom (Caissons sykdom); Gassbobler i blodet kan forårsake emboliser og iskemi, som kan ligne på tromboemboliske hendelser ved APS.
- Trombotisk trombocytopenisk purpura/hemolytisk uremisk syndrom; Disse tilstandene gir trombocytopeni og mikroangiopatisk hemolytisk anemi, som kan forveksles med katastrofalt APS.
- Hjerneslag hos barn: DaDa-2 /juvenil PAN: Betennelse i blodkar hos barn kan gi hjerneslag, som kan forveksles med APS.
- Sneddons syndrom (overlapp mot DaDa2): En tilstand med livedo reticularis og økt risiko for trombose, som kan ligne på APS.
- TIA/slag (diffusjonsvektet MR kan vise cerebral iskemisk skade): Kan være et symptom på APS, men kan også ha andre årsaker.
Kombinert venøs og arteriell okklusjon
- Defekt trombolyse (dysfibrinogenemi eller plasminogen aktivator mangel); Nedsatt fibrinolyse kan øke risikoen for trombose, som ved APS.
- Degos syndrom; En sjelden vaskulitt med hud- og organmanifestasjoner, som kan gi trombose og ligne på APS
- Homocysteinemi: Forhøyet homocysteinnivå øker risikoen for trombose, som ved APS.
- Myeloproliferative sykdommer; Kan gi økt risiko for trombose og noen ganger autoantistoffer, som kan ligne på APS.
- Polycytemia vera (hyperviskositet): Økt antall røde blodlegemer kan øke risikoen for trombose, som ved APS.
- Paroksymal nocturnal hemoglobinuri: En sjelden blodsykdom med økt risiko for trombose, som kan forveksles med APS.
- Waldenstrøms makroglobulinemi; En type lymfom som kan gi hyperviskositet og økt risiko for trombose, som ved APS.
- Sigdcelle-sykdom; Kan gi trombose og vaskulære komplikasjoner, som kan ligne på APS.
- Vaskulitt-sykdommer; Betennelse i blodkar kan gi trombose og ligne på APS.
- Paradoksal emboli; En embolus fra venesystemet kan krysse over til arteriesystemet gjennom en åpning i hjertet, og gi symptomer som ligner på APS.
Kreftsykdom Økt risiko for tromboser ved kjent og ukjent kreft som kan være et initialt symptom før diagnose, og kan forveksles med APS.. En begrenset malignitetsutredning er anbefalt ved trombose uten kjent årsak.
Andre årsaker til tromboembolier
- Protein S mangel
- Protein C -mangel
- Faktor V Leiden
- Protrombin genmutasjon
- MBL-mangel
Litteratur: Emmi G 2014
Behandling av APS
Beslutning om å starte antikoagulasjonsbehandling hos pasienter med APS er kompleks og krever nøye vurdering av flere faktorer. Risikofaktorer for tromboembolisk sykdom, inklusiv type og titer av antifosfolipidantistoffer og svangerskapsplaner, men også medikamentell etterlevelse, annen medisinering, blødningsrisiko og pasientens preferanser og ønsker bør vurderes.
Generelt om trombosehemmende medikamenter Acetylsalicylsyre (ASA) hemmer syntesen av tromboksan gjennom hemming av cyklooksygenase I (COX-1). Gir moderat hemming av trombocyttaggregasjonen (platehemmer). DOAK. Direkte virkende antikoagulantia (DOAK): Apiksaban og rivaroksaban hemmer koagulasjonsfaktor Xa direkte og hemmer omdannelsen av faktor II (protrombin) til faktor IIa (trombin). Dabigatran etexilate hemmer trombin direkte og hindrer omdannelsen av fibrinogen til fibrin (Helsebiblioteket ).
Anbefalte antikoagulasjonsmidler ved APS:
- Heparin øker antitrombins inaktivering av faktor Xa og trombin. Hemmer altså koagulasjon. Antidot er protamin. Monitoreres med APTT eller ACT. Dosering avhenger av indikasjon (tromboseprofylakse eller behandling): ved DVT gis initialt 150 IE/kg, deretter 400 IE/kg i døgnet. Som tromboseprofylakse 70 IE/kg x 1-2 per døgn.
- Lavmolekylært heparin / (Fragmin, Klexane) har samme virkningsmåte som Heparin, men lengre virkningstid og gir sjeldnere bivirkninger som trombocytopeni og osteoporose. Monitoreres vanligvis ikke. Dosering 200 IE/kg/døgn – ved tromboseprofylakse 100 IE/kg/døgn.
- Marevan (warfarin). Warfarin er en K-vitaminantagonist som hemmer dannelsen av koagulasjonsfaktorene II, VII, IX, X, samt protein C og S. Dosering justeres basert på INR-målinger. Startdose kan være 7,5-10 mg daglig i 2-3 dager. Monitoreres med TT eller INR. -Økt respons på Marevan kan forårsakes av endogene faktorer som bloddyskrasier, kreft, koronarsykdom, diare, feber, leverdysfunksjon og hypertyreose. Eksogene faktorer, som dårlig ernæring, kan også gi økt warfarin respons. -Redusert warfarin respons sees ved ødem, hyperlipidemi, hypotyreose, nefrotisk syndrom og eksogene faktorer som medikamenter og økt Vit K tilførsel. Streptokinase danner et kompleks med plasminogen og plasmin og gir økning av plasmin som bryter ned fibrin.
- Direktevirkende orale antikoagulantia (DOAK) anbefales ikke ved APLs fordi de ikke hindrer tromboembolier i tilstrekkelig grad, spesielt ikke arterielle hendelser (Adelheim JBH, 2023).
Forebygging
Det er essensielt å redusere risiko for tromboembolier. Supplerende risikofaktorer som hypertensjon, hyperlipidemi, høy homocystein bør korrigeres. Røking og bruk av østrogenholdige orale prevensjonsmidler unngås (genstagen p-piller kan brukes). Behandlingen kan bygge på anbefalinger publisert av EULAR i 2019 (Tektonidou MG, 2019).
Retningslinjer, anbefalinger og prosedyrer
A. Ved høy-risiko APL profil: Profylakse med ASA 75-100mg/d
B. Ved lav-risiko vurderes profylakse med ASA 75-100mg/d
3. Blant ikke-gravide med tidligere svangerskaps-komplikasjoner (med eller uten SLE) anbefales ASA 75-100mg/d profylaktisk etter adekvat vurdering av risk/nytte. Sekundær trombe-profylakse ved APS 4. Blant pasienter med sikkert APS og første venøse trombose:A. Behandling med Marevan og INR 2–3 anbefales
B. Rivaroxaban (et DOAK) bør ikke brukes ved trippel positiv APL antistoff på grunn av risiko for nye tromboser. DOAK kan vurderes hvis INR-målet ikke er mulig å oppnå til tross for god medikamentoppfølging eller ved kontra-indikasjoner for Marevan (allergi, intoleranse).
C. Blant pasienter med spontan første venøse trombose bør lang tids behandling anti-koagulasjon gjennomføres.
D. Blant pasienter med provosert første venetrombose (risiko-adferd) bør behandlingen kontinueres med samme varighet som for dem uten APS og i henhold til internasjonale retningslinjer. Lengre antikoagulasjon kan vurderes blant pasienter med høy-risiko APL profil eller andre risiko-faktorer for ny trombose.
5. Hos pasienter med sikkert APS og tilbakevendende venøse tromboser til tross for behandling med Marevan og INR 2-3:A. Undersøk compliance/etterlevelse for behandlingen, vurder pasientopplæring og hyppige INR målinger.
B. Hvis behandlingsmålet på INR 2-3 var oppnådd, vurder å legge til ASA 75-100mg/d eller skifte til lavmolekylært heparin.
6. Pasienter med sikker APS og første arterielle trombose:A. Behandling med Marevan er anbefalt fremfor bare lavmolekylært heparin.
B. Behandling med Marevan med INR 2-3 eller INR 3-4 er anbefalt, avhengig av individuell risiko for blødning og tilbakevendende trombose. Behandling med Marevan med INR 2-3 i kombinasjon med ASA 75-100mg/d kan også vurderes.
C. Rivaroxaban (et DOAK) bør ikke brukes av pasienter som er trippel positive for APL og har hatt arterielle episoder. Basert på nåværende kunnskap anbefalers ikke DOAK hos pasienter med sikkert APS og arterielle episoder på grunn av høy risiko for residiverende trombose.
7. Blant pasienter med tilbakevendende arterielle tromboser til tross for adekvat behandling med Marevan, etter evaluering av andre årsaker og økning av INR til 3-4, kan supplering med ASA 75-100mg/d eller overgang til lavmolekylært heparin vurderes. Svangerskap. 8. Blant kvinner med en høy-risiko APS profil, men uten anamnestisk trombose eller svangerskaps-komplikasjoner (med- eller uten SLE) vurderes behandling med ASA 75-100mg/d under svangerskap. 9. Blant kvinner med APS relaterte svangerskaps-komplikasjoner, men uten tidligere tromboser (med- eller uten SLE): A. Dersom tidligere ≥3 tilbakevendende spontanaborter gis kombinasjonsbehandling med lavdose ASA og heparin i profylaktisk dose gjennom svangerskap. B. Ved tidligere tidlig-fødsel før svangerskapsuke 34 på grunn av eklampsi, alvorlig preeklampsi eller påvist placenta-insuffisiens anbefales profylaktisk behandling med ASA 75-100mg/d alene eller i kombinasjon med lavmolekylært heparin, basert på individuell risikoprofil. C. Hvis obstetrisk APS ikke helt oppfylles, slik som ved to spontanaborter før svangerskapsuke 10 eller fødsel ≥ uke 34 på grunn av alvorlig pre-eklampsi eller eklampsi kan behandling med ASA alene eller i kombinasjon med lavmolekylært heparin vurderes basert på individuell risikoprofil. D. Obstetrisk APS behandlet profylaktisk med lavmolekylært heparin i svangerskap bør vurderes kontinuert i 6 uker post-partum for å redusere risiko for matern trombose. 10. Blant kvinner som fyller kriteriene for obstetrisk APS med tilbakevendende svangerskaps-komplikasjoner tross kombinasjonsbehandling med ASA og lavmolekylært heparin i profylaktiske doser vurderes høyere heparin-dose opp mot terapeutiske doser eller supplement med hydroksyklorokin (Plaquenil) eller lav-dose prednisolon i første trimester. Intravenøs immunglobulin kan vurderes i svært utvalgte tilfeller. 11. Hos kvinner med tidligere trombotisk APS anbefales en kombinasjon av ASA og lavmolekylært heparin i terapeutiske doser i svangerskap.Obstetrisk antifosfolipid syndrom med spontanaborter eller fosterdød skyldes en eller flere sykdomsassosierte faktorer: Tromboser i placenta, komplement-aktivering, påvirkning av trofoblast-vekst (cellelaget som omgir embryoblasten) og differensiering, samt redusert trofoblast-invasjon og hormonproduksjon. Ved høy spontanabort-risiko vurderes ASA i lav dose, for eksempel 75mg/døgn, initiert allerede før konsepsjon (Skorpen CG, 2021). Seponering 3 uker før forventet fødsel kan være aktuelt dersom Fragmin/Klexane/lavmolekylært heparin benyttes samtidig. Fragmin/Klexane/lavmolekylært heparin stanses minst 10 timer før fødselsinduksjon eller keisersnitt, men kan startes igjen 6-8 timer etter fødsel eller keisersnitt (NKSR). Se info også om antikoagulantia, og om antifosfolipid syndrom fra NKSR
Katastrofalt antifosfolipid syndrom (CAPS)
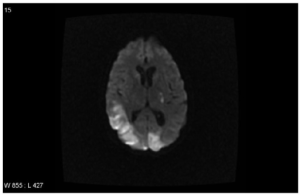
Definisjon av CAPS. Katastrofalt antifosfolipidsyndrom (CAPS) er en sjelden, men livstruende komplikasjon av antifosfolipidsyndrom (APS). Den er preget av et plutselig og raskt forløpende angrep på flere organer samtidig, forårsaket av tromber i små blodkar (“trombotisk storm”).
CAPS forekommer i ca. 1% ved APS (Cervera R, 2005).
Symptomer på CAPS kan variere avhengig av hvilke organer som er rammet, men kan inkludere:
- Feber
- Forvirring
- Endret bevissthetsnivå
- Smerter i brystet
- Pustevansker
- Lavt blodtrykk
- Blod i urin eller avføring
- Hudutslett
- Ikterus
Diagnose av CAPS stilles basert på en kombinasjon av symptomer, blodprøver og bildediagnostikk. Det er viktig å utelukke andre sykdommer og syndromer som kan gi lignende symptomer.
| Differensialdiagnoser for CAPS (Kazzaz, NM, 2016) | ||||||
| CAPS (catastrophic antiphospholipid syndrome) | TTP-HUS (TTP, thrombotic thrombocytopenic purpura; HUS, hemolytic uremic syndrome) | DIC (disseminated intravascular coagulation) | HELLP (hemolysis, elevated liver enzymes, low platelets) | SRC (scleroderma renal crisis) | HIT (Heparin indusert trombocytopeni) | |
| Mikrovaskulær trombose | + | + | + | + | + | – |
| Makrovaskulær trombose | + | – | – | + | – | + |
| Blødning | – | – | + | +/- | – | – |
| Multiorgansvikt | ++ | +/- | +/- | +/- | – | – |
| Nyresvikt | +/- | ++ | – | +/- | ++ | – |
| Redusert mentalt | +/- | +/- | – | +/- | – | – |
| Lungesykdom (ARDS) | ++/- | – | +/- | +/- | – | – |
| Hjertesykdom (Infarkt, svikt) | +/- | – | – | – | – | – |
| Svangerskap | +/- | – | +/- | + | – | – |
| Infeksjon | +/- | +/- | +/- | – | – | – |
| Malignitet | +/- | – | +/- | – | – | – |
| Hemolytisk anemi | +/- | ++ | +/- | + | + | – |
| Schistocytter | +/- | ++ | +/- | + | + | – |
| Trombocytopeni | +/- | ++ | + | + | +/- | ++ |
| Forlenget PTT | +/- | – | + | – | – | – |
| Fibrinogen | Normal | Normal | ↓ | Normal | Normal | Normal |
| Leverenzymer | ↑ | Normal | Normal | ↑↑ | Normal | Normal |
| APL (>40 U/ml) | ++ | – | – | – | – | – |
| ADAMTS13 | Normal | ↓↓↓ | ↓ | Normal | Normal | Normal |
| Anti-PF4 | – | – | – | – | – | ++ |
Klassifikasjonskriterier for CAPS
- Påvist affeksjon av tre eller flere organer, organsystemer eller vev (oftest okkluderte blodårer og nyre-manifestasjon/alvorlig hypertoni)
- Utvikling av manifestasjoner samtidig eller i løpet av en uke
- Histologisk okklusjon i små blodkar i minst ett organ eller vev
- Laboratorieprøver: Lupus antikoagulant, og/eller anti-kardiolipin antistoff (hvis ikke kjent APS skal positive prøver foreligge ved to anledninger med minst 6 ukers intervall)
- Alle fire kriterier, bortsett fra at bare to organer/organsystemer/vev affiseres.
- Alle fire kriterier, bortsett fra at laboratorieprøvene ikke er bekreftet etter minst 6 uker (grunnet ikke testet før eller død)
- 1, 2 og 4
- 1,3 og 4 og utvikling av en tredje manifestasjon etter mer en en uke, men mindre enn en måned, til tross for antikoagulasjon.
Behandling av CAPS
Behandlingen av CAPS er rettet mot å stoppe dannelsen av blodpropper og forhindre organskade. Den inkluderer vanligvis:
- Høydose kortikosteroider
- Antikoagulantia
- Plasmaferese (fjerning av antistoffer fra blodet)
- Eculizumab (en komplementhemmer)
A. Umiddelbar behandling av infeksjoner hos alle APL-positive individer og minimaliser avbrudd i antikoagulasjons-behandling eller for lav INR hos pasienter med trombotisk APS for å hindre utvikling av CAPS.
B. Som første-linje behandling ved CAPS anbefales en kombinasjon med glukokortikoid, heparin og plasmaferese eller intravenøs immunglobuliner fremfor ett enkelt medikament eller andre medikament-kombinasjoner. I tillegg bør alle utløsende faktorer som infeksjoner, gangren eller malignitet behandles. Blant pasienter med refraktært CAPS kan B-celle hemming (rituksimab) eller komplement-hemmer (eculizumab) vurderes.
Prognose
CAPS. Prognosen for CAPS er avhengig av hvor raskt diagnosen stilles og behandlingen settes i gang. Med rask og riktig behandling kan mange med CAPS overleve og komme seg fullstendig.
APLS. Mortaliteten generelt er økt når antifosfolipid syndrom er assosiert med SLE (Cervera R, 2002). En retrospektiv russisk studie viste at 8 års overlevelse ved SLE uten antifosfolipid syndrom var 98% sammenlignet med 75% ved SLE med sekundært APS og 83% ved primært antifosfolipid syndrom (Reshetniak TM, 2003). Vanligste dødsårsaker er alvorlige tromboembolier (slag, myokardinfarkt, lungeemboli) eller CAPS (Cervera R, 2002).
Svangerskap ved antifosfolipid syndrom
Alvorlige komplikasjoner i svangerskap
Svangerskap ved antifosfolipidsyndrom (APS) kan medføre betydelige komplikasjoner, både for mor og barn, men med riktig oppfølging og behandling kan man oppnå gode resultater for både mor og barn. Det er imidlertid viktig å være klar over risikofaktorer og tilgjengelige behandlingsalternativer. I 20-30% av tilfellene ser man alvorlige komplikasjoner (Schreiber K, 2019), som:
- Tidlig eller sent fostertap
- Premature fødsler
- Preeklampsi
- Eklampsi
- HELLP-syndrom
- Placenta-ruptur
I EURO-fosfolipid-prosjektet som begynte i 1999 ble 1000 uselekterte pasienter med APS evaluert. Tidlig-fødsler forelå hos 72,3%, intrauterin vekthemming hos 51,1% som indikerer høyere risiko enn for SLE (Cervera R, 2002).
Disse historiske data viser komplikasjonsraten den gang. Imidlertid har behandling og oppfølging endret seg betydelig i ettertid, slik at bedre resultater ved oppfølging oppnås nå.
Pasienter med APLS følges uansett opp som «risikosvangerskap» der gynekolog/fødselslege og hematolog samarbeider. Ved sekundært APLS (hvis også SLE, Sjøgrens eller annen revmatisk sykdom foreligger) samarbeider en med revmatolog.
Risikofaktorer
Flere faktorer øker risikoen for komplikasjoner i svangerskap ved APS:
- Antistoffnivåer: Høye nivåer, særlig av av lupus antikoagulant, men også kardiolipin antistoff og beta-2 glykoprotein er assosiert med økt risiko.
- Trippel positivitet: Forekomst av alle tre antistoffene (trippel positivitet) gir høyest risiko.
- IgG antistoff: Høye nivåer av IgG antistoff er mer betydelige enn IgM nivå.
- Tidligere komplikasjoner: Kvinner som har hatt komplikasjoner i tidligere svangerskap har økt risiko for gjentakelse.
Behandling og oppfølging i svangerskap
Pasienter med APS følges opp som “risikosvangerskap” av et tverrfaglig team bestående av gynekolog/fødselslege, hematolog og revmatolog (ved sekundært APS). Behandlingen har som mål å forebygge trombose og dermed redusere risikoen for komplikasjoner. Risiko for tromboemboli er uansett økt i svangerskap og i ukene etter fødsel. Den gravide kan få tromboembolier som dyp venetrombose (DVT), lungeemboli eller slag. Fosteret kan rammes via blodpropper i placenta og dermed økt risiko for abort eller dødfødsel.
Forebyggende tiltak:
- Antikoagulantia: Heparin og lavmolekylære hepariner brukes ofte under svangerskap. Acetylsalisylsyre (ASA, Albyl-E 75 mg/dag) kan også være aktuelt. Marevan må imidlertid ikke brukes under svangerskap på grunn av økt risiko på ca 6% for fosterskade ved bruk etter svangerskaps uke 9 (warfarin-embryopati; Wainwright H, 2010). Direktevirkende antikoagulantia (DOAK) anbefales heller ikke, fordi økt rate spontanaborter og misdannelser ikke kan utelukkes (Beyer-Westendorf J, 2020). En bør imidlertid være klar over at antikoagulantia kan begrense mulighet for epidural anestesi ved fødsel. Etter fødsel kan en etter 2-3 uker vurdere å starte Marevan igjen (hvis brukt før svangerskap). INR nivå kan variere og skape doseringsproblemer kort tid etter fødsel. Alternativt brukes Fragmin eller Klexane ca. 6 uker etter fødsel.
- Plaquenil (hydroksyklorokin): Kan ha en blodproppforebyggende effekt og kan brukes under svangerskap. Data tyder på at Plaquenil kan redusere nivået av SSA/B antistoff som en tilleggseffekt, også under svangerskap (Sciascia S, 2015).
Ved alle spontanaborter må andre årsaker også vurderes og avdeling med spesiell kompetanse konsulteres ved gjentatte spontanaborter.
Ved “behandlingsresistent” antifosfolipidsyndrom, har en i noen tilfeller sett nytte av supplerende behandling med Prednisolon 10mg/dag frem til svangerskapsuke 14 og på spesielle indikasjoner som alvorlig placentasvikt og preeklampsi har pravastatin 20mg/dag, intravenøs immunglobuliner (2g/kg kroppsvekt pr. måned) og / eller plasmautskiftning (plasmaferese) også vært brukt ved spesialavdelinger som utprøvende behandling (Uthman I, 2019; Ambati A, 2023).
Katastrofalt antifosfolipid syndrom (CAPS) og svangerskap)
CAPS kan debutere under svangerskap og er forbundet med økt risiko for mors liv. Tilstanden kjennetegnes ved rask, dramatisk utvikling (innen mindre enn 1 uke) og at flere organer angripes samtidig (multiorganaffeksjon). Behandling kan være nødvendig for å redde mor, selv om det kan skade fosteret. Uvanlig høye doser av antikoagulantia, IVIG, kortikosteroider og/eller Plaquenil kan brukes. Plasmautskiftning (plasmaferese) kan også være aktuelt.
