VASKULITT (REV 034-052)
82 Behcets sykdom (REV 034)
Ragnar Gunnarsson
Kjennetegn på Behçets sykdom
Anamnese må suppleres med klinisk undersøkelse der en ser bl.a. etter; orale og genitale sår, akne eller erytema nodosum hud funn og uveitt eller andre øye-manifestasjoner.
Det foreligger ingen spesifikke immunologiske tester eller entydige histologiske forandringer med mulighet for over-diagnostisering.
Diagnosekoder ICD-10: M35.2 Behcets.; K12.0 Aftøs stomatitt (ikke Behcets)
ATC koder (for legemiddelstatistikk): Prednisolon: H02A B06 Immunsuppressive legemidler: L04A A
Definisjon
Sykdomskomplekset Behçets sykdom («Behçet’s disease» (BD)) er nå av fleste nevnt Behçets syndrom (BS) og begrepene sykdom og syndrom går om hver andre i medisinsk litteratur når man omhandler sykdomskomplekset. Det er ikke påviste autoantistoffer ved BS, som ved de fleste autoimmune bindevevssykdommer. BS er klassifisert som vaskulitt, men sykdomstilstanden har mer slektskap til autoinflammatoriske sykdommer og til pyoderma gangrenosum og andre nøytrofile dermatoser en andre vaskulittsykdommer.
BS gjenkjennes av tilbakevendende aftøse sår av slimhinner i munn og sår på ytre genitale, av hudaffeksjon, samt av øye– og eventuelt sentralnervesystemet. Sykdommen kan gi leddaffeksjon og kan affisere kar og pasientene kan utvikle vaskulær Behçets syndrom. Vaskulitt hos pasienter med Behçets sykdom kan påvirke arterier, arterioler, kapillærer, venoler og/eller vener. I den internasjonale konsensuskonferansen i Chapel Hill, i 2012, der nomenklatur og klassifikasjon for vaskulitt-sykdommer var bestemt var BS klassifisert som variabel kar vaskulitt (1).
Historikk
Pasienter med sannsynlig Behçets sykdom har vært beskrevet av selveste «medisinens far». den greske Hippokrates fra Kos (460 – 377 f.Kr.). Første beskrivelsen av tilstanden er tilegnet professor Hulusi Behçet (1889–1948) som var professor i dermato-venerologi ved Universitet i Istanbul i Tyrkia som ble publisert 1937 i Dermatologische Wochenschrift. Der han definerte symptomer i form av aftøse slimhinnesår i munn, genitale sår og hypopyon uveitt.
Kriterier for diagnose
Det finnes to internasjonale kriteria som brukes ved forskning på BS. De første er fra 1990, Criteria for diagnosis of Behcet’s Disease av International Study Group for BS og refereres til som ISG kriteriene (se Tabell 1) (2). Det andre mest brukte kriteria for BS er fra 2013, The New International Criteria for Behcet’s Disease og er oftest forkortet til ICBD kriteriet (se tabell 2A og 2B) (3).
ICBS kriteria for BS har estimert sensitivitet på 94,8%, som er betydelig høyere enn for de opprinnelige ISG-kriteriene som er 85,0%. Spesifisiteten til ICBS kriteriene er akseptabelt høyt på 90,5%, men lavere sammenlignet med ISG-kriteriene som angis å være 96,0%.
Tabell 1
ISG kriterier for diagnose av Behçets sykdom fra 1990 (2).
Minst tre episoder av orale after i løpet av ett år (og observert av helsepersonell)
Og minst to av følgende kriterier:
- Tilbakevendende sår i underliv observert av helsepersonell.
- Øye affeksjon (uveitt, retinal vaskulitt etc.) påvist av øyelege.
- Typiske hudforandringer observert av helsepersonell, og/eller erythema nodosum observert av pasient og/eller helsepersonell
- Positiv patergi-test avlest av helsepersonell etter 24-48 timer. En papel ≥2mm i diameter etter stikk med 20-gauge nålespiss 5mm inn i huden lest av etter 48 timer.
Tabell 2A
ICBS kriteria. The New International Criteria for Behcet’s Disease fra 2013 (3).
Når poengsum ≥ 4 indikerer Behçets syndrom/sykdom.
| Sign/symptoms | Poeng |
| Øye affeksjon | 2 |
| Genitale sår | 2 |
| Aftøse sår i munn | 2 |
| Hudlesjoner | 1 |
| Neurologiske manifestasjoner | 1 |
| Vaskulære manifestasjoner | 1 |
| Positiv patergi test* | 1* |
* Patergi test er valgfritt i kriteriene og den primære poengsummen inkluderer ikke patergi testing.
Når patergi testing utføres, kan et ekstra poeng tildeles for et positivt resultat.
Tabell 2B
ICBS kriteria. The New International Criteria for Behcet’s Disease fra.
Konklusjon fra poengsum.
| Poengsum | Plausibilitet av BS | Forenklet klassifikasjon |
| ≤ 1 | Ikke BS | Ikke BS |
| 2 | Usannsynlig BS | Ikke BS |
| 3 | Mulig, men usannsynlig BS | Ikke BS |
| 4 | Sannsynlig BS | BS |
| 5 | BS meget sannsynlig | BS |
| ≥ 6 | Nærmest sikker BS | BS |
Vurdering av sykdomsaktivitet og livskvalitet ved Behçets syndrom
Behçets sykdoms-livskvalitet (BD-QoL) ble opprettet for å måle effekten av BS på pasientens daglige liv og fullføres av pasienten selv (4). Behçets aktivitetsskjema «The Behçet’s disease current activity form» representerer et verktøy for overvåking av sykdommen BS. Nåværende aktivitetsskjema fylles ut av lege sammen med pasienten (5).
Epidemiologi
Det er meget sterk genetisk fordeling av sykdommen der den er hyppig rundt Middelhavet og Japan, men BS er sjelden andre steder, inklusiv i Nord-Europa, Nord-Asia, i største deler av Afrika, Australia og Nord- og Sør-Amerika. Det er økt hyppighet av BS i befolkninger som har sitt opphav fra områder som ligger rundt den såkalte silkeveien, den oldtidens handelsrute mellom Europa og Kina. Det er anført at det er rundt 120 per 100.000 i Tyrkia (6). En studie fra Tyrkias største by, Istanbul har rapportert den høyeste prevalens tall som er kjent på 420 per 100.000 (7). Det er også høy prevalens på 31,8 i Midtøsten, mens i Sør-Europa på 5,3 og Nord-Europa på 2,1 og Asia rundt 4,8 per 100.000 som har BS (6). Det er anført relativ lik kjønnsdistribusjon av BS, men det ser ut til å være etniske forskjeller. Det er anført overvekt av menn i Midtøsten og overvekt av kvinner i Japan og Korea. Det ser også til å være forskjell i organmanifestasjon der gastrointestinal affeksjon er rapportert som svært hyppig over halvparten i Japan og Korea, mens dette er sjelden i Midtøsten og Tyrkia (8). Undersøkelse fra Mayo Clinic i Rochester, så insidens og prevalens av BS i Olmsted fylke i delstaten Minnesota over 45 år og fylte International Study Group (ISG) kriteriene. Olmsted fylke har hovedsak kaukasisk befolkning med stort innslag av skandinavisk befolkning. Insidens der var på 0,38 per 100 000 per år, det var over 2 ganger flere kvinner og prevalensen på 5,2 per 100 000 innbyggere, som er sammenlignbart med andre Europeiske populasjoner (9). Det var merket at på de årene som studien tok til økte antall innbyggere i Olmsted fylke fra Asia fra 0,2% til over 5%, men av de som fikk BS hadde nesten 1/3 opprinnelse fra Øst-Asia. Dette bekreftes også fra undersøkelse fra Skåne i Sør-Sverige publisert i 2012 der var prevalens på 4,9 per 100 000 voksne (10). BS var omtrent syv ganger hyppigere blant innvandrere og deres etterkommere på 13,6 mot 2,0 av 100 000 hos etniske svenske. BS var litt mer en dobbelt hyppigere hos menn og retrospektiv insidens var estimert til 0,2 per 100 000 voksne per år (10).
Patogenese og patologi
Histologi skiller ikke mellom benigne aftøse sår ved oral stomatitt («Recurrent aphthous stomatitis (RAS)») og histologi ved BS. I begge tilfeller er overtall av nøytrofile og mononuklære celler samt av CD4+ T-lymfocytter, samt noen få B-lymfocytter, NK celler og makrofager i lesjonen. Verken ved akneformet hudaffeksjon eller erythema nodosum ved BS skilles histologien seg fra vanlig akne eller fra erythema nodosum assosiert til andre tilstander. Vevsprøver av BS med vaskulitt viser nekrotiserende leukocytoklastisk obliterativ perivaskulitt og venøs trombose med lymfocytisk infiltrasjon av kapillærer, vener og arterier i alle størrelser. Cellulær infiltrasjon har ofte i en perivaskulær fordeling, med nøytrofile og CD4 + T-lymfocytter rundt i vasa vasorum. Rapport fra Rigshospitalet i København viste lav positiv patergi test på 7,7% (11) i Skandinavisk befolkning, som bekreftes ut fra erfaring her i Norge. Patergi reaksjon er en form av overreaksjon på små trauma. Histologisk ses blandet infiltrering av inflammatoriske celler oftest nøytrofile og/eller lymfocytter ofte med hevelse i endotel. Det kan sees forandringer forenelig med lobulær pannikulitt, i andre tilfeller perivaskulær celleinfiltrering, lymfocytisk vaskulær reaksjon, eller forandringer med vaskulitt. Behçets artritt viser histologisk i hovedsak nøytrofil synovial betennelsesreaksjon. Ikke granulomatøs panuveitt er karakteristisk for okulær BS. Leukocyttinfiltrasjon kan ses rundt blodkar og ved aktiv sykdom kan nøytrofile celler være til stede i øyets fremre kammer «hypopyon», samt i andre deler av øyet. Det er sterk genetisk assosiasjon ved BS og er knyttet til humane leukocyttantigener (HLA) spesielt HLA B51 og HLA-B5. Den samlede oddsforhold (OR) av bærere av allelet HLA B51/B5 for å utvikle BS sammenlignet med ikke-bærere var 5,8 og ser ut til å være uavhengig av etnisitet (12). Det ser også ut til at pasienter med HLA-B51 allelet har alvorligere sykdomstilstand.
Ved BS er endotel dysfunksjon og aktivering av endotel formidler betennelse samt trombose i kar. Dette ser ut til å være delvis formidlet via nitrogenoksid (NO). Patogenesen av trombose i BS skyldes sannsynligvis vaskulær skade forårsaket av endotel dysfunksjon eller betennelse. Det er utvilsomt at ved BS spiller både medfødt («innate») og adaptiv immunitet avgjørende betydning. Endret immunrespons for bakterier kan trigge immunrespons. Delvis kan det være patologisk respons på mykobakterielle «heat shock» proteiner. Det virker som antistoff immune respons spiller rolle, men det finnes ikke ett bestemt autoantigen ved BS. Anti-Saccharomyces cerevisiae antistoffer har blitt observert hos noen pasienter med BS, men dette er i grunn uspesifikk funn og sees ved andre sykdommer som inflammatorisk tarmsykdom og ankyloserende spondylitt.
Ved BS er polymorfonukleære leukocytter (PMN), nøytrofile, basofiler og eosinofiler, aktiverte og har økt motilitet. Det er økte nivå av cytokinene; TNF-alfa og interleukin-8 i sirkulasjonen. PMN celler har økt tendens til å feste seg på endotel som skylles delvis økt ekspresjon av celleoverflatereseptorer og adhesjonsmolekyler. Nøytrofile ekstracellulære feller «traps» (NETs) er nettverk av ekstracellulære fibre laget av nøytrofile celler og binder patogen. Sirkulerende nøytrofile fra pasienter med BS ser ut til å lage mer NETs.
Lave serumnivå av mannose bindende lektin (MBL), som en del av det medfødte immunforsvaret er assosiert til BS som ved autoimmune bindevevssykdommer. Nedsatt immunrespons mot mikroorganisme øker risikoen for infeksjon og påfølgende immunaktivering. Immunologisk aktivitet i BS er formidlet med blanding av T-hjelper 1 (Th1) og T-hjelper 2 (Th2) lymfocytter responser, med dominerende Th1-lymfocytte respons. Det har vært antydet at Th1 og Th17 responser er involvert aktive faser av sykdommen, mens Th2 respons kan ha innvirkning på sykdomsforløp og alvorlighetsgrad av sykdommen (13).
Ved BS er økt antall av Th1-lymfocytter, som produserer flere cytokiner som; IL-2, IL-6, IL-8, IL-12, IL-18, TNF-alfa og interferon gamma. Studier har vist at perifere mononukleære blodceller fra pasienter med BS viser økt forholdet mellom CD8+ og CD4+ lymfocytter, med reduksjon i av hemmende «suppressor»-T lymfocytter mest markant hos pasienter med aktiv BS som del av Th2 respons. Med økt produksjon av cytokinene; IL-4, IL-10 og IL-13. I tillegg sees forhøyede IL-26 nivåer via økt T-hjelper 17 (Th17) respons hos pasienter med BS.
Kliniske manifestasjoner av Behçets syndrom
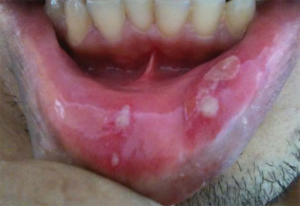
Tilbakevendende smertefulle orale sår rammer så å si nærmest alle med BS og er «sine que non» for diagnosen BS etter ISG kriteriene. Orale aftøse sår er oftest debuterende symptom for BS og kommer ofte flere år før andre manifestasjoner for sykdommen. Sårene kommer i munnslimhinne på innsiden av leppene, på tannkjøtt, rundt og på tungen og i ganen og kan også komme i orofarynks. I tillegg kan de også ramme neseslimhinnen. De er oftest runde eller ellipseformete med klar avgrensning og gråaktig sårbunn. Aftøse sår ved BS kan fra utseende ikke skylles fra benign aftøs stomatitt («recurrent aphthous stomatitis» (RAS) og histologi fra sår skiller ikke imellom (-> Differensialdiagnoser). Vanlig utvikling av orale sår ved BS er at sårene gror på 1-3 uker vanligvis uten arr. Sårene ved BS pleier å være små, fra få millimeter og er sjelden større 20 mm i diameter. Det er rapportert at på gruppenivå avtar sårutvikling etter mer enn 20 år med sykdommen. Det er negativ assosiasjon til orale sår og røyking der røyking virker beskyttende.
Sår på kjønnsorganer:
Sår på genitale er den nest hyppigst observerte opprinnelige manifestasjonen i BS som forekommer hos 60-90% av pasientene. De er betydelig mer spesifikke for BS enn orale sår. De ligner orale aftøse sår, men er oftest større og dypere og har mer oftest uregelmessige grenser og gror ofte med arrdannelse. De vises vanligvis på pungen, på penisskaft og sjelden på glans penis hos menn. Hos kviner er de oftest på vulva. Den viktigste differensialdiagnosen for kjønnssår inkluderer seksuelt overførbare sykdommer (-> Differensialdiagnoser). Pasienter kan også få epididymitt og salpingitt som følge av tilstanden
Kvise-lignende, papulopustulære lesjoner er de vanligste kutan manifestasjon av BS de ser ut til å være noe hyppigere hos kvinner. De papulopustulære lesjoner ligner morfologisk på akne (akne vulgaris) og har nærmest samme bakterieflora som ved akne og histologi skiller ikke imellom. Vanlig akne har oftest mest utbredt på øvre del av kroppen. Pasienter med BS og utbredte papulopustulære lesjoner har oftere synovitt.
Knuterosen, erythema nodosum, er ømme rød-blå hevelser på opp mot noen cm i diameter og forekommer oftest på ekstremiteter, da på legger og de kan komme og gå og flytte på seg. Det ses ofte inflammatoriske tegn med erythem og ødem rundt. Lesjonene er ofte mer uttalte ved BS enn man vanlig ser ved «klassisk» erythema nodosum. Histopatologisk funn kan avvike fra den typiske lymfohistiocytiske septum og/eller lobulær pannikulitt forandringene ses ved «klassisk» erythema nodosum og har ofte mer vaskulitt forandringer med subkutan nøytrofil infiltrasjon.
Overfladisk tromboflebitt i hud rammer pasienter med BS og kan ligne på erythema nodosum i utseende, men kan differensieres med ultralydundersøkelse. Overfladisk tromboflebitt er hypo-ekkoiske, mens erythema nodosum lesjoner er hyper-ekkoiske.
Overreaksjon på småskader som små stikk med intensivert hevelse og rubor med utvikling av pustler som kalles patergi reaksjon. Dette brukes ved utredningen med stikk-test (patergi-test) der positiv patergi-test er utvikling av pustel lesjon 48 timer etter stikk med 20 gauge nål. Det er klar genetisk forskjell på patergi reaksjon som er hyppig positiv hos tyrkiske pasienter, der det er anført mellom 50-75% med positiv patergi test. Patergi hudtest har her i Skandinavia både lav sensitivitet og lav spesifisitet. Rapport fra Rigshospitalet i København viste kun positiv patergi test hos 7,7% (11) i skandinavisk befolkning med BS, som bekreftes av egen erfaring her i Norge. Det er også vært å ha med seg at man kan få patergireaksjon hos pasienter med inflammatorisk tarmsykdom som viste at rundt hos 10,8% (10/93) pasienter med Crohns sykdom og 6,2% (8/130) pasienter med ulcerøs kolitt i en studie fra Tyrkia (18). Patergi reaksjon er ikke være påvirkelig av immunsuppresjon.
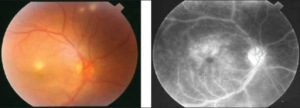
Øyeaffeksjon er hyppigere hos menn som også har dårligere prognose av BS hvis de får øyeaffeksjon. Forekomst av øyeaffeksjon er avhengig av etnisitet og forekommer hos 25-75% BS pasienter. Ubehandlet går utviklingen i fleste tilfelle til blindhet. BS i høyendemiske områder som i Tyrkia hyppigste årsaken for blindhet hos menn. Anfallsvis og bilateral uveitt er ofte det dominerende øyeaffeksjonen. Som oftest er dette pan uveitt ofte med vedvarende lavgradig inflammasjon mellom anfall. Det er viktig med oppfølging av øyelege med spaltlampe undersøkelse og mer avanserte metoder. Ubehandlet posterior uveitt, retinal vaskulitt og optisk neuritt vil svekke synet irreversibelt og kan medføre til blindhet.
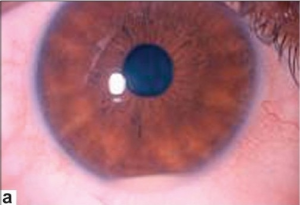
Hypopyon er en alvorlig fremre uveitt med oppsamling av purulent materiale i det fremre kammeret er karakteristisk ved BS og rammet de første tre pasientene som ble beskrevet av professor Hulusi Behçet i sin tid.
Affiserer cirka 50% av pasienter med BS. Forårsaker vanligvis intermitterende mono- eller asymmetrisk oligoartikulær, ikke-erosiv artritt, som oftest rammer mellomstore og store ledd, og inkluder ofte; kne, ankler og håndledd. Polyartikulær leddaffeksjon er sjelden og leddaffeksjonen er oftest assosiert til økning av andre BS-manifestasjoner som orale og/eller genitale sår. Intraartikulær steroid behandling har god dokumentert effekt.
Blodkarsaffeksjon – vaskulær Behçets syndrom:
Vaskulær affeksjon opptrer hyppigere hos menn og er hyppigste dødsårsaken ved BS. Venøs affeksjon av BS er mer vanlig hos pasienter med en positiv patergi test og øyeaffeksjon. Vaskulær affeksjon ses hos omtrent 25-30% av pasientene. Det er cirka 14 ganger økt risiko for venøs trombose hos pasienter med BS basert på case-control studie. BS vaskulitt affiserer kar av forskjellige størrelser. Overfladisk subkutan tromboflebitt og dyp venetrombose (DVT) er de vanligste trombotiske manifestasjoner ved vaskulær BS. Imidlertid til tross for økt forekomst av venøs tromboser, sees lungeembolier relativ sjelden. Det gjenkjenner vaskulær affeksjon av BS at tromboser kommer på uvanlige steder som intrakardialt.
Lungearterie-aneurismer er den karakteristisk for BS. Det vanligste symptomet på dette er hemoptyse. Det er kritisk å skille dette fra lungeemboli som krever annen behandling.
Budd-Chiari syndrom (BCS) innebærer trombose i levervene og/eller i den intra- eller suprahepatisk vena cava inferior. Dette er en sjelden, men alvorlig komplikasjon av vaskulær BS.
Arteriell affeksjon utgjør opp mot 15% av de som har vaskulær BS og er mye sjeldnere en tromboser. Patologien er i hovedsak dannelse av arterielle aneurismer og okklusjon. Aneurismer rammer oftest lungearterietreet. Store arterier er rammet i ca. 1/3 tilfelle. De affiserte karene er halskar, abdominal aorta, mens i mindre grad thorakal aorta. I tillegg er Iliaca-, femoral- og popliteal-arterier, oftest involverte. Kransårer og nyrearterier er sjelden affiserte.
Ultralydmåling av karveggtykkelse av femoralvener (CFV) og vena saphena magna (SV) hos pasienter med BS har i en Tyrkisk studie vist signifikant (p <0,001) høyere tykkelse sammenlignet med friske kontroller og pasienter med ankyloserende spondylitt. Grenseverdiene for høyre og venstre CFV-tykkelse for BD var på 0,49 og 0,48mm og dette funnet var uavhengig om det forelå vaskulær involvering. Tyrkiske gruppen har anført sensitivitet avhengig om man måler på høyre eller venstre side på 81,0-82,8% og spesifisitet på 78,4-82,8-% for diagnosen BS basert kun på venefortykkelse, som er imponerende (14). Foreløpig er dette ikke bekreftet ved andre studier og hos pasienter av annen etnisitet, men en mindre studie fra England har tidligere påvist lignende funn med MRI undersøkelse (15). Man har utført pilotforsøk her på OUS i Norge på både MRI og ultralyd basert estimat på venefortykkelsene på BS uten å finne en merkbar forskjell.
Påvirkning på hjerte rammer for det meste mannlige pasienter med BS. Hjertemedvirkning forekommer hos mindre enn 10% av pasienter med BS. Dette inkluderer forskjellige tilstander som; perikarditt, endokarditt, aortainsuffisiens, intrakardial trombose, hjerteinfarkt, endomyokardial fibrose og hjerteaneurisme.
Gastrointestinal affeksjon – GI-Behcets sykdom:
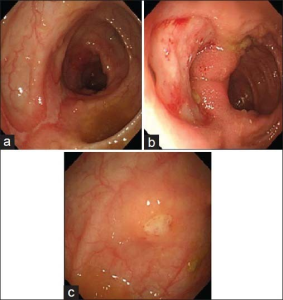
Det er stor forskjell i prevalens av gastrointestinal affeksjon av BS og det er sterkt assosiert til etnisitet. Prevalens er anført å ligge imellom 0–60%. GI-affeksjon er sjelden i Tyrkia på under 5% men hyppig i Japan på 60% mens i Israel er på rundt 10% og rundt 40% i UK. Hvis det foreligger, opptrer GI- symptomer vanligvis 4-6 år etter debut av BS. Symptomer på gastrointestinal affeksjon på BS kan være umulig å skille fra symptomer om inflammatorisk tarmsykdom (IBD). Symptomer som; magesmerter, diaré, vekttap og blødninger. For å komplisere dette videre kan munnsår også forekommer hos pasienter med inflammatorisk tarmsykdom. Slimhinnesår i rektum er svært sjelden ved BS og forekommer hos mindre enn 1%, som gjør at hoved differensialdiagnosen Crohns sykdom er da mer sannsynlig.
Gastrointestinale sår og også tarmperforasjon kan forekomme forekommer hos pasienter med BS. Hvis det foreligger affeksjon av tarm ved BS er funnene oftest diskret slimhinnesår som er da ofte lokalisert i terminale ileum, cøkum og høyre del av tykktarmen. Det kan forekomme dypere, såkalte vulkanformede sår, som oftest ileocøkalt ved BS der patologi viser kronisk aktiv ikke-spesifikk betennelse. En retrospektiv studie på koloskopiske funn hos pasienter med Behçets syndrom og sammenlignet med funn hos Crohns pasienter (16). (i) Brosteins-utseende sår var sterkt assosiert til Crohns sykdom. Når det ikke forelå brosteins-utseende sår, kunne sårformen skille mellom Crohns og BS. (ii) Sår med rundaktig form var hyppigst BS. (iii) Langsgående sår var typiske for Crohns sykdom. (iv) I de tilfellene der sårformen ikke er klart definert med ”uregelmessige eller geografisk” utseende, var fokal lokalisering av slimhinnesår assosiert til BS, mens segmental eller diffus fordeling av sårene gjennom tykktarmen antydet Crohns sykdom (16). Prognose for GI-BS har en kronisk, uforutsigbar kurs med forverring og remisjon og vanligvis redusert anfallshyppighet og anfalls alvorlighetsgrad over tid. Den medisinske behandlingene som brukes mot GI-BS er ofte de samme som de som brukes for for IBD, med sulfasalazin, eller mesalamin (5-aminosalisylsyre [5-ASA] og glukokortikoid som er i grunn hovedbehandlingen ved GI-BS. Azathioprin og anti-TNF-α inhibitor er behandling som har god dokumentasjon både ved IBD og BS.
Sentralnervesystemet – Nevro-Behçet sykdom:
Forekommer hos mindre enn 10% og observeres oftere hos menn. Hodepine er det vanligste symptomet på og rammer rundt 70% av pasientene og er ofte er det ikke forbundet med organiske eller strukturelle endringer. Nevrologisk affeksjon er ofte klassifisert som parenkymal og ikke-parenkymal affeksjon.
Parenkymal sentralnervøs sykdom ved BS rammer ofte hjernestammen. Kan opptre med diffus multifokal affeksjon som kan ramme flere områder, inkludert hjernestamme, hjerne- og/eller ryggmarg. Pasienter kan få myelitt, optisk nevropati, eller mer diffus hjerne affeksjon som kan inkludere encefalopati, hemiparese eller hemisensoriske funn, epilepsi, kognitiv dysfunksjon, mentale endringer og organbasert psykose.
Ikke-parenkymal sentralnervøs BS inkluderer cerebral venøs trombose, intrakranielt hypertensjonssyndrom («posterior reversible encephalopathy syndrome» (PRES)). Samt og subakutt aseptisk meningoencefalitt eller meningitt er relativ hyppig manifestasjon. Hjerneslag forårsaket arteriell trombose, arterie disseksjon eller aneurisme kan også forekomme.
Sykdomsklynger assosiert til Behçets syndrom
Ved vaskulær BS ses også vene trombose og/eller sinus venøs trombose. Ved BS preget av mye akne ses oftere artritt og/eller entesitt. BS med øyeaffeksjon har oftere og sentralnervøst system affeksjon.
Hughes-Stovin syndrom: der foreligger både lungearterie-aneurismer og perifer DVT, men ikke orale eller genitale ulcera som ved BS.
MAGIC syndrom: der «MAGIC» er akronym for «mouth and genital ulcers with inflamed cartilage», ble først lansert av Firestein og kolleger i 1985 og representer overlapping mellom tilbakevendende polykondritt («relapsing polychondritis») og Behçet sykdom/syndrom (17).
Differensialdiagnoser ved Behçets sykdom
Benign tilbakevendende aftøs stomatitt i BS «recurrent aphthous stomatitis» (RAS) er en relativ vanlig tilstand, som ikke er assosiert med noen systemisk sykdom og forekommer hos 20-25% av frisk befolkningen generelt. Det er oftest til stede fra barndommen og blir oftest generelt bedre med årene. I sammenligning med BS, er de orale sårene ved RAS mindre (dvs. < 1 cm) og vanligvis mindre smertefulle og har en tendens til å gro spontant på kortere tid en orale sår ved BS. Orale sår ved RAS affiserer svært sjelden myke ganen og orofarynks.
- TNFAIP3 mutasjon er autosomal dominant tilstand som også kalles A20 haploinsufficiency (HA20). TNFAIP3 genet koder for A20-proteinet som hemmer den proinflammatoriske nukleær faktor κB (NF-κB). Heterozygote tap med funksjonsmutasjoner i TNFAIP3 genet fører til haploinsuffisiens A20, som karakterisert ved tidlig debuterende systemisk betennelse med tilbakevendende orale, genitale og gastrointestinale sår som ligner Behçets syndrom.
- PFAFA sykdom («Periodic Fever, Aphthous Stomatitis, Pharyngitis, Adenitis») debuterer fra barnsalder med gjentatte episoder med; feber, aftøse munnsår, faryngitt og hovne lymfeknuter.
Primære hudsykdommer kan ramme slimhinner, tilstander som;
- Lichen planus, bulløse hudsykdommer som bullous pemphigus og pemphigoid, samt og kroniske form av erythema multiforme.
Erythema nodosum er assosiert til rekke tilstander bl.a:
- Sarkoidose og Crohns sykdom som også kan forårsake uveitt og artritt som BS, mens Crohns sykdom kan i tillegg også gi sår i slimhinner, men da som oftest dypere sår med arr-tilhelning.
Blant autoimmune sykdommer er det spesielt:
- Systemisk lupus erythematosus (SLE) som kan gi slimhinnesår men de er oftest smertefri og oftest oppe i ganen.
Vanlig akne vulgaris og sekundære former av akne som steroid utløst akne, som lett kan forveksles med akneformet utslett ved BS. Akneformet utslett er også assosiert til SAPHO syndrom i tillegg til synovitt, pustulose, hyperostose og osteitt, men osteitt og hyperostose er ikke del av BS og SAPHO gir ikke utslett i slimhinner.
Infeksiøse årsaker er viktig å utelukke inkluderte;
- Herpes simpleks virusaffeksjon med slimhinneaffeksjon
- Herpetisk gingivostomatitt
- Herpangina (Coxsackie-virus A)
- Hånd-munn-sykdom (Coxsackie-virus A16 eller Enterovirus 71) som i hovedsak rammer barn under 10 år.
Den viktigste differensialdiagnosen for genitale sår inkluderer
- Seksuelt overførbare sykdommer som; herpes simpleks virusinfeksjon, syfilis (Treponema pallidum), bløt sjanker eller kankroid som er forårsaket av Haemophilus ducreyi, donovanosis eller granuloma inguinale forårsaket av Klebsiella granulomatis og lymfogranuloma venereum forårsaket av Chlamydia trachomatis.
Sekundære årsaker for slimhinnesår som syklisk nøytropeni og dette kan ses ved visse former av lymfom.
Diagnose
Som anført her tidligere er diagnosen av Behçets sykdom en klinisk diagnose som baserer seg på mønstergjenkjenning. BS er sjelden hos pasienter av skandinavisk herkomst, men betydelig hyppigere av pasienter med særlig av tyrkisk etnisitet. Det er i viktig å dokumentere om pasienten fyller kriteria for diagnostikk enten ISG kriteria fra 1990 og/eller ICBD kriteriene basert på scoring system ved diagnose. Viktig at funn er verifisert og dokumentert.
Vevstype HLA B51 er assosiert til BS og rundt 40-60% med BS har denne vevstypen, med odds ratio på under 6 hos de som har skandinavisk etnisitet. HLA B51 er uegnet i diagnostikk pga. høy andel falsk positive og falsk negative tester til tross for sterk og signifikant assosiasjon på gruppenivå. Dessverre er ingen særlig hjelp av laboratorietester som egner seg i differensialdiagnostikk og kartlegging av sykdomsmanifestasjon og oppfølging av medisinsk behandling.
Svangerskap
Vennligst de info fra NKSR
Behandling av Behçets syndrom
Behandlingen må tilpasses pasientens sykdomstilstand, organmanifestasjoner og alvorlighetsgrad. I 2018 kom oppdatering på European League Against Rheumatism (EULAR) anbefalingene fra 2008 om behandling av Behçets syndrom (19). EULAR 2018 anbefalingene kom før apremilast (Otezla®) ble introdusert i behandling av BS. Apremilast (-> se herunder) har per dags dato best dokumentasjon på orale ulcera ved BS (20, 21) men det foreligger per dags dato lite dokumentasjon på andre manifestasjoner av BS. Apremilast er det eneste medikamentet som har særskilt indikasjon på BS i Norge per i dag. Medikamentet er kostbart og generelt vil man forsøke lokal behandling og mindre kostbare behandlingsformer før man igangsetter det og per dags dato må man søke til fagdirektør om individuell refusjon.
Lokal behandling av slimhinner i munn
- Hos pasienter med hovedsak slimhinneaffeksjon kan man anvende lokal behandling men ofte må man kombinere med systemisk behandling.
- Noen har nytte av Oralmedic® som kjøpes reseptfritt på apotek. Kan svi kraftig og kan ikke brukes av alle
- Antepsin® (sukralfat) mikstur 200mg/ml og brukes vanligvis 4 ganger daglig ved svake symptomer og kan forsøkes og har lite bivirkninger.
- Lokal steroid behandling er reseptpliktig, men det må søke registreringsfritak, men de er hyllevarer i fleste apotek i Norge. Dette er langt i fra tømmende liste men disse alternativene brukes oftest i Norge
- Triamcinolon acetonide
- KENACORT A Orabase limpasta 0,1% 5 g
- Volon A 0,1% munnsalve 10 g
- Clobetasol propionate
Klobetasol munngel 0,025% 250 g
Clobetasol dentagel
Ved uttalte plager fra svelg og munn har man forsøkt med:
- “Düsseldorfblanding” er en spesiell laget mikstur som kan lages av apotek og består av klorheksidin (Corsodyl), nystatin (Mycostatin) og natrium bikarbonat løst i sterilt vann.
- ”Fløteblanding” (10ml Paracetamol, 10ml Xylocain viskøs og litt fløte). En skje av blanding 20-30 minutter før hvert måltid. Den gir nummenhet i svelget.
Begge brukes hovedsakelig hos pasienter under kreftbehandling og store svelgeproblemer og kan unntaksvis forsøkes ved korttidsbehandling hos pasienter med store svelgeproblemer og vekttap.
Affeksjon av ytre genitale kan bruke lokal steroid behandling under kontroll av hudlege eller gynekolog.
Systemisk behandling
Glukokortikoid behandling som oftest kurer med Prednisolon. Vanlig oppstart ved aktiv sykdom med oftest 20-30mg /dag som trappes ned over 2-3 uker og seponeres og hvis manglende respons kan man intensivere behandlingen. Lavere vedlikeholdsdosering (ca. 5mg/d) kan brukes ved residiverende tilstand.
Ved alvorlige former som øye, sentralnervøse og vaskulær BS gis høyre dosering og evt. intravenøs høydose behandling med SoluMedrol® behandling.
Kolkisin (colchicine) [Colchicine Tiofarma®, Colrefuz®, Kolkisin Aurora Medical®] er i 500µg tabletter. Kolkisin har en god dokumentasjon på orale og genitale ulcera og har også effekt på hudaffeksjon både erythema nodosum og pseudo-folikulitt samt på leddaffeksjon. Kolkisin har påvist forebyggende effekt. Medikamentet er gammelt, men gir gastrointestinal bivirkninger i høye doseringer. Vanlig dosering er 500 µg x3 ved anfall og reduksjon ned til 0,5mg x1 som vedlikehold.
Azatioprin [Imurel®, Azatioprin®] og finnes i 50 og 25 mg tabletter er relative bra dokumentert som steroid sparende medikament og brukes både ved orale og genitale sår i doseringen 2 – 2,5mg/kg. Man anbefaler å ta tiopurin methyltransferase (TPMT) genotype forut behandling. De fleste (rundt 90%) har TPMT*1/*1 (wild-type) genotype med normal TPMT enzym aktivitet og kan få vanlig dosering, 2,0-2,5 mg/kg per dag en gang på dagen. Pasienter som er heterozygote med TPMT*1 og noen av de over 20 TPMT polymorfismer, som oftest er *2, *3A, *3B, *3C, og *4, har redusert TPMT enzym aktivitet og må få redusert, oftest halvert dosering og følges grundig hvis oppstart. De som ikke har TPMT*1genotypen og enten homozygot og/eller heterozygot for en av de allelene bør ikke få azathioprin pga. økt risiko for alvorlig myelosuppresjon. Dette utgjør få pasienter (>1%). Vises til Avdeling for farmakologi. Oslo universitetssykehus. https://anx.no/tpmt/. Verdi av 6-tioguaninnukleotide (6-TGN) og metyl-merkaptopurin (me-MP) måles i Heparinisert fullblod, tilsier om effekt av AZA behandlingen. Terapeutisk område er: 6-TGN 3,5−5,0 µmol/L og me-MP <50 µmol/L når brukes i transplantasjonsmedisin. Dette kan anvendes i kontroll med blodprøve. Se https://anx.no/6tgn/
Mykofenolat mofetil: [CellCept, Myfenax, Mykofenolat, Mykofenolat mofetil] er relativ sparsom dokumentasjon ved BS, men kan vurderes hvis intoleranse eller at azathioprin (AZA) er frarådet der virkningsmekanismen på lymfocytter er relativ lik sammenlignet med AZA. Dosering: 2-3 g/d fordelt på to doseringer, med ca. 12 timers intervall. Det er tabletter på 500mg og kapsler på 250mg i tillegg finnes det som mikstur.
Mykofenolatsyre (MMF) [Myfortic, Mykofenosyre Accod] er i grunn samme medikamentet som MMF, men skal ha noe mindre gastrointestinal bivirkninger. Generelt anbefales ikke høyere doseringer en 1440 mg/d fordelt på to doseringer med 12 timers interval. Tabletter på 180 og 360mg.
TNF-alfa-hemmere: for slimhinne sykdom er godt dokumentert på flest alle manifestasjoner inklusiv oral og genitale ulcera, øyeaffeksjon, sentralnervøse manifestasjoner og leddaffeksjon(22-35). En japansk studie sammenlignet 40 mannlige pasienter med BS, alle med positiv patergi testing og slimhinne sykdom og/eller synovitt, ble randomisert (20 pasienter til hver studiearm) for å få enten s.c. etanercept 25 mg to ganger i uken eller placebo i 4 uker. Og effekt på slimhinne- og artikulære manifestasjoner ble sammenlignet mellom de to gruppene. Det var ingen reduksjoner i patergi respons, men gjennomsnittlig antall orale sår, nodulære lesjoner og papulopustulære lesjoner var mindre i etanercept-gruppen sammenlignet med placebogruppen (34). En større fransk multisenterstudie konkluderte at anti-TNF alfa-terapi var effektiv ved alle alvorlige og resistente BS manifestasjoner og effekten ser ut til å være lik uansett om infliksimab eller adalimumab ble brukt. De så på utfall av hos 124 menn med BS og anti-TNF alfa-behandling som bestod hovedsakelig av antistoffbehandling med infliksimab (62%) og adalimumab (30%). Samlet respons (dvs. fullstendig og delvis) var 90,4%. Klinisk respons ble observert hos pasienter med alvorlige og/eller resistente øye (96%), slimhinne (88%), ledd (70%), gastrointestinale (78%), sentralnervesystem (92%) og kardiovaskulære manifestasjoner (67%). Ingen signifikant forskjell ble funnet på effekt av anti-TNF brukt som monoterapi eller i kombinasjonsbehandling med et immunsuppressivt middel. Prednison dosen ble signifikant redusert etter 6 og 12 måneder behandling (p <0,0001). Forekomsten av tilbakefall per pasient per år var signifikant lavere under anti-TNF-behandling (0,2 ± 0,5 mot 1,7 ± 2,4 før bruk av anti-TNF, p <0,0001). Effekten og tilbakefallfri overlevelse var lik uavhengig av hvilken type anti-TNF-middel som ble brukt (35).
Konklusjonen er at anti-TNF-alfa hemmere er god og effektiv behandling både ved slimhinneaffeksjon og mer alvorlig organaffeksjon. Det er påvist effekt av; infliksimab, adalimumab og etanercept og sannsynligvis er dette klasse effekt til tross andre anti-TNF-alfa behandlinger (certulizumab og golimumab) har ikke særlig dokumentasjon.
Både etter EULAR behandlings retningslinjene fra 2018 og American Academy of Ophthalmology allerede fra 2014 er enstemmige og anbefaler anti-TNFα som første linje behandling for alvorlig uveitt hos BS-pasienter (19, 36).
Apremilast (Otezla®): er i tablettform og det finnes i styrken 10, 20 og 30 mg. Vanlig dosering for voksen pasient er 30mg x2. Apremilast er phosfodiesterase-4-inhibitor som medfører til økt intracellulært cAMP-nivå, som igjen nedregulerer inflammatorisk respons ved å modulere uttrykk av bl.a. cytokinene; TNF-α, IL-23, IL-17. I tillegg modulerer cAMP også nivået av antiinflammatoriske cytokiner som IL-10. Apremilast er registrert for bruk for psoriasis, psoriasis artritt og Behçets sykdom. Vanlige bivirkninger er gastrointestinale med diaré, kvalme, dyspepsi og løs mave samt utmattelse og hodepine samt nedstemthet. I tillegg er hoste og tett nese anført som vanlig bivirkninger. Medikamentet har foreløpig kun dokumentasjon på orale sår ved BS og i studiene var tendens til minskete genitale sår, men det var ikke statistisk signifikant i henhold til placebo (20, 21, 37). Foreløpig er medikamentet kostbart i Norge i forhold til anti-TNF-alfa behandling, som er for øvrig bedre bedre dokumentert ved alvorlige former av BS og bør sannsynlig forsøkes før man anvender apremilast. Foreløpig må man på individual søke til fagdirektør før bruk.
Kalsineurin-hemmere (CNI): ciclosporin og takrolimus inngår i de fleste behandlingsprotokoller etter organtransplantasjon til å dempe avstøtningsreaksjon. CNI har dokumentert effekt på BS og er best dokumentert på øyeaffeksjon(38-40). Immunsuppressiv effekt av CNI er formidlet ved å redusere interleukin-2 (IL-2) produksjon og IL-2 reseptoruttrykk, noe som fører til en reduksjon i T-celleaktivering. Det er anført at CNI ikke skal brukes ved sentralnervøs affeksjon og det fremkommer også i behandlings-rettningslinjene fra 2018 fra EULAR.
Metotreksat (MTX): p.o eller s.c. [Methotrexat®, Metex®, Ebetrex®, Methofill®]. MTX s.c. er å foretrekke, for bedre og mer stabil blodverdi 0,3 mg/kg/uke (15-25 mg), trappes opp over maks. 4 uker. Det har vært tradisjon å gi samtidig p.o. Folsyre for eksempel 1 mg daglig. Er ikke førstehåndsmedikament for BS og det foreligger ikke særlig dokumentasjon på bruk (41-43). Egen begrenset erfaring er at det er lite effektiv på slimhinne BS.
Andre behandlingsalternativer
Cyklofosfamid: [Sendoxan®] intravenøs, 50 mg tablett. Ved vaskulær form av BS kan man gi cyklofosfamid. Behandlingen er ikke særlig godt vitenskapelig bekreftet og er på stadium III når det gjelder bevisnivå («level of evidence»). Man kan enten gi per oral eller intravenøs cyklofosfamid men fleste velger her intravenøs i det det gir lavere kumulativ cyklofosfamid dosering. Hvis man velger p.o. cyclofosfamid behandling bruker man rundt 2 mg/kg per dag som morgendosering. Ved intravenøs cyklofosfamid foreligger lavere total kumulativ dosering. Cyclofosfamid med intravenøse pulser med cyclofosfamid 15 mg/kg (max 1.200 mg) eller 500-1000 mg/m2 hudoverflate Cyclofosfamid doseringen må både tilpasses alder samt nyrefunksjon se Tabell 4. Fleste gir Uromitexan (Mesna) i forbindelse med intravenøs cyklofosfamid. Det kan gis både som intravenøst (100 mg/ml) og som tabletter (400 og 600 mg). Det forebygger urinveistoksisitet forårsaket av oxazafosforiner som kommer fra metabolisme av cyklofosfamid med å bindes akrolein som er toksisk oxafosforin-metabolitt og bidra til langsommere nedbryting som også reduserer akrolein utskillelsen. Vanlig dosering er månedlige pulser hver måned til sammen 6 behandlings-runder og videre kan man forlenge intervall til hver andre til hver tredje måned. Dette gis sammen med høydose prednisolon behandling som er gradvis redusert. Etter avsluttet CYC behandling er konvensjonelt å fortsette med po. azathioprin (Imurel) behandling som vedlikehold (44).
Tabell 4 Doseendring av cyklofosfamid relatert til alder / nyrefunksjon
| CYC i.v. puls (mg/kg)
(Max 1200 mg) |
||
| Alder (år) | Kreat. ≤ 300(μmol/L) eller
eGFR > 30 (ml/min/1,73m2) |
Kreat. > 300
eGFR: ≤ 30 |
| < 60 | 15 | 12,5 |
| 60 – 70 | 12,5 | 10,0 |
| > 70 | 10,0 | 7,5 |
Interferon α-2b: [IntronA®] 6 mill. IE/ml (3 ml) og 10 mill. IE/ml (2,5 ml). «Off-label» bruk av Interferon α-2b (IF α-2b) har en dokumentasjon på Behçets syndrom både på slimhinneaffeksjon og på øyeaffeksjon. Vanligste dosering er s.c. 5 millioner IE 3 ganger/uken i 6 uker, etterfulgt av 5 mill. IE en gang i uken i 10 uker. Den optimale doseringen av IF α-2b behandling, frekvens og varigheten av behandlingen av Behçets syndrom er foreløpig uklar. IF behandling vært brukt varierte doseringer i små studier er variable fra 2 til 5 millioner enheter/dose (45-50). Det er en rekke bivirkninger knyttet opp til behandling med IF inklusiv nøytropeni og anemi og sjeldnere trombocytopeni. Kvalme og oppkast samt diaré samt dyspné samt depresjon, angst og agitasjon samt feber og influensalignende symptomer samt rekke andre bivirkninger. Behandling med IF α-2b står relativ høyt på EULAR anbefalingene inklusiv IIA evidens ved øyeaffeksjon og IB evidens ved slimhinneaffeksjon og leddaffeksjon (19).
Thalidomid: [Thalidomide Celgene] 50 mg kapsler. Brukes her svært sjelden pga. betydelig risiko for nevropati og teratogenisitet. Effekten av thalidomid monoterapi for slimhinne manifestasjoner av BS ble demonstrert i en studie med 96 mannlige pasienter som ble tilfeldig fordelt på en av tre behandlingsgrupper: (a) thalidomid 100 mg/dag,(b) 300 mg/dag eller (c) placebo over 24 uker (51). En fullstendig respons var hos 6% (2/32) av de som fikk thalidomid 100 mg/d, hos 16% (5/31) av de som fikk thalidomid 300 mg/d; og hos ingen (0/32) av de som fikk placebo (P = 0,031). Effekten av thalidomid ved begge doser (100 og 300 mg/dag) var tydelig ved 4 uker for orale sår (P <0,001) etter 8 uker for genitale sår (P <0,001) og follikulære hudlesjoner (P = 0,008). Effekt av behandlingen avtok etter avsluttet behandling. Ulemper: Det var signifikant økning av erythema nodosum ved begge doser av thalidomid i løpet av de første 8 ukene av behandlingen (P = 0,03), mens 6% (4/63) utviklet irreversibel polynevropati derav 3/4 ved høyeste doseringen (300 mg/dag) (51). Behandling med thalidomid står relativ høyt på EULAR anbefalingene med IB evidens (19) til tross moderat behandlingseffekt med betydelige og dels irreversible bivirkninger i form av nevropati.
ANDRE Behandlingsformer
Anti-interleukin 1 (IL-1) behandling, med enten interleukin-1 inhibitor med anakinra eller anti-interleukin 1 antistoff med canakinumab (52, 53) Rituksimab (anti-CD20 antistoff) behandling har vært forsøkt. Det har vært utført i hvert fall to ikke-myeloablativ høydosebehandling med autolog stamcellestøtte (HMAS) på to pasienter med terapiresistent neurovaskulær BS, der den ene hadde effekt, men den andre ikke (54). Det er også forsøkt med ustekinumab et humanisert monoklonal antistoff mot interleukin 12 (IL-12) og interleukin 23 (IL-23) som syntes å være effektiv i ikke randomisert observasjonsstudie på 30 pasienter (55).
Trygderettigheter i Norge:
Behcets sykdom står på listen over sjeldne tilstander som kan få refundert utgifter til tannlegebehandling (A listen) i Norge https://www.helsenorge.no/sjeldne-diagnoser/stotte-til-tannbehandling/
Prognose
Det er stor forskjell i prognose av menn og kvinner med BS både i mortalitet og morbiditet. Å få sykdommen i ung alder er også en risikofaktor. Det er observert at sykdommen blir mindre aktiv etter 40 års alder. En Fransk kohort studie viste at av 817 pasienter med BS, døde 41 (5%). Hele 95,1% av de som døde var menn og de døde gjennomsnittlig i alder av 34,8 år (56). Det ser også til å være en klar assosiasjon for de som får sykdommen i alder av 15-24 år versus de som får sykdommen senere. Mortalitet er assosiert til vaskulær affeksjon og særlig lungearterie aneurisme og sentral nervøs affeksjon (56, 57).
Anbefalt litteratur
Oversiktsartikler:
Saadoun, D., et al. (2024). “Behcet’s Syndrome.” N Engl J Med 390(7): 640-651.
Hatemi, G., et al. (2023). “Behçet Syndrome.” Rheum Dis Clin North Am 49(3): 585-602.
Behandlingsretninglinjer:
Hatemi, G. (2022). “A treat-to-target approach is needed for Behcet’s syndrome.” Curr Opin Rheumatol 34(1): 39-45.
Hatemi, G., et al. (2018). “2018 update of the EULAR recommendations for the management of Behcet’s syndrome.” Ann Rheum Dis 77(6): 808-818.
REFERANSER
- Jennette JC, Falk RJ, Bacon PA, Basu N, Cid MC, Ferrario F, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2013 Jan;65(1):1-11. PubMed PMID: 23045170.
- Criteria for diagnosis of Behcet’s disease. International Study Group for Behcet’s Disease. Lancet. 1990 May 5;335(8697):1078-80. PubMed PMID: 1970380.
- International Team for the Revision of the International Criteria for Behcet’s D. The International Criteria for Behcet’s Disease (ICBD): a collaborative study of 27 countries on the sensitivity and specificity of the new criteria. J Eur Acad Dermatol Venereol. 2014 Mar;28(3):338-47. PubMed PMID: 23441863.
- Gilworth G, Chamberlain MA, Bhakta B, Haskard D, Silman A, Tennant A. Development of the BD-QoL: a quality of life measure specific to Behçet’s disease. J Rheumatol. 2004 May;31(5):931-7. PubMed PMID: 15124253.
- Lawton G, Bhakta BB, Chamberlain MA, Tennant A. The Behcet’s disease activity index. Rheumatology (Oxford). 2004 Jan;43(1):73-8. PubMed PMID: 12890862.
- Maldini C, Druce K, Basu N, LaValley MP, Mahr A. Exploring the variability in Behçet’s disease prevalence: a meta-analytical approach. Rheumatology (Oxford). 2018 Jan 1;57(1):185-95. PubMed PMID: 28339670.
- Azizlerli G, Köse AA, Sarica R, Gül A, Tutkun IT, Kulaç M, et al. Prevalence of Behçet’s disease in Istanbul, Turkey. Int J Dermatol. 2003 Oct;42(10):803-6. PubMed PMID: 14521694.
- Savey L, Resche-Rigon M, Wechsler B, Comarmond C, Piette JC, Cacoub P, et al. Ethnicity and association with disease manifestations and mortality in Behçet’s disease. Orphanet journal of rare diseases. 2014 Mar 27;9:42. PubMed PMID: 24674137. PMCID: PMC3986678.
- Calamia KT, Wilson FC, Icen M, Crowson CS, Gabriel SE, Kremers HM. Epidemiology and clinical characteristics of Behçet’s disease in the US: a population-based study. Arthritis Rheum. 2009 May 15;61(5):600-4. PubMed PMID: 19405011. PMCID: PMC3024036.
- Mohammad A, Mandl T, Sturfelt G, Segelmark M. Incidence, prevalence and clinical characteristics of Behcet’s disease in southern Sweden. Rheumatology (Oxford). 2013 Feb;52(2):304-10. PubMed PMID: 23012468.
- Gyldenløve M, Tvede N, Larsen JL, Jacobsen S, Thyssen JP. Low prevalence of positive skin pathergy testing in Danish patients with Behçet’s disease. J Eur Acad Dermatol Venereol. 2014 Feb;28(2):259-60. PubMed PMID: 23676001.
- de Menthon M, Lavalley MP, Maldini C, Guillevin L, Mahr A. HLA-B51/B5 and the risk of Behçet’s disease: a systematic review and meta-analysis of case-control genetic association studies. Arthritis Rheum. 2009 Oct 15;61(10):1287-96. PubMed PMID: 19790126. PMCID: PMC3867978.
- Vaccarino L, Triolo G, Accardo-Palombo A, Scola L, Palmeri M, Bova M, et al. Pathological implications of Th1/Th2 cytokine genetic variants in Behçet’s disease: Data from a pilot study in a Sicilian population. Biochem Genet. 2013 Dec;51(11-12):967-75. PubMed PMID: 23857551.
- Alibaz-Oner F, Ergelen R, Mutis A, Erturk Z, Asadov R, Mumcu G, et al. Venous vessel wall thickness in lower extremity is increased in male patients with Behcet’s disease. Clinical rheumatology. 2019;38(5):1447-51. PubMed PMID: 30758790.
- Ambrose N, Pierce IT, Gatehouse PD, Haskard DO, Firmin DN. Magnetic resonance imaging of vein wall thickness in patients with Behçet’s syndrome. Clin Exp Rheumatol. 2014 Jul-Aug;32(4 Suppl 84):S99-102. PubMed PMID: 25268665.
- Lee SK, Kim BK, Kim TI, Kim WH. Differential diagnosis of intestinal Behcet’s disease and Crohn’s disease by colonoscopic findings. Endoscopy. 2009 Jan;41(1):9-16. PubMed PMID: 19160153.
- Firestein GS, Gruber HE, Weisman MH, Zvaifler NJ, Barber J, O’Duffy JD. Mouth and genital ulcers with inflamed cartilage: MAGIC syndrome. Five patients with features of relapsing polychondritis and Behçet’s disease. Am J Med. 1985 Jul;79(1):65-72. PubMed PMID: 4014306.
- Hatemi I, Hatemi G, Celik AF, Melikoglu M, Arzuhal N, Mat C, et al. Frequency of pathergy phenomenon and other features of Behçet’s syndrome among patients with inflammatory bowel disease. Clin Exp Rheumatol. 2008 Jul-Aug;26(4 Suppl 50):S91-5. PubMed PMID: 19026122.
- Hatemi G, Christensen R, Bang D, Bodaghi B, Celik AF, Fortune F, et al. 2018 update of the EULAR recommendations for the management of Behcet’s syndrome. Ann Rheum Dis. 2018 Jun;77(6):808-18. PubMed PMID: 29625968.
- Takeno M. Positioning of apremilast in treatment of Behçet’s disease. Mod Rheumatol. 2020 Mar;30(2):219-24. PubMed PMID: 31747804.
- Hatemi G, Mahr A, Ishigatsubo Y, Song YW, Takeno M, Kim D, et al. Trial of Apremilast for Oral Ulcers in Behcet’s Syndrome. N Engl J Med. 2019 Nov 14;381(20):1918-28. PubMed PMID: 31722152.
- Giardina A, Ferrante A, Ciccia F, Vadalà M, Giardina E, Triolo G. One year study of efficacy and safety of infliximab in the treatment of patients with ocular and neurological Behçet’s disease refractory to standard immunosuppressive drugs. Rheumatol Int. 2011 Jan;31(1):33-7. PubMed PMID: 19859715.
- Al-Rayes H, Al-Swailem R, Al-Balawi M, Al-Dohayan N, Al-Zaidi S, Tariq M. Safety and efficacy of infliximab therapy in active behcet’s uveitis: an open-label trial. Rheumatol Int. 2008 Nov;29(1):53-7. PubMed PMID: 18496694.
- Tugal-Tutkun I, Mudun A, Urgancioglu M, Kamali S, Kasapoglu E, Inanc M, et al. Efficacy of infliximab in the treatment of uveitis that is resistant to treatment with the combination of azathioprine, cyclosporine, and corticosteroids in Behçet’s disease: an open-label trial. Arthritis Rheum. 2005 Aug;52(8):2478-84. PubMed PMID: 16052571.
- Kikuchi H, Aramaki K, Hirohata S. Effect of infliximab in progressive neuro-Behçet’s syndrome. J Neurol Sci. 2008 Sep 15;272(1-2):99-105. PubMed PMID: 18550081.
- Iwata S, Saito K, Yamaoka K, Tsujimura S, Nawata M, Suzuki K, et al. Effects of anti-TNF-alpha antibody infliximab in refractory entero-Behcet’s disease. Rheumatology (Oxford). 2009 Aug;48(8):1012-3. PubMed PMID: 19465589.
- Markomichelakis N, Delicha E, Masselos S, Fragiadaki K, Kaklamanis P, Sfikakis PP. A single infliximab infusion vs corticosteroids for acute panuveitis attacks in Behçet’s disease: a comparative 4-week study. Rheumatology (Oxford). 2011 Mar;50(3):593-7. PubMed PMID: 21097877.
- Mohammed RH. Etanercept therapy in Behçet’s disease. The tight control strategy in refractory disease. Z Rheumatol. 2014 Sep;73(7):650-6. PubMed PMID: 24549921.
- Zou J, Ji DN, Shen Y, Guan JL, Zheng SB. Mucosal Healing at 14 Weeks Predicts better Outcome in Low-dose Infliximab Treatment for Chinese Patients with Active Intestinal Behcet’s Disease. Ann Clin Lab Sci. 2017 Mar;47(2):171-7. PubMed PMID: 28442519.
- Hibi T, Hirohata S, Kikuchi H, Tateishi U, Sato N, Ozaki K, et al. Infliximab therapy for intestinal, neurological, and vascular involvement in Behcet disease: Efficacy, safety, and pharmacokinetics in a multicenter, prospective, open-label, single-arm phase 3 study. Medicine (Baltimore). 2016 Jun;95(24):e3863. PubMed PMID: 27310969. PMCID: PMC4998455.
- Ohno S, Umebayashi I, Matsukawa M, Goto T, Yano T. Safety and efficacy of infliximab in the treatment of refractory uveoretinitis in Behçet’s disease: a large-scale, long-term postmarketing surveillance in Japan. Arthritis Res Ther. 2019 Jan 5;21(1):2. PubMed PMID: 30611312. PMCID: PMC6321670.
- Tanida S, Inoue N, Kobayashi K, Naganuma M, Hirai F, Iizuka B, et al. Adalimumab for the treatment of Japanese patients with intestinal Behçet’s disease. Clin Gastroenterol Hepatol. 2015 May;13(5):940-8.e3. PubMed PMID: 25245624.
- Martín-Varillas JL, Calvo-Río V, Beltrán E, Sánchez-Bursón J, Mesquida M, Adán A, et al. Successful Optimization of Adalimumab Therapy in Refractory Uveitis Due to Behçet’s Disease. Ophthalmology. 2018 Sep;125(9):1444-51. PubMed PMID: 29602570.
- Melikoglu M, Fresko I, Mat C, Ozyazgan Y, Gogus F, Yurdakul S, et al. Short-term trial of etanercept in Behçet’s disease: a double blind, placebo controlled study. J Rheumatol. 2005 Jan;32(1):98-105. PubMed PMID: 15630733.
- Vallet H, Riviere S, Sanna A, Deroux A, Moulis G, Addimanda O, et al. Efficacy of anti-TNF alpha in severe and/or refractory Behçet’s disease: Multicenter study of 124 patients. J Autoimmun. 2015 Aug;62:67-74. PubMed PMID: 26162757.
- Levy-Clarke G, Jabs DA, Read RW, Rosenbaum JT, Vitale A, Van Gelder RN. Expert panel recommendations for the use of anti-tumor necrosis factor biologic agents in patients with ocular inflammatory disorders. Ophthalmology. 2014 Mar;121(3):785-96.e3. PubMed PMID: 24359625.
- Hatemi G, Melikoglu M, Tunc R, Korkmaz C, Turgut Ozturk B, Mat C, et al. Apremilast for Behcet’s syndrome–a phase 2, placebo-controlled study. N Engl J Med. 2015 Apr 16;372(16):1510-8. PubMed PMID: 25875256.
- Pacor ML, Biasi D, Lunardi C, Cortina P, Caramaschi P, Girelli D, et al. Cyclosporin in Behçet’s disease: results in 16 patients after 24 months of therapy. Clin Rheumatol. 1994 Jun;13(2):224-7. PubMed PMID: 8088063.
- Ermakova NA. Efficacy of corticosteroids and cyclosporin in the treatment of retinal vasculitis in patients with Behçet’s disease. Adv Exp Med Biol. 2003;528:563-5. PubMed PMID: 12918765.
- Sloper CM, Powell RJ, Dua HS. Tacrolimus (FK506) in the treatment of posterior uveitis refractory to cyclosporine. Ophthalmology. 1999 Apr;106(4):723-8. PubMed PMID: 10201592.
- Hirohata S, Suda H, Hashimoto T. Low-dose weekly methotrexate for progressive neuropsychiatric manifestations in Behcet’s disease. J Neurol Sci. 1998 Aug 14;159(2):181-5. PubMed PMID: 9741405.
- Kikuchi H, Aramaki K, Hirohata S. Low dose MTX for progressive neuro-Behçet’s disease. A follow-up study for 4 years. Adv Exp Med Biol. 2003;528:575-8. PubMed PMID: 12918768.
- Davatchi F, Shahram F, Chams H, Jamshidi AR, Nadji A, Chams C, et al. High dose methotrexate for ocular lesions of Behçet’s disease. Preliminary short-term results. Adv Exp Med Biol. 2003;528:579-84. PubMed PMID: 12918769.
- Davatchi F, Sadeghi Abdollahi B, Shams H, Shahram F, Nadji A, Chams-Davatchi C, et al. Combination of pulse cyclophosphamide and azathioprine in ocular manifestations of Behcet’s disease: longitudinal study of up to 10 years. Int J Rheum Dis. 2014 May;17(4):444-52. PubMed PMID: 24314325.
- Azizlerli G, Sarica R, Köse A, Ovül C, Kavala M, Kayabali M, et al. Interferon alfa-2a in the treatment of Behçet’s disease. Dermatology. 1996;192(3):239-41. PubMed PMID: 8726638.
- Kötter I, Vonthein R, Zierhut M, Eckstein AK, Ness T, Günaydin I, et al. Differential efficacy of human recombinant interferon-alpha2a on ocular and extraocular manifestations of Behçet disease: results of an open 4-center trial. Semin Arthritis Rheum. 2004 Apr;33(5):311-9. PubMed PMID: 15079762.
- Kiliç H, Zeytin HE, Korkmaz C, Mat C, Gül A, Coşan F, et al. Low-dose natural human interferon-alpha lozenges in the treatment of Behçet’s syndrome. Rheumatology (Oxford). 2009 Nov;48(11):1388-91. PubMed PMID: 19717547.
- Onal S, Kazokoglu H, Koç A, Akman M, Bavbek T, Direskeneli H, et al. Low dose and dose escalating therapy of interferon alfa-2a in the treatment of refractory and sight-threatening Behçet’s uveitis. Clin Exp Rheumatol. 2009 Mar-Apr;27(2 Suppl 53):S113-4. PubMed PMID: 19796551.
- Keskin Y, Seyahi E, Poyraz C, Ugurlu S, Ozyazgan Y, Yazici H. Interferon alfa-associated depression in patients with Behçet’s syndrome: a prospective controlled study. Clin Exp Rheumatol. 2014 Jul-Aug;32(4 Suppl 84):S175. PubMed PMID: 25268670.
- Lightman S, Taylor SR, Bunce C, Longhurst H, Lynn W, Moots R, et al. Pegylated interferon-α-2b reduces corticosteroid requirement in patients with Behçet’s disease with upregulation of circulating regulatory T cells and reduction of Th17. Ann Rheum Dis. 2015 Jun;74(6):1138-44. PubMed PMID: 25269831.
- Hamuryudan V, Mat C, Saip S, Ozyazgan Y, Siva A, Yurdakul S, et al. Thalidomide in the treatment of the mucocutaneous lesions of the Behcet syndrome. A randomized, double-blind, placebo-controlled trial. Ann Intern Med. 1998 Mar 15;128(6):443-50. PubMed PMID: 9499327.
- Grayson PC, Yazici Y, Merideth M, Sen HN, Davis M, Novakovich E, et al. Treatment of mucocutaneous manifestations in Behçet’s disease with anakinra: a pilot open-label study. Arthritis Research & Therapy. 2017 March 24;19(1):69.
- Orlando I, Vitale A, Rigante D, Lopalco G, Fabiani C, Cantarini L. Long-term efficacy and safety of the interleukin-1 inhibitors anakinra and canakinumab in refractory Behcet disease uveitis and concomitant bladder papillary carcinoma. Intern Med J. 2017 Sep;47(9):1086-8. PubMed PMID: 28891187.
- Statkute L, Oyama Y, Barr WG, Sufit R, Ho S, Verda L, et al. Autologous non-myeloablative haematopoietic stem cell transplantation for refractory systemic vasculitis. Ann Rheum Dis. 2008 Jul;67(7):991-7. PubMed PMID: 17947303.
- Mirouse A, Barete S, Desbois AC, Comarmond C, Sene D, Domont F, et al. Long-Term Outcome of Ustekinumab Therapy for Behcet’s Disease. Arthritis & rheumatology (Hoboken, NJ). 2019 Oct;71(10):1727-32. PubMed PMID: 31008548.
- Saadoun D, Wechsler B, Desseaux K, Le Thi Huong D, Amoura Z, Resche-Rigon M, et al. Mortality in Behcet’s disease. Arthritis Rheum. 2010 Sep;62(9):2806-12. PubMed PMID: 20496419.
- Saadoun D, Asli B, Wechsler B, Houman H, Geri G, Desseaux K, et al. Long-term outcome of arterial lesions in Behcet disease: a series of 101 patients. Medicine (Baltimore). 2012 Jan;91(1):18-24. PubMed PMID: 22198498.
