ANDRE SYKDOMMER (REV 063-REV 077)
217 Smerter; non-inflammatorisk smerte, nociceptiv, nevropatisk og nociplastisk smerte (REV 070)
Øyvind Palm and Jan Tore Gran
Non-inflammatoriske smerter
- Kroniske smerter, definert som vedvarende smerte i over tre måneder, er et komplekst helseproblem.
- For å forstå og behandle kroniske smerter bedre, klassifiseres de i tre hovedtyper basert på underliggende mekanismer:
- Nociceptive som skyldes vevsskade
- Nevropatiske som stammer fra nerveskade
- Nociplastiske hvor endret smerteprosessering i sentralnervesystemet er primær.
- Denne differensieringen er avgjørende for målrettet behandling og bedre pasientutfall.
ICD-10: 79.6 (smerte i ekstremitet); R52.9 (uspesifisert smerte). M79.0 (Fibromylagi)
Definisjon
Kronisk smerte defineres ved en varighet på tre måneder eller mer. The International Assosiation for the study of Pain (IASP) definerer smerte som “Ubehagelig sanse- og emosjonell opplevelse assosiert med, eller lignende det som er assosiert med, faktisk eller potensiell vevsskade” (Raja SN, 2020).
For bedre å forstå smerte, kan den deles inn i tre hovedtyper: nociceptiv, nevropatisk og nociplastisk (Anastasiou C, 2022). I praksis overlapper ofte disse hverandre delvis.
Definisjon og klassifisering av smerte
Smerte er en kompleks og subjektiv opplevelse som kan være akutt eller kronisk. Den internasjonale foreningen for smertestudier (IASP) definerer smerte som en “ubehagelig sensorisk og emosjonell opplevelse assosiert med, eller beskrevet i termer av, faktisk eller potensiell vevsskade” (Pain Suppl, 1986). Selv om denne definisjonen er mye brukt, er den ikke perfekt, og det har vært argumentert for en revisjon (Aydede M, 2019).
Typer av smerte
Nociceptiv smerte
Nociceptiv smerte oppstår når nociceptorer, spesialiserte nervefibre som reagerer på skadelige stimuli, aktiveres. Denne typen smerte er vanligvis skarp, lokalisert og forverres ved bevegelse eller trykk. Eksempler på nociceptiv smerte inkluderer:
- Inflammatorisk smerte: Oppstår på grunn av betennelse i vev, som ved revmatoid artritt eller psoriasisartritt.
- Mekanisk smerte: Skyldes skade på vev, for eksempel ved brudd eller forstuing.
Behandling av nociceptiv smerte inkluderer ofte ikke-steroide antiinflammatoriske legemidler (NSAIDs), paracetamol og opioider. Fysioterapi og andre ikke-medikamentelle tiltak kan også være nyttige.
Nevropatisk smerte
Nevropatisk smerte skyldes skade eller dysfunksjon i nervesystemet. Denne typen smerte kan være brennende, stikkende, elektrisk eller prikkende, og kan være ledsaget av nummenhet eller overfølsomhet. Eksempler på nevropatisk smerte inkluderer:
- Diabetisk nevropati: Nerveskade forårsaket av diabetes.
- Postherpetisk nevralgi: Smerte som vedvarer etter et herpes zoster-utbrudd.
- Polynevropati
Behandling av nevropatisk smerte kan være utfordrende, og krever ofte en kombinasjon av ulike medikamenter, som antidepressiva, antiepileptika og opioider.
Nociplastisk smerte
Nociplastisk smerte er en nyere kategori av smerte som ikke skyldes direkte skade eller sykdom i vev eller nervesystem. Denne typen smerte antas å skyldes endringer i måten nervesystemet behandler smertesignaler på og kan være generalisert, vedvarende og vanskelig å behandle. Nociplastisk smerte er den minst forståtte av de kroniske smertetilstandene, men antas å involvere uheldige kretsmekanismer i sentralnervesystemet (Fizcharles MA, 2021). Eksempler på nociplastisk smerte inkluderer (Kosek E, 2016):
- Fibromyalgi: En kronisk smertetilstand med ukjent årsak.
- Irritabel tarmsyndrom (IBS): En funksjonell mage-tarmlidelse med kroniske magesmerter.
- Uspesifiserte kroniske korsryggsmerter.
Behandling av nociplastisk smerte er ofte kompleks og krever en tverrfaglig tilnærming, inkludert medikamentell behandling, fysioterapi, kognitiv atferdsterapi og andre ikke-medikamentelle tiltak.
Kombinert eller overlappende smerte
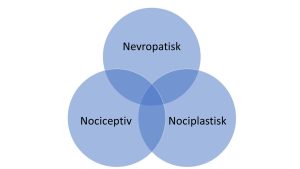
Det er ikke uvanlig at pasienter opplever en kombinasjon av ulike smertetyper, eller at smertemekanismene overlapper. For eksempel er fibromyalgi, en form for nociplastisk smerte, vanligere hos pasienter med revmatoid artritt enn i befolkningen ellers. Dette kan skyldes at langvarig smerte ved kronisk revmatisk sykdom kan føre til økt sensitivitet i sentralnervesystemet, noe som bidrar til utvikling av nociplastisk smerte (Ranzolin A 2009; Wolfe F, 2011; Lee YC, 2011; Arendt-Nielsen L, 2010).
Årsaker til smerte ved revmatiske sykdommer.
Alle autoimmune revmatiske sykdommer kan forårsake akutt og kronisk smerte. Årsaker til smerte ved revmatiske sykdommer kan være (Anastasiou C, 2022):
- Aktiv inflammasjon/sykdomsaktivitet
- Akkumulert skade fra sykdom eller behandling
- Traumer
- Nevrologiske komplikasjoner
- Nevropatiske smerter
- Sentrale smertetilstander
Undersøkelser
En grundig smertevurdering er viktig for å kunne tilby optimal behandling (Helsedirektoratet). Dette inkluderer:
Anamnese. Kartlegging av smertevarighet, intensitet, mønster, lokalisasjon, ledsagende symptomer, søvn, komorbiditet, psykososiale forhold og bruk av medikamenter og rusmidler.
Klinisk undersøkelse: Inkludert en orienterende nevrologisk vurdering.
Standardiserte kartleggingsverktøy: Kan brukes for å vurdere smerteintensitet og påvirkning på funksjon og livskvalitet.
Laboratorieprøver For å vurdere infeksjonsstatus, kalsiumnivå og alkalisk fosfatase (ALP).
Bildediagnostikk: Røntgen, CT, MR og ultralyd kan være nyttig for å avdekke strukturelle årsaker til smerte (Helsedirektoratet).
Forekomst
Muskel- og skjelettsymptomer er såpass vanlig at 75 – 80 % opplever i løpet av en måned smerter eller plager fra muskel- og skjelettsystemet (Ihlebaek C, 2007). De fleste er selvbegrensende og kortvarige. Likevel fant Helseundersøkelsen i Nord-Trøndelag (HUNT) en insidens for muskel- og skjelettplager med varighet over to uker siste måned på 7,9 % (Hagen K, 2006), og 51 % av befolkningen rapporterte muskel- og skjelettsymptomer med varighet i tre måneder eller mer siste år (Holth HS, 2008). Flere kvinner enn menn rapporterer muskel- og skjelettsmerter og man ser generelt en økning i forekomsten med økende alder. Forekomsten av denne typen lidelser holder seg stabil i befolkningen over tid (Statistisk sentralbyrå).
Diagnostikk
Utbredelsen av kronisk revmatisk smerte kan være generalisert, lokalisert/regional, nociceptiv, nevropatisk eller nociplastisk. I klinisk praksis møter revmatologen mange andre smertetilstander som kan forveksles med revmatisk sykdom. En vanlig måte å kvantifisere smerte på er å la pasienten markere smerteintensiteten på en skala fra 0-10. Imidlertid kan målingene medføre for mye fokus på medikamenteffekt og overforbruk av opioide analgetika (Ballantyne JC, 2015). I tillegg vil målinger av smerteintensitet ikke gjenspeile hele aspektet av smerteopplevelse. En ikke måler lidelsen som smerte medfører (Edwards RR, 2017).
| Tre kategoriser smerte og eksempler på disse (Wang J, 2024) | |||
| Kategori | Eksempler | Lokalisering | Supplerende smertesymptomer |
| Nociceptiv | Artrose, urinsyregikt | Typisk lokalisert smerte | Ingen |
| Nevropatisk | Smerte ved diabetisk perifer nevropati, postherpetisk nevropati | Nevroanatomisk utbredelse | Parestesier, nedsatt sensibilitet |
| Nociplastisk | Fibromyalgi | non-nevroanatomisk utbredelse | Fatigue, kognitive symptomer, søvnforstyrrelser |
For å kunne diagnostisere og behandle pasienter med kroniske smertetilstander forsøker en å identifisere bakenforliggende årsak eller sikre at slik tilstand ikke foreligger. Undersøkelsesmetoden (se ovenfor) krever initialt en nøyaktig anamnese og generell klinisk undersøkelse. Supplerende blod- og urinprøver kan vise tegn til om tegn til systemisk inflammasjon eller organ-manifestasjoner foreligger. Om nødvendig suppleres med bildediagnostikk og spesialundersøkelser.
Nedenfor er en liste, delvis med lenker til aktuelle sykdommer og supplerende informasjon:
Generalisert non-inflammatorisk smerte
- Artralgi
- Fibromyalgi
- Nevropati (polynevropati)
- Skjelettsmerter
Lokalisert non-inflammatorisk smerte
- Abdominale smerter (Irritabel tarm syndrom, IBS)
- Adhesiv kapsulitt (Frozen shoulder)
- Algodystrofi (refleksdystrofi)
- Artralgi
- Brystsmerter (perikarditt, pleuritt, vaskulitt, aneurismer)
- Isjas
- Karpal tunnel syndrom (Canalsi Carpi)
- Lumbago
- Lyske og lår-smerter
- Mononevritt
- Øye-smerter
Behandling av kronisk smerte
Uavhengig av smertekategori er den nåværende kliniske tilnærmingen en multimodal behandlingsstrategi for kronisk smerte. Denne tilnærmingen inkluderer smertestillende legemidler, kirurgiske teknikker, stimuleringsteknikker, fysioterapi, og psykologiske tilnærminger og mestringstrening som ofte kombineres. Fysisk aktivitet er også vist å kunne forebygge kronifisering og konsekvenser av muskel- og skjelettsmerter (Holth HS, 2008). Persontilpasset medisin for kronisk smerte er viktig, men fortsatt en utfordring.
Behandling av nociceptiv smerte
Behandlingen av kronisk, non-cancer relatert, nociceptiv smerte er best studert og støttet av bedre evidens enn for andre kroniske smertetilstander. Farmakologiske alternativer inkluderer NSAIDs, paracetamol, antidepressiva og opioider. .Medikamenter mot smerter er beskrevet i et eget kapittel
NSAIDs. Systematiske oversikter og metaanalyser av randomiserte kontrollerte studier (RCTer) har vist effekt av NSAIDs for uspesifikke kroniske korsryggsmerter. En analyse fra 2016 av seks studier med 1354 deltakere viste en signifikant smertelindring og bedring i funksjon til fordel for NSAIDs sammenlignet med placebo (Enthoven WTM, 2016). Topikale NSAIDs har også vist effekt for kroniske muskelskjelettsmerter, med en risiko for minst 50 % smertelindring på 1.2 (95 % CI 1.1–1.3) for diklofenak og 1.1 (95 % CI 1.01–1.2) for ketoprofen sammenlignet med placebo (Derry S, 2016).
Paracetamol anbefales ofte for nociceptiv smerte på grunn av tilgjengelighet og gunstig bivirkningsprofil ved lave til moderate doser (< 3 g daglig). En systematisk oversikt fra 2015 fant imidlertid ingen fordeler med paracetamol over placebo for uspesifikke spinale smerter. For hofte- eller kneartrose viste paracetamol en liten, men statistisk signifikant reduksjon i smerteintensitet (Machado GC, 2015).
Antidepressiva, som serotonin-noradrenalin-gjenopptakshemmere (SNRI) og trisykliske antidepressiva (TCA) er førstelinjemidler for nevropatisk smerte, men har også vist effekt ved nociceptive smertetilstander. En systematisk oversikt fra 2022 av RCTer for hofte- og kneartrosesmerter viste en liten, men konsistent fordel av antidepressiva for smertelindring, med et NNT på 6 (95 % CI 4–11) for minst 50 % smertelindring (Leaney AA, 2022).
Opioider har lenge vært en grunnpilar i kronisk smertebehandling. En systematisk oversikt og metaanalyse fra 2018 av RCTer sammenlignet opioider med ikke-opioider for kronisk ikke-kreftrelatert smerte. Resultatene viste en liten fordel for opioider over placebo for smertelindring, men ingen klinisk signifikant forbedring i fysisk funksjon (²⁰. Studier har også vist ingen signifikant forskjell mellom opioider og NSAIDs, eller opioider og nortriptylin for smertelindring (Busse JW, 2018). Til tross for dette brukte rundt 22 % av voksne med kronisk smerte i USA reseptbelagte opioider de siste tre månedene, basert på data fra 2019 (Dahlhamer JM, 2021). Retningslinjer for opioidforskrivning anbefaler en individualisert, pasientsentrert tilnærming (Dowel D, 2022). Bekymringer har oppstått rundt feil anvendelse av retningslinjer, som for eksempel brå nedtrapping, som kan være assosiert med økt risiko for overdose og mentale helsekriser (Magnan EM, 2023).
Behandling av nevropatisk smerte
Forståelse av patofysiologien bak kronisk nevropatisk smerte er fortsatt utilstrekkelig, noe som begrenser behandlingsalternativene. I 2015 gjennomførte Neuropathic Pain Special Interest Group (NeuPSIG) en systematisk oversikt og metaanalyse av farmakologiske behandlinger for nevropatisk smerte. Basert på denne ble SNRI, TCA og gabapentinoider (f.eks. gabapentin og pregabalin) anbefalt som førstelinjebehandling. Andrelinjebehandlinger inkluderte kapsaicin 8 % plaster, lidokainplaster og tramadol, mens botulinumtoksin A og sterkere opioider ble anbefalt som tredjelinjebehandlinger. Generelt var behandlingseffektene for førstelinjemidlene moderate, med NNT-verdier fra 3.6 til 7.7 for å oppnå smertelindring. Bivirkninger inkluderer antikolinerge og sedative effekter for TCA, gastrointestinalt ubehag og søvnløshet for SNRI, samt sedative effekter og perifert ødem for gabapentinoider (Finnerup NB, 2015).
Behandling av nociplastisk smerte
Nociplastisk smerte behandles typisk med medikamenter som brukes mot nevropatisk smerte. Fibromyalgi er den prototypske nociplastiske smertetilstanden med typisk diffuse muskelskjelettsmerter, depresjon, fatigue og søvnforstyrrelser. Ubehandlede depressive symptomer og dårlig søvnkvalitet er assosiert med dårligere utfall ved behandling av fibromyalgi (Munipalli B, 2022; Andrade A, 2020).
En systematisk oversikt og nettverksmetaanalyse fra 2022 av farmakoterapier for fibromyalgi viste at duloksetin (SNRI) var assosiert med størst smertelindring sammenlignet med placebo. Amitriptylin (TCA) var assosiert med de største forbedringene i søvn, mens duloksetin og pregabalin viste størst forbedring i depressive symptomer. SNRI, TCA og gabapentinoider anses som sentrale elementer i det terapeutiske regimet for nociplastisk smerte, ofte supplert med paracetamol (Farag HM, 2022). Til tross for begrenset suksess med tilgjengelige anti-nevropatiske midler, viser nociplastisk smerte en relativt høy grad av behandlingsresistens.
Nye farmakologiske tilnærminger
Nyere forskning har fokusert på spenningsstyrte natriumkanaler (Nav1.7 og Nav1.8) som potensielle terapeutiske mål for smertelindring. Flere kliniske studier med selektive hemmere av disse kanalene, som VX-548, har vist lovende resultater for akutt postoperativ smerte, med effekt sammenlignbar med hydrokodon-paracetamol kombinasjoner. Forskning pågår også for kronisk nevropatisk smerte (Jones J, 2023). Et annet eksempel er tetrodotoksin (TTX) som blokkerer visse spenningsstyrte natriumkanaler, og er under utprøving for kjemoterapi-indusert nevropatisk smerte (Goldlust SA, 2021). Disse studiene kan potensielt føre til nye, ikke-avhengighetsskapende analgetika.
Ikke-farmakologiske tilnærminger
Revmatologer bør alltid vurdere om pasienten kan ha nytte av ikke-medikamentell behandling, enten som et alternativ til eller i kombinasjon med medikamenter. Sentral sensitivisering, en økt følsomhet for smerte i sentralnervesystemet, kan forverre og kronifisere smerte. Ikke-medikamentelle tiltak som kognitiv atferdsterapi, mestringskurs og tilpasset fysisk aktivitet kan bidra til å redusere sentral sensitivisering og dermed smerte. En tverrfaglig tilnærming med fysioterapeuter, ergoterapeuter og sykepleiere kan være nyttig for å optimalisere behandlingen (Knittle K, 2010).
Fysikalsk behandling kan inkludere fysioterapi, trening og transkutan elektrisk nervestimulering (TENS). Fysisk trening har vist seg å forbedre fysisk funksjon betydelig, selv om smertescorene ikke alltid endres konsekvent (Geneen LJ, 2017). TENS har vist moderat effekt på smertelindring sammenlignet med placebo (Johnson M, 2022).
Psykologiske og atferdsmessige tilnærminger er spesielt relevante i den biopsykososiale smertemodellen. Kognitiv atferdsterapi (KBT) har vist en liten, men konsistent fordel for smertelindring, funksjonshemning og ubehag. Andre tilnærminger som atferdsterapi (AT) og aksept- og forpliktelsesterapi (ACT) har vist mer blandede resultater (Williams AQCdC, 2020). Nylige innovasjoner inkluderer Pain Reprocessing Therapy (PRT) som fokuserer på å redusere sentral smerteprosessering. En randomisert studie viste signifikant smertelindring og en høyere andel pasienter med minimal smerte etter PRT sammenlignet med placebo og vanlig behandling, med vedvarende effekter etter ett år ((Williams AQCdC, 2020).
Komplementære behandlingsformer som sinn-kropp-intervensjoner, akupunktur og yoga kan også spille en rolle. Akupunktur har vist moderate effektstørrelser sammenlignet med ingen akupunktur for ulike kroniske smertetilstander, noe som indikerer en potensiell rolle som supplement til andre behandlinger (Vicker AJ, 2018).
Intervensjonelle terapier: Intervensjonelle smerteprosedyrer kan være en viktig del av multimodal behandling. For ryggsmerter inkluderer alternativer epidurale steroidinjeksjoner og radiofrekvensnevrotomi av mediale grenner (Sharma AK, 2017; Smith CC, 2020). For leddsmerter brukes leddinjeksjoner og fysioterapiterapi. Nevromodulasjon, inkludert perifernervestimulering og ryggmargsstimulering (SCS), er FDA-godkjent for pasienter som ikke responderer på annen behandling (Schneider BJ, 2020; Knotkova H, 2021). SCS har vist smertelindrende effekt hos over 50 % av pasientene, spesielt ved radikulære smerter, “failed back surgery syndrome”, diabetisk perifer nevropati og iskemisk brystsmerte (Deer TR, 2014); Taylor RS, 2014; Grider JS, 2016). Til tross for effekt er bivirkninger som parestesier vanlige (Deer TR, 2014).
| Systematisk gjennomgang- av behandlinger og behandlingseffekt ved kroniske smerter (modifisert etter Wang J, 2024) | |||||
| Klinisk populasjon | Intervensjon | Antall studier | Antall inkluderte pasienter | Funn | Referanser |
| —Medikament-studier— | |||||
| Kroniske korsryggsmerter (low back pain) | NSAIDs | 6 placebo-kontrollerte RCT’er | 1.354 | NSAIDs var bedre enn placebo ved median oppfølging på 56 dager | Entoven WTM, 2016 |
| Kroniske muskelskjelettsmerter ved artrose | Topikale NSAIDs | 10 placebo-kontrollerte RCT’er | 4.926 | Topikale NSAIDs var bedre enn placebo i studier over 6-12 uker | Derry S, 2016 |
| Spinal smerte | Paracetamol | 3 placebo-kontrollerte RCT’er | 3.344 | Ingen forskjell | Machado GC 2015 |
| Hofte- og kneartrose | Paracetamol | 12 placebo-kontrollerte RCT’er | 4.894 | En liten fordel av paracetamol over placebo | Machado GC 2015 |
| Hofte- og kneartrose | Antidepressiva | 9 placebo-kontrollerte RCT’er | 2.122 | Non-klinisk bedring for antidepressiva mot placebo. En liten del av pasientene anga >50% bedring av smertene med antidepressiva | Leaney AA, 2022 |
| Kroniske non-cancersmerter | Opioider | 9 placebo-kontrollerte RCT’er: opioider mot NSAIDs | 1.431 | Ingen forskjell | Busse JW, 2018 |
| kroniske non-cancersmerter | Opioider | placebo-kontrollerte RCT’er: opioider mot nortriptylin (Noritren) | 246 | Ingen forskjell | Busse JW, 2018 |
| Nevropatisk smerte | Nevropati-medikasjon | 229 placebo-kontrollerte RCT’er | – | Første-linjebehandling er gabapenmtin, pregabalin, serotonin-norepinefrin reopptakshemmere (SNRI) og tricykliske antidepressiva | Finnerup NB, 2022 |
| Fibromyalgi | aminotryptilin, pregabalin, SNRI | 36 placebo-kontrollerte RCT’er | 11.930 | Duloxetin (Cymbalta) hadde størst effekt mot placebo | Fara HM, 2022 |
| —Studier av fysikalsk behandling— | |||||
| Kronisk non-cancersmerte | Fysisk aktivitet/trening | 21 placebo-kontrollerte RCT’er | 19.642 | Motstridende funn for smerteintensitet, men bedring av fysisk funksjon med trening | Geneen LJ, 2017 |
| Kronisk smerte (utenom hodepine) | Transkutan nervestimulering (TENS) | 8 placebo-kontrollerte RCT’er | 2.895 | På grunn av veldig lav kvalitet på studiene kunne en ikke trekke noen sikker konklusjon for virkningen på kort sikt | Gibson W, 2019 |
| Akutt og kronisk smerte | TENS | 381 placebo-kontrollerte RCT’er | 24.532 | Effekt av TENS sammenlignet med andre behandlinger under eller umiddelbart etter TENS | Johnson MI, 2022 |
| —Studier på adferdsterapi— | |||||
| Kronisk non-cancersmerte (utenom hodepine) | Kognitiv adferdsterapi (CBT) | 23 placebo-kontrollerte RCT’er | 3.235 | En liten fordel av CBT over aktiv kontroll | Williams AC, 2020 |
| Kronisk non-cancersmerte (utenom hodepine) | Adferdsterapi (BT) | 8 placebo-kontrollerte RCT’er for BT mot kontroll | 647 | Ingen forskjell | Williams AC, 2020 |
| Kronisk non-cancersmerte (utenom hodepine) | Aksept og verdibasert adferdsterapi (ACT) | 5 placebo-kontrollerte RCT’er ACT mot aktiv kontroll | 443 | Ingen forskjell | Williams AC, 2020 |
| —Alternativ behandling— | |||||
| Muskelskjelettsmerte, kronisk hodepine | Akupunktur | 39 placebo-kontrollerte RCT’er: akupunktur mot placebo (narre-akupunktur) | 20.827 | Effekt av akupunktur sammenlignet med placebo og med ingen akupunktur | Vickers AJ, 2018 |
Historie
- På 1500-tallet refererte Guillaume de Baillou til noe som ble kalt “muskulær revmatisme” for å beskrive diffuse smerter i bløtvevet. På 1800-tallet var det mange som trodde at muskelsmerter var en sykdom i selve muskelen, og at vonde knuter man kunne kjenne i musklene var et tegn på dette.
- I antikken og middelalderen var smertelindring ofte knyttet til religiøse forklaringer og forsøk på å gjenopprette kroppens balanse. Urter med smertelindrende egenskaper, som opium, har vært brukt i lang tid.
- “Gate control theory” på midten av 1900-tallet foreslo at smerteimpulser kan moduleres i ryggmargen, noe som åpnet for nye måter å tenke på smertelindring. I dag anerkjennes muskelsmerter ofte innenfor en biopsykososial modell, som tar hensyn til biologiske, psykologiske og sosiale faktorer i opplevelsen av smerte.
Retningslinjer
EULAR: Geenen R, 2017 (management)
ACR: Task force 2010 (management)
Litteratur
Fayaz A, 2015 (forekomst i Storbritannia)
