VASKULITT (REV 034-052)
81 Arteritis Temporalis (AT)/Temporalisarteritt/Kjempecellearteritt (GCA) og ekstrakranial/non-kranial storkarsvaskulitt (REV 034)
Øyvind Palm and Jan Tore Gran
Kjennetegn på temporalisarteritt og ekstrakranial storkarsvaskulitt
Alle er over 50 år, de fleste også over 65 års alder.
Tydelig forhøyet CRP og SR.
Tinning-hodepine er ikke alltid til stede, selv om temporal arterien er affisert.
Non-kranial storkarsvaskulitt kjennetegnes ved noe lavere alder, flere kvinner, diffuse eller ingen åpenbare vaskulitt-symptomer (“silent vasculitis”) og lengre latenstid før diagnose enn ved arteritis temporalis.
Polymyalgia revmatika kan forekommer samtidig både med og uten temporalarterie-affeksjon.
Ultralyd, CT eller PET/CT viser ev tegn på vaskulitt i store arterier.
Diagnosekoder ICD-10:: M31.6 (uten polymyalgia), M31.5 med polymyalgia. M31.9 Uspesifisert nekrotiserende vaskulitt
Prosedyrer: EKG: FPFE15
ATC koder (for legemiddelstatistikk): Prednisolon: H02A B06 Immunsuppressive legemidler: L04A A
Nøkkelord for journalskriving
Diagnosen er basert på
- Alder 50 år eller eldre ved symptomdebut (sjelden før 60 års alder).
- Generell sykdomsfølelse, nattesvette, feber, vekttap (antall kg over bestemt tidsrom).
- Nyoppstått ensidig eller bilateral hodepine.
- Lokal ømhet, pulsreduksjon og promenerende a. temporalis uni- eller bilateralt over en av hodets overfladiske arterier, særlig a. temporalis indikerer arteritis temporalis.
- Synsforstyrrelser (plutselig flimmer-syn, diplopi, redusert synsfelt). Øyelege-vurdering.
- Polymyalgia revmatika hos 40% (morgenstivhet i skuldre/nakke)
- Tygge-klaudikasjon (iskemisk smerte under tygging), øm hodebunn (skalpømhet), kjevesperre, hørselstap, vertigo.
- Forhøyet CRP og/eller SR (maksimale og aktuelle verdier)
- Ultralyd av arterier (a. temporalis, a. axillaris) som viser “halo”
- PET/CT suspekt på vaskulitt i store kar
- Arteriebiopsi med transmural inflammasjon eller kjempeceller, andre histologiske funn
- TIA eller slag i sykdomsforløpet
- Aortaaneurisme i forløpet
Tidspunkt for sykdomsdebut og debutsymptom
Behandling med kortikosteroider (doser), ev. DMARDs og biologiske legemidler.
Årsak til konsultasjonen
Definisjon
Arteritis temporalis (AT)/temporal arteritis/storkarsvaskulitt/kjempecellearteritt er en vaskulitt-sykdom som angriper personer over 50 års alder. AT klassifiseres blant vaskulitter i store- og mellom-kar (storkarsvaskulitt) sammen med Takayasus arteritt, Cogans syndrom og isolert aortitt.
AT kalles også kjempecellearteritt (engelsk: “giant cell arteritis, GCA”) fordi man histologisk kan finne kjempeceller i biopsi.
Alle navnene (arteritis temporalis, storkarsvaskulitt, kjempecellearteritt og temporalis arteritt) blir brukt. Muligens er det en økende tendens til å bruke storkarsvaskulitt som et overordnet begrep, fordi det inkluderer både de kraniale (hodet) og ikke-kraniale (resten av kroppen) manifestasjonene.
Storkarsvaskulitten kan deles inn i grupper etter lokalisering og sykdomsutbredelse:
- Kranial arteritt. Inflammasjonen påvises oftest i de mellom-store temporalis-arteriene i tinninger og (sjeldnere) i occipitalis-arteriene (bakhodet). Blodforsyning kan bli kritisk til øyne (risiko for blindhet), kjevemuskler (tyggeklaudikasjon) og skalpen (skalpsmerter/nekrose) .
- Kombinert kranial og ekstakranial arteritt kan også ramme store arterier som aorta, a. axillaris, a. carotis, a. subclavia og a. brachialis (mixed AT).
- Non-kranial/ekstrakranial storkarsvaskulitt angriper store arterier, men kraniale arterier angripes ikke. Ellers ligner sykdommen på AT. Fravær av karakteristiske symptomer gjør denne formen vanskelige å gjenkjenne uten målrettet bildediagnostikk (“silent vasculitis”). Typisk er systemisk inflammasjon hos eldre personer med risiko for aneurismer senere i forløpet (Lensen KDF, 2016).
Polymyalgia revmatika (PMR). Nær halvparten av pasientene med arteritis temporalis eller non-kranial storkarsvaskulitt får raskt innsettende proksimale muskelsmerter i form av polymyalgia revmatika (PMR) (Pugh D, 2022).
Juvenil arteritis temporalis er en sjelden sykdom som medfører fortykket arteria temporalis hos unge personer (Kolman OK, 2009). Vennligst se mer under “Spesielle sykdomsgrupper” nedenfor.
Historikk
Den medisinske historien bak AT går tilbake til 1800-tallet. Før man hadde god kunnskap om dem, ble de ofte sett på som uspesifikke, revmatiske lidelser.
I malerkunst mener noen å finne den første dokumentasjonen av arteritis temporalis (AT) alleredere fra 1436 i Jan van Eycks (1385-1440) maleri “The Holy Virgin with Canon van der Paele” (Brugge Gemeenter museum). Man ser at venstre temporalarterie på den gamle mannen prominerer betydelig (vennligst se illustrasjonen nedenfor). Etter sigende skulle han også ha hatt vansker med å forrette morgengudstjenesten på grunn av generell stivhet (polymyalgia revmatika?) og nedsatt allmenntilstand.
Ca. 450 år senere beskrev Sir Jonathan Hutchinson (1828-1913, London) AT i 1890 (“thrombotic arteritis of the aged”) (Pearce JM, 1994).
De histologiske forandringene i tinningarteriene ble beskrevet av Bayard T. Horton (1895-1980) ved Mayo klinikken i 1932 (Horton BT, 1946). Dette førte til at sykdommen hovedsakelig ble assosiert med hodepine og andre symptomer fra hoderegionen.
Den non-kraniale/ekstrakraniale formen ble før moderne bildediagnostikk ble tilgjengelig ansett som sjelden eller ikke-eksisterende. Utviklingen av ultralyd, MR-angiografi og PET/CT fra 1990- og 2000-tallet har endret dette. Dette har vist at den ikke-kraniale formen av GCA er mye vanligere enn man tidligere antok. Disse funnene har ført til at American College of Rheumatology (ACR) og European League Against Rheumatism (EULAR) etablerte nye kriterier som inkluderer ekstrakranial vaskulitt for diagnosen.
Insidensen av temporalis arteritt i Norge ble første gang estimert i Aust-Agder (Gran JT, 1997).

Epidemiologi
Årlig insidens av AT per 100 000 innbyggere 50 år eller eldre varierer fra 5,1-33,6. I Norge er den beregnet til 20,7-29 per 100 000 i aldersgruppen 50 år og eldre og 8-9 per 100 000 i hele befolkningen (Gran JT, 1997; Skaug HK, 2023). Kvinner angripes litt oftere enn menn (Salvarani C, 2008).
Forekomsten av ekstrakranial manifestasjon var tidligere estimert til 3-15% (Klein RG 1975), men med nyere bildediagnostikk er forekomsten korrigert til 50-70%. Enkelte studier har viste enda høyere forekomst (83%) (Blockmans D, 2006). En eldre autopsistudie fant ekstrakranial arteritt hos hele 92% (Östberg G, 1973).
Sykdommen er mye vanligere blant etnisk skandinaviere enn personer av Sør-Europeisk, Asiatisk eller Afrikansk opphav (Watts RA, 2022).
Ekstrakranial storkarsvaskulitt. Det er ikke gjort epidemiologiske studier på uspesifisert ekstrakranial storkarsvaskulitt, men forekomsten kan være høyere enn for arteritis temporalis (Lensen KDF, 2016).
Etiologi
Sykdomsårsaken ved AT er ikke avklart, men genetiske forhold kombinert med aldrings prosesser i immunsystemet antas å være viktige faktorer (Weyand CM, 2023). Soleksposisjon, mikrobiota (tarm- og vaskulær mikrobiota), samt virus som varicella zoster og vaksinasjoner har også blitt foreslått som mulige utløsende faktorer.
G-CSF. En sjelden gang (mellom 1 per 1000 og 1 per 10 000) er aortitt utløst av granulocyttkolonistimulerende faktor (G-CSF). En slik bivirkning av G-CSF etter for eksempel kreftbehandling bør mistenkes dersom feber og vedvarende forhøyede inflammasjonsparametere foreligger (Gaustad A, 2025).
Patogenese
Temporalis arteritt er en autoimmun sykdom i medium- og store arterier. Den kjennetegnes ved granulomatøs inflammasjon i alle tre lag av arterieveggene, noe som resulterer i kjempeceller, stenoser, okklusjoner, disseksjoner og aneurismer. Patogenesen er kompleks og involverer celler fra det medfødte og det adaptive immunsystemet.
Immunsystemet og inflammasjonen
Utviklingen av AT er en gradvis prosess som starter med asymptomatiske forandringer i immunsystemet. Over tid kan dette føre til ukontrollert aktivitet i det inate immunsystemet (autoinflammasjon) med akutt faserespons og ekstravaskulære manifestasjoner. Senere kan toleransen mot eget vev brytes ned, og det adaptive immunsystemet forårsaker progressiv inflammasjonen i arteriene. (Weyand CM, 2023).
Den transmurale inflammasjonen er hovedsakelig ekstrakranialt og strekker seg vanligvis ikke mer enn 5 mm. forbi penetrasjonen av dura. Årsaken kan være at lamina elastica som er en del av arterieveggen spiller en sentral rolle. Når f. eks. arteria vertebralis passerer gjennom dura, reduseres den totale mengden elastiske fibre betydelig. Lamina elastica externa som ligger mellom adventitia og media kan ikke lenger gjenfinnes. Likevel forekommer intrakranial arterieaffeksjon, hovedsakelig som intrakraniale aneurismer, i enkelte tilfeller (Prasad V, 2024).
Immunpatologien er kompliser og ikke helt ut forstått. Man ser at dendrittiske celler (DCs) i karveggen aktiveres av ukjente mikrobielle eller cellulære molekyler. DC produserer så IL-12, IL-6 og IL-23. Th1-celler produserer IFN-γ og GM-CSF, mens Th17-celler produserer IL-17 som videre aktiverer makrofager. Makrofager bidrar til granulomdannelse og produserer matrisemetalloproteinase 9 (MMP9) som bryter ned arterieveggens matriks (Paroli M, 2024).
Kjempeceller er flerkjernede, klassisk aktiverte makrofager og Langerhans kjempeceller. Selv om betegnelsen “kjempecelleartritt” brukes om arteritis temporalis er disse kjempecellene ikke unike for tilstanden. De kan påvises også ved blant annet Takayasus arteritt, granulomatose med polyangiitt (GPA/Wegeners), fremmedlegemer, sarkoidose, infeksjoner og i lungevev ved COVID-19 infeksjon (Tian S, 2020; Bajocci, 2018).
Ekstrakranial storkarsvaskulitt
Patogenese og histopatologi ved uspesifisert ekstrakranial storkarsvaskulitt er ikke godt undersøkt, men antas å være lik den ved arteritis temporalis (Lensen KDF, 2016). Årsaken til at kraniale arterier ikke angripes er ukjent.
Symptomer
Klassisk arteritis temporalis, kranial form
Ved klassisk, kranial At er en gradvis eller akutt utvikling av smerter i hodet kombinert med allmennsymptomer typisk. Generelt har de eldste pasientene oftere kraniale symptomer, mens de yngre preges mer av fatigue, febertendens og andre tegn på høy systemisk inflammasjon (Monti S, 2023). Symptomene forårsakes av vaskulær iskemi kombinert med tegn på cytokin-mediert lokal og systemisk inflammasjon. Symptomene kan omfatte
- Hodepine (oftest unilateralt i tinning)
- Kjeve-klaudikasjon
- Transistent synstap
- Ubehag i svelget og/eller heshet
- Skalpømhet (hodebunnen)
Ubehandlet er spesielt permanent synstap og hjerneslag fryktede komplikasjoner. Andre alvorlige komplikasjoner er aortaaneurisme, disseksjon og ruptur (Prior JA, 2017).
Allmennsymptomer omfatter ny utmattelse/fatigue, nattesvette, lavgradig feber, nedsatt appetitt og vekttap. Feber observeres i opp til 40% av tilfellene. Symptomet utgjør 15% av tilstander som utredes for med feber av ukjent årsak blant personer >65 år (Smetana GW, 2002; Myklebust G, 1996).
Aortaaneurisme: Forekomsten av aortaaneurisme ved diagnose av biopsiverifisert AT er beregnet til ca. 8% totalt og 10% etter 5 års sykdomsforløp (Koster MJ, 2021). Menn etter 65 års alder er mest utsatt (Monti S, 2023). I motsetning til aterosklerotiske aneurismer er omtrent 80% thorakale og 20% abdominale.
Aneurismeutvikling synes ikke å være korrelert til klinisk sykdomsaktivitet, da manifestasjonene kan oppstå ved medikamentelt godt kontrollert sykdom og i klinisk sykdomsremisjon. Imidlertid har studier med PET/CT vist at FDG-opptak likevel kan foreligge og øker risikoen for senere aneurismer (Blockmans D, 2024; Moreel L, 2023).
At subklinisk inflammasjon kan være av betydning passer med resultater fra biopsi-studie som viste at 50% hadde inflammatoriske forandringer i a. temporalis etter ett år til tross for full-dose kortikosteroid-behandling (Malszewski JJ, 2017). Ser en på histologien ved aortaaneurismer er forekomsten av aktiv inflammasjon enda høyere, selv etter seks år fra sykdomsdebut (Kaymakci MS, 2023).
Patogenetisk antas aneurismeutviklingen å være følger av inflammatoriske skader på media, intima og lamina elastica interna i blodåreveggene kombinert med det høye trykket som arterievegger utsettes for.
Audiovestibulære manifestasjoner (sjelden): Hørselstap, tinnitus, vertigo, spontan nystagmus, øresmerter ses ved AT, men forventes ikke ved utelukkende ekstrakranial sykdom (Amor-Dorado JC, 2003).
Hals og svelg. Opp til 10% av pasientene merker irritert, tørt svelg med heshet, tørrhoste eller noe ekspektorat. Årsaken antas å være iskemi i svelget (Ameer RA, 2023).
Hjerteinfarkt kan ses hyppigere etter diagnostisert AT eller polymyalgia revmatika. Menn med hypertensjon er spesielt utsatt (Uddhammar A, 2002; Pujades-Rodrigues M, 2020). Omtrent halvparten skjer innen tre måneder før eller etter debut eller residiv av AT. Årsakene er til dels ruptur av plakk relatert til eksaserbasjon av aterosklerose vaskulopati (type 1). Det er omdiskutert om også risikoen for arteritt i koronarkar (type2) uten plakk er økt (Ungprasert P, 2015).
Hodesmertene er nye og lokaliseres oftest temporalt, sjeldnere frontalt, oksipitalt eller er generaliserte. Noen opplever nummenhet og smerte i hele skalpen/hårbunnen ved AT. Symptomene forventes å gå tilbake innen ca. tre dager på behandling med en høy dose kortikosteroider (prednisolon 60mg/dag eller metylprednisolon/SoluMedrol) (Mollan SP, 2020).
Kjeve-klaudikasjon er smerte som oppstår under tygging og må skilles fra andre typer kjeveleddsmerter. Smerter relatert til kjeveområdet skyldes affeksjon av arteriegrener utgående fra a. carotis externa. Foruten klassisk kjeve-klaudikasjon kan iskemi medføre redusert gapeevne, smerter i a. maxillaris gebetet, sår hals, dysfagi og ubehag ved tale. Kjeve- og andre kraniale symptomer forventes ikke ved utelukkende ekstra/non-kranial sykdom (Lim J, 2024).
Klaudikasjon i ekstremiteter er uvanlig. Affeksjon av store arterier fører sjelden til alvorlige stenoser og okklusjoner, men påvises ved bildediagnostikk (CT, MR, ultralyd eller PET/CT). Differensialdiagnostisk bør man ved klaudikasjon i ekstremiteter tenke på Takayasus arteritt, aterosklerose, tromboembolier eller disseksjon. Klinisk iskemi eller nekroser i ekstremiteter er uvanlig, men utelukker ikke diagnosen (Almeida-Morais L, 2016: Watts RA, 1989).
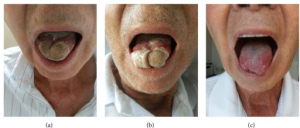
Orale manifestasjoner: Trismus (kjevesperre), svelgsmerte, dysfagi, hoste og sår hals, heshet, dysartri, nummenhet i kinn, glossitt, makroglossi, leppe og tungenekrose, smerte i tennene, hevelser i hode, nakke og ansikt kan forekomme. Ved de orale manifestasjoner må vanligere årsaker til munnsår vurderes differensialdiagnostisk. Disse omfatter karsinom, emboli, rusmidler, resultat av strålebehandling, kjemoterapi, Behcets sykdom, syfilis og tuberkulose (Chehem FCD, 2024).
Perifer artritt forekommer nesten ikke ved AT og omtrent aldri ved diagnose-tidspunkt. Artritt er uvanlig også ved annen storkarsvaskulitt. Imidlertid kan revmatoid artritt og polymyalgia revmatika ha delvis overlappende symptomer ved debut eller oppstå omtrent samtidig/koeksistere (Korkmaz C, 2017).
Polymyalgia revmatika (PMR) forekommer hos ca. 40% og kan debutere før, etter eller samtidig med arteritis temporalis eller uspesifisert ekstrakranial storkarsvaskulitt (Korkmaz C, 2017).
Sentralnervesystemet ved arteritis temporalis:
-Hjerneslag. Hyppigheten av apopleksi ved arteritis temporalis er sannsynligvis noe økt (3%) de første 4 uker av sykdomsforløpet. Hjerneslag i tidlig sykdomsstadium (selv etter påbegynt behandling) utgår oftest fra arteria vertebralis, mens senere i forløpet er arteria carotis-området av større betydning (Gonzalez-Gay, 2009). Insidensen av hjerne slag ved AT etter 50 års alder er estimert til 0,76 per 100.000 (Samson M, 2015).
-Intrakranial vaskulitt. MR-studier har dessuten vist at opptil 15% av pasientene har tegn til intrakranial vaskulitt i minst en arterie (oftest a carotis interna), noe som også kan føre til cerebral iskemi (Guggenberger KV, 2024).
-Annet. Det foreligger kasuistiske meddelelser om tilfeller med ataksi, lateralt medulla syndrom, hemianopsi, demens og hørselstap. Ved angrep av a. facialis/lingualis kan døvhet, tinnitus, smakstap, kjeve-klaudikasjon og tungegangren utvikles (Bonnan C, 2023).
Skalpnekrose kan utvikles lokalt over den affiserte arterien. Slike pasienter har ofte alvorlig AT, selv om hudlesjonen per se vanligvis heles fullstendig (Gran JT, Irgens K. 2007).
Slag. Vennligst se “Sentralnervesystemet” ovenfor.
Synsforstyrrelser eller blindhet utvikles hos 6-20 % av pasientene med AT. De fleste rammes før behandlingsstart, sjeldnere senere i sykdomsforløpet. Den hyppigste årsaken til synstap er anterior iskemisk optikusnevritt på grunn av vaskulitt i de bakre ciliar-arteriene (a. ciliares posteriores). Mer sjeldent er iskemisk retrobulbær nevritt og okklusjon av a. centralis (Heron E, 2022). Ved synstap på ett øye er det overhengende fare (25-50%) for blindhet på det andre øyet dersom behandling ikke iverksettes.
-Synsforstyrrelsene kan opptre som visuelle hallusinasjoner hos ellers psykisk normale personer (Charles-Bonnets syndrom) (Razavi M, 2024).
-Ved diplopi foreligger ofte samtidige okulære iskemiske forandringer.
-Tidlig diagnose og behandling er viktig for å redusere risiko for blindhet. Samarbeid med øyelege/øyeavdeling kan derfor være essensielt.
-Med MR (“black blood modus”) kan opp til 32% av pasientene med AT ha orbitale sykdomstegn, oftest patologisk kontrastopptak i nervus opticus (Guggenberger KV, 2023).
-Sjeldne orbitale manifestasjoner: Øyesmerter, chemose («rødt øye»), episkleritt, ptose, ødem av øyelokk, exophthalmus (proptose), oftalmoplegi, abducens parese (6. hjernenerve), oculomotorius parese (3. hjernenerve). Okulære manifestasjoner forventes ikke ved uspesifisert ekstrakranial storkarsvaskulitt, men amaurosis fugax og andre synsforstyrrelser som følge av iskemi i arteria vertebralis gebetet forekommer ved begge tilstander (vennligst se sentralnervesystemet ovenfor) (Gonzalez-Gay MA, 2000).
| Anatomisk lokalisering | Primære vaskulære lesjoner | Synsforstyrrelser | Klinisk undersøkelse | *Forekomst |
|---|---|---|---|---|
| Orbita | ||||
| Øyemuskler | Grener fra a. oftalmica | †Diplopi (alle typer), oftalmoplegi | Parese i en eller flere ekstraoculære muskler | 5–10% |
| Orbitalt vev | Grener fra a. oftalmica | Diplopi, smerte, konjunktivalt ødem | Øyemotilitet, eksoftalmus, chemose | Sjelden (≤1%) |
| Okulære områder (fra frontal til dorsal) | ||||
| Anteriort segment (ofte generalisert oculær iskemi) | Anteriore ciliaris arterier (a. ophtalmica) | ‡Synstap | Hypotoni, pseudo-uveitt, pupilleavvik | Sjelden (≤1%) |
| Retina | A. centralis retinae | ‡Synstap | Blek, ødematøs retina, kirsebærrød macula, ±”cotton wool spots” | 10% |
| ϕCilioretinal A. okklusjon | 22% | |||
| Choroid | Posteriore ciliære arterier | ‡Synstap | Områder med choroidale infarkter | 10% |
| Opticus nerven: | ||||
| Anteriort | Posteriore ciliære arterier | ‡Synstap | Kalkhvit hevelse i synsnerven (papillødem) ± blødninger rundt synsnervepapillen. Etter 4–6 uker oppstår optisk atrofi. | 80–90% |
| Posteriort | Tilførende arterier til synsnervegrenen. | ‡Synstap | Normal fundus. Opticus-atrofi etter 4–6 uker | 5% |
| Occipitalt i hjernen | Vertebral arterier | ‡Synstap | Homonym lateral hemianopsi (occipitalt hjerneslag) | Sjelden (≤1%) |
Vaskulitt i ekstremitetene: Ekstrakraniale store arterier angripes hos opp til 100% av pasientene som også har biopsiverifisert vaskulitt i a. temporalis. Ved angiografi påvises 20-67% av disse, ved 18FDG PET/CT 83% og ved biopsi kan vaskulitt ses hos alle (Östberg G, 1973; Gribbons KB, 2020). Særlig affiseres aorta og de nærmeste grenene, inklusive a. carotis, a. subclavia og a. brachialis.
Øyet. Vennligst se synsforstyrrelser ovenfor.
Differensialdiagnoser ved akutt hodepine
Subaraknoidal blødning (nakkestivhet), apopleksi (blødning/infarkt), sinusvene-trombose (utreding: CT med venefase), pseudotumor cerebri (stasepapille), meningitt/encefalitt / sinusitt, tumor cerebri, cerebral abscess arterie-disseksjon.
Ekstrakranial/non-kranial storkarsvaskulitt
Ekstrakranial storkarsvaskulitt bør mistenkes blant eldre med vedvarende uklart forhøyede inflammasjonsparametere (CRP, SR) kombinert med enten uspesifikke symptomer eller tegn på perifer arteriell sykdom som ikke skyldes aterosklerose (Lensen KDF, 2016).
Få har symptomer direkte relatert til organaffeksjonen i arteriene (“silent vasculitis”). Diagnostisk forsinkelse er større enn ved klassisk arteritis temporalis (Skaug HK, 2023; Lensen KDF, 2016).
Med sensitiv bildediagnostikk har en i likhet med i autopsistudier, sett at vaskulitt i aorta og tilgrensende store kar er en manifestasjon ved storkarsvaskulitt med eller uten at temporalarteriene er affiserte (Bossert M, 2011; Lensen KDF, 2016). Non-temporal sykdom rammer spesielt pasienter i de litt yngre aldersgruppene. Men også blant pasienter med AT er forekomsten av vaskulitt i store kar vanligere før 65 års alder (65%) sammenlignet med bare 23% hos de > 79 års alder (Monti S, 2023).
Allmenntilstanden er ved ekstrakranial/non-kranial storkarsvaskulitt er påvirket i form av utmattelse, redusert appetitt, vekttap, nattesvette og lett feber, slik som som ved klassisk AT. Polymyalgia revmatika kan ses også ved denne tilstanden og noen utvikler aorta-aneurisme (oftest thorakalt). Symptomene på non-kranial storkarsvaskulitt er lite karakteristiske og forsinker ofte diagnosen, selv om blodprøver indikerer inflammasjon.
Synstap er uvanlig. Pasientene har ikke tinning-smerter eller kjeve-klaudikasjon og øye-symptomer er uvanlig.
Undersøkelser
Diagnostiseringen omfatter anamnese, klinisk undersøkelse, laboratorieprøver, bildediagnostikk, eventuelt a. temporalis-biopsi og i noen tilfeller også øyelegeundersøkelse.
Anamnesen kartlegger aktuelle symptomer hos personer i aktuell aldersgruppe (over 50 år). Spesielt kan man etterspørre:
- Generell sykdomsfølelse som nattesvette og vekttap
- Ny polymyalgi (PMR)
- Ny hodepine, lokal ømhet i tinning
- Nye synsforstyrrelser
- Klaudikasjon under tygging (kjeve-klaudikasjon)
- Skalpømhet
- Sår hals og ny heshet
- Resultat av blodprøver som viser høy CRP og/eller blodsenkning (SR).
- Forutgående behandling med G-CSF kan etterspørres ved aortitt.
Klinisk undersøkelse. I tillegg til en generell status, er det aktuelt å:
- Arteria temporalis kan ved palpasjon være distinkt øm og fortykket i forløpet.
- Occipital-arterier og skalpen palperes ved lokaliserte symptomer.
- Ekstrakranial manifestasjon er klinisk sjelden påvisbar, men en kan palpere perifer puls ved håndledd (a. radialis), på føttene (a. dorsalis pedis eller a tibialis posterior) og på halsen (a. carotis). Stenoser og tegn på redusert blodsirkulasjon forekommer i enkelte tilfeller og tilstanden bør avgrenses fra Takayasus arteritt (med stenoser og okklusjoner).
- Ved auskultasjon undersøkes systematisk for stenoselyder fra arteriestenoser over precordiet, hals, lysker og abdomen. Blodtrykk måles på begge overarmer (asymmetrisk affeksjon i subclavia/ brachialis-arterier).
Laboratorieprøver. Rutineundersøkelse omfatter CRP som viktigste serologiske indikator på inflammasjon. Senkningsreaksjon (SR) er også en god parameter. Det finnes ingen spesifikke tester for arteritis temporalis eller andre typer storkarsvaskulitt.
Supplerende prøver kan omfatte Hb, leukocytter med differensialtellinger, elektrolytter, lever-, nyre- og thyreoidea-funksjonsprøver, kreatin kinase (CK), glukose, HbA1c, proteinelektroforese og urin-stiks. Differensialdiagnostisk kan antistoff som anti-CCP (RA), ANA og ANCA være aktuelt.
Man forventer høye inflammasjonsparametere, hvorav CRP er mer spesifikk enn SR. Veldig tidlig i forløpet kan ca. 10% ha normal CRP eller SR. Deretter utvikler over 95% forhøyede verdier både for SR og CRP. Tresifrede verdier er ikke uvanlig, særlig hvis sykdommen har vært udiagnostisert og ubehandlet over tid. I alt er det funnet at 90% av pasientene har SR >50mm/t, 10% har SR < 50mm/t og 3,6% har SR under 30 mm/t (Kermani TA, 2012). Normale verdier for både SR og CRP sees hos kun 4% av pasientene (Kermani TA, 2012).
Hvis normal CRP, men høy SR bør en differensialdiagnostisk vurdere paraproteinemi med høy IgG eller IgM eller annen blodsykdom. Leukocytose sees hos omkring 1/3 (og nesten alltid etter påbegynt kortikosteroid-behandling). Trombocytose hos 1/3. Tilsvarende funn forventes ved non-kranial/ekstrakranial manifestasjon.
Øyelege. Ved synsforstyrrelser suppleres med snarlig øyelege-undersøkelse. Fundoskopi kan initialt avdekke avblekning og ødem på synsnervepapillen, eventuelt også atrofi. Supplerende orbital bildediagnostikk (OCT, transorbital UL og MR) kan også bidra til å sikre diagnosen (Heron E, 2022).
Bildediagnostikk
Utviklingen av bildediagnostikk har bedret diagnostiseringen av AT betydelig. I dag kan bildeteknikker som ultralyd, MR og PET/CT gi en rask, nøyaktig og ikke-invasiv diagnose. Dermed er behovet for en biopsi av a. temporalis redusert. Tidligere var en biopsi den eneste sikre metoden for å stille diagnosen.
Sammenligner man sensitiviteten, finner en at ultralyd er 70% sensitiv, mens tilsvarende for FDG-PET/CT og MR er henholdsvis 52 og 57% (van Nieuwland M, 2025).
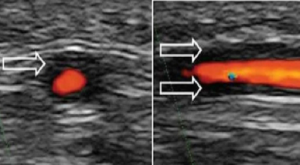
–Ultralyddiagnostikk (UL) anbefales som førstelinje bildediagnostikk. Ultralydapparater er tilgjengelige på alle revmatologiske og radiologiske avdelinger og brukes regelmessig i diagnostikken (Dejaco C, 2023).
–Temporalis-arteriene kan undersøkes initialt, helst supplert med UL av axillaris-arterier (Bosch P, 2023). UL-diagnostikk av disse to regionene identifiserer AT i neste alle tilfellene. Supplerende UL av occipital- og subclavia-arterier eller carotider bidrar mindre til AT-diagnosen og kan utelates for å spare tid (Martins-Martinho J, 2025).
–Dersom en bilateralt finner typiske arteritt-tegn er spesifisiteten nær 100%. En ulempe med UL-undersøkelse er relativ lav sensitivitet, og at denne er avhengig av undersøkerens erfaring (Arida A, 2010). Særlig kan små forandringer i vasa vasorum i tidlig sykdomsfase overses ved UL (Restuccia G, 2012). En annen ulempe er at undersøkelsen ofte tar 15-20 minutter av konsultasjonstiden.
–Det er utviklet et OMERACT skåringssystem for vurdering av temporalis arteritt (Dejaco C, 2022).
–Dersom UL av a. temporalis og axillaris er negative, men man mistenker likevel AT eller non-kranial kjemecellearteritt ( f. eks ved høy CRP og/eller symptomer), kan supplerende utredning med UL av flere arterier, a. temporalis-biopsi eller PET/CT være diagnostisk nyttig (Mukhtyar CB, 2025).
–Bruk av UL av arteria temporalis kan også bedre ved planlagt biopsi. Funn av ødem rundt arterien («halo») og manglende evne til arteriekompresjon med UL-proben vil indikere områder med aktiv inflammasjon (Khurshid MA, 2025).
–Forutgående kortikosteroid-behandling reduserer imidlertid UL-undersøkelsens sensitivitet (Pinnell J, 2023), og haloen forsvinner som regel etter 2-3 ukers steroidbehandling (Gran JT. 2005).
-Transorbital ultralyd kan brukes som del av utredningen ved synstap. Redusert arteriell sirkulasjon i arteria centralis retinae og redusert diameter av n. opticus kan påvises (Petzinna SM, 2024). Vennligst se også eget kapittel om ultralyd-undersøkelser ved vaskulitt.
–Computertomografi (CT) av aorta kan gjøres som del av utredningen for å utelukke tidlige tegn til aneurisme eller disseksjon. En vil da også ha et utgangspunkt for senere kontrollundersøkelser. Ikke sjelden er fortykket karvegg i aorta (ofte ascendens) og tilgrensende kar på CT en inngangsport til storkarsvaskulitt-diagnosen. Veggfortykkelse over 2,2 mm. kan indikere vaskulitt (Berthod PE, 2018).
–For å utelukke aneurismeutvikling i forløpet og etter seponering av behandling er det aktuelt å følge opp CT aorta eller ekkokardiografi og CT abdomen (se oppfølging/monitorering nesten nederst på denne siden).
-Cerebral MR (med kontrast) kan visualisere inflammasjon i a. temporalis, a. occipitalis, a. occipitalis superficialis og a. vertebralis (Dejaco C, 2024).
–3D compressed sensing black-blood MRI (3D-CS-BB-MRI) er en nyere metode som har avdekket at intracerebral vaskulitt ikke er så uvanlig som tidligere antatt. En studie viste en forekomst på ca. 15% og at symptomene hovedsakelig var hodepine (Guggenberg KV, 2025).
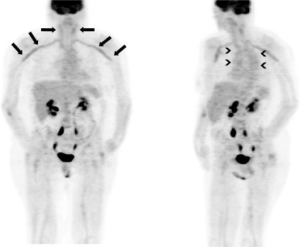
-PET/CT er det neste bildebehandlingsalternativet etter ultralyd av ekstrakraniale blodårer (sensitivitet på 76 % og spesifisitet på 95 % ved klinisk diagnose som referanse) (Dejaco C, 2024). Undersøkelsen kan påvise utbredelse av aktiv vaskulitt i store- og mellomstore arterier. Undersøkelsen bør gjøres før behandling med kortikosteroider er påbegynt eller når prednisolon-dosen er under 10-15 mg/dag. Dersom evaluering av FDG-opptaket utvides fra (vanlig etter 60 minutter) til 90-120 minutter (“delayed imaging”), kan sensitiviteten økes (Aldasoro V , 2025). Med sensitiv teknikk kan også arteria temporalis fremstilles (Nienhuis PH, 2020). Opptak i også a. femoralis er ikke uvanlig, men skyldes ofte samtidig forekomst av aterosklerose og ikke nødvendigvis vaskulitt.
Ved hjelp av PET Vascular Activity Score (PETVAS) i klinisk remisjonsfase kan man estimere subklinisk sykdomsaktivitet (Grayson PC, 2017).
FDG-PET kan også oppdage andre alvorlige sykdommer som infeksjoner eller kreftsvulster, spesielt hos pasienter med atypiske symptomer. Bruk av PET/CT begrenses likevel av tilgjengelighet og kostnader (Dejaco C, 2024).
-PET/MR er ikke i rutinemessig bruk i Norge per 2025, men har potensial til å fremstille storkarsvaskulitt og sykdomsaktiviteten (Pugh D, 2024).
Fluorescin angiografi, indocyanin angiografi, OCTA. De mest aktuelle metodene for å diagnostisere iskemi i øyet utenfor papillo-macula-områdene er intravenøs fluorescein angiografi, indocyanin angiografi eller optical coherence tomography angiography (OCTA) (Kenwothy MK, 2025; Casella AMB, 2022).
Biopsi
Biopsi av arteria temporalis sikrer diagnosen der bildediagnostikk ikke er tilstrekkelig (Dejaco C, 2024). Ideelt bør biopsien ha en lengde på tre centimeter. Dette fordi sykdommen har en segmental og ikke kontinuerlig utbredelse. I praksis er korte biopsier vanlig.
Generelt har bare 5-10% med AT negativ histologi. Ved negativt biopsifunn, men likevel mistanke om AT, kan man be om ytterligere snitt av det allerede biopserte karet. Viser de nye snittene også normale funn, har det vært vanlig å anbefale ny biopsi fra motsatt side. Imidlertid er sjansen for å påvise patologiske forandringer ved ny biopsi etter en forutgående negativ biopsi liten (<10%).
Ved fravær av symptomer, men påvist ekstrakranial manifestasjon er biopsi positiv hos ca. 50% (Amer MA, 2021), noe som viser at subklinisk affeksjon i a. temporalis er hyppig. Biopsi fra andre store/mellomstore arterier kan medføre store blødninger, utenom ved operative prosedyrer på annen indikasjon (aneurisme, disseksjon).
-Kortikosteroider. Allerede igangsatt behandling med kortikosteroider reduserer ikke sjansen for å påvise patologiske forandringer ved behandling over kort tid. Etter under to uker fra behandlingsstart gjenfinnes vaskulitt hos 78%, etter 2-4 uker hos 65% og etter mer enn 4 uker hos 40% (Narvaez J, 2007).
-Histologi. Typiske biopsi-funn ved temporalis-biopsi er en blandet infiltrasjon i karveggen av mange typer inflammatoriske celler, slik som epiteloide celler, lymfocytter, neutrofile, eosinofile og fibroblaster. Ofte er også lamina elastica interna skadet. Kjempeceller ses hos ca. 50% (Stacy RC, 2011). For et sikkert diagnostisk funn ved AT kreves transmural infiltrasjon av betennelsesceller og kjempeceller. Med sannsynlig patologisk funn kreves minimum transmural inflammasjon.
Inflammasjon i a. temporalis er imidlertid ikke helt spesifikk for AT og er også beskrevet ved polyarteritis nodosa (PAN), granulomatose med polyangiitt (GPA, Wegeners granulomatose) (Haugeberg G. 1998) og Kimuras sykdom (Bajocci, 2018).
Ekstrakranial/non-kranial storkarsvaskulitt. Uspesifikke symptomer medfører ofte lang latenstid før diagnosen er sikker. En studie fant at latenstid fra symptomdebut til diagnose var 9 uker for AT mens den var nesten det dobbelte for uspesifisert non-kranial sykdomsmanifestasjon (Prior JA, 2007). Non-kranial storkarsvaskulitt diagnostiseres vanligvis på bakgrunn av systemisk inflammasjon (CRP, SR, nedsatt allmenntilstand) og bildediagnostikk (ultralyd, PET/CT, MR, CT). Biopsi (av av ekstrakraniale arterier) er sjelden aktuelt pga. blødningsrisikoen.
Juvenil arteritis temporalis karakteriseres av fortykket temporalis arterie, men denne har vanligvis et annet histologisk bilde med panarteritt, eosinofile infiltrater og fravær av granulomer og kjempeceller (Lie JT, 1975). (Vennligst se mer om tilstanden under “Spesielle sykdomsgrupper” nedenfor).
Screening for kreft. Generelt anbefales ingen cancerscreening ved AT, da det ikke foreligger noen sikker økt hyppighet av maligne lidelser verken ved AT eller PMR (Myklebust G, 2002). Imidlertid rammer begge tilstander eldre personer der forekomsten av kreft er relativt høy. Det kreves derfor nøye klinisk undersøkelse av disse pasientene. Maligne sykdommer kan dessuten debutere med muskelsymptomer. Risiko ved uspesifisert ekstrakranial storkarsvaskulitt er ikke godt undersøkt.
Diagnose
Mistanke om arteritis temporalis bør bekreftes ved bildediagnostikk (ultralyd, MR av a. temporalis og andre kraniale arterier, CT, PET-CT eller MR av aorta og andre store ekstrakraniale arterier) eller ved biopsi/histologi (Dejaco C, 2024).
Klassifikasjonskriterier for arteritis temporalis er først og fremst konstruert for vitenskapelig bruk. I klinisk praksis er de veiledende, men de egner seg ikke for en tidlig diagnose, da de ikke tar hensyn til at sykdomsbildet utvikles gradvis.
De eldre ACR-kriteriene ikke krever positiv biopsi eller bildediagnostikk. Likevel anbefales nå bildediagnostikk eller biopsi i diagnostisk øyemed.
Utenom ACR/EULAR klassifikasjonskriterier (Ponte C, 2023) kan en modifisert utgave av ACR 1990 kriteriene brukes i klinisk praksis:
Diagnostiske kriterier for AT (modifisert av JTG etter Hunder GG, ACR 1990): tre eller flere av følgende:
- Alder 50år eller eldre
- Nyoppstått hodepine
- Ultralyd viser halo-tegn og kompresjonstesten er positiv eller arteriebiopsi som viser transmural inflammasjon.
- Lokal ømhet eller pulsreduksjon av en av hodets overfladiske arterier
- Forhøyet SR (og/eller CRP)
- Eksklusjon av andre sykdommer
Sensitivitet og spesifisitet er ukjent.
| ACR/EULAR klassifikasjonskriterier (2022): Disse baseres på vekting og av poeng-score og vil kreve alder ≥ 50 år og påvist vaskulitt ved bildediagnostikk i tillegg til kliniske kjennetegn (Ponte C, 2023). | |||
| Kliniske symptomer | pkt | Undersøkelser | pkt |
| Morgenstivhet i skuldre/nakke | +2 | Senkningsreaksjon (SR) ≥ 50 mm./t, CRP ≥ 10 mg/L | 3+ |
| Plutselig synstap | +3 | a. Temporalis-biopsi positiv eller ultralyd med halo | +5 |
| kjeve eller tunge-klaudikasjon | +2 | a. Axillaris: Bilateral affeksjon | +2 |
| Smertefull hodebunn | +2 | FDG-PET med tegn til inflammatorisk aktivitet i hele aorta | +2 |
| Palpasjon av a. temporalis med patologisk funn | +2 | ||
| Klassifikasjon når ≥ 6 punkter foreligger. Sens. 87%, spes. 95% | |||
Spesielle sykdomsgrupper
AT med normal SR/CRP: Dette er en sjelden problemstilling som er rapportert hos mindre enn 4% av tilfellene (Kermani TA, 2012). Diagnosen AT bør da stilles histologisk og etter meget nøye klinisk vurdering. Enkelte har hevdet at behandlingsrespons kan sees ved at SR/CRP avtar innen normalområdet.
AT hos personer under 50 års alder: Både klassisk AT og non-kranial storkarsvaskulitt er ytterst sjeldne i denne aldersgruppen. Andre årsaker til symptomer er ofte mer sannsynlig, slik at spesielt nøye differensialdiagnostisk utredning kreves. Annen systemisk vaskulitt, særlig Takayasus arteritt, Cogans syndrom, ANCA-vaskulitt eller Kimura sykdom er blant differensialdiagnosene (Akalin T, 2014). De fleste vil initialt føle noe lindring av høye doser kortikosteroider selv om AT ikke foreligger. Imidlertid tilkommer vanligvis symptomresidiv tidligere enn forventet under dosenedtrapping.
AT hos personer med asiatisk eller afrikansk genetisk bakgrunn: Tilstandene er mye sjeldnere enn blant kaukasiere. Differensialdiagnostiske overveielser er desto viktigere (Watts RA, 2022).
Juvenil arteritis temporalis
-Definisjon. Juvenil arteritis temporalis er ikke samme sykdom som AT. Tilstanden ble første gang beskrevet i 1975 (Lie JT, 1975). Selv om “juvenil” henspiller på barn og unge, kan alle aldersgrupper angripes. De fleste er likevel unge under 45 års alder. Prevalensen er anslått å være ca. 1 per million (Marques-Soares J, 2024).
-Symptomer og kliniske funn. Typisk symptom er palpabel, knutete, fortykket temporalis arterie i en tinning, sjelden bilateralt. Vanligvis er lesjonen smertefri og allmenntilstanden er ikke påvirket.
-Laboratorieprøver viser normale eller nær normale CRP og SR, men noen tilfeller med eosinofili er beskrevet.
-Biopsi med histopatologisk uttalt inflammasjon med lymfocytter, eosinofile, plasmaceller og endotel-proliferasjon er karakteristisk. Også intima-proliferasjon og skadet media forventes (Marques-Soares J, 2024).
-Differensialdiagnoser omfatter Kimuras sykdom som kan ha et lignende histologisk bilde. Imidlertid angriper Kimuras sykdom oftest etniske asiater og medfører typiske subkutane, store lesjoner (>2 cm) med andre lokalisasjoner, samt hovne spyttkjertler.
-Behandling med prednisolon (initialt 0,5 mg/kg) med rask nedtrapping og seponering over et par måneder er gitt (Pipinos II, 2006). Det er mulig behandlingen medvirker at sykdommen går raskt tilbake. Residiv, synstap, aneurismer eller alvorlige komplikasjoner er uansett ikke å forvente
Litteratur: Marques-Soares J, 2024, Lie JT, 1975; Kolman OK, 2009; Bollinger A, 1986
Differensialdiagnoser
Hodepine av annen årsak: Uspesifikk hodepine kan etterligne AT, men mangler vanligvis systemiske symptomer, høy SR og CRP, og rammer ofte yngre personer.
- Aneurisme i a. temporalis (idiopatisk): En sjelden tilstand som kan gi pulserende smerte i tinningen, men uten ømhet eller fortykkelse av arterien og uten systemiske symptomer.
- Borrelia infeksjon: Kan gi hodepine, feber og tretthet, men nevrologiske symptomer og utslett er vanligere. Borrelia-serologi kan avklare diagnosen. Tempo-mandibulær smerte.
- Cluster-hodepine (Hortons hodepine): Ekstremt intense, ensidige hodepiner med autonome symptomer (rennende øye, tett nese), men har et karakteristisk anfallsvis, episodevis (cluster) mønster og mangler systemiske symptomer.
- Fibromyalgi: Kronisk utbredt smerte med tretthet og søvnproblemer, men uten inflammasjon eller forhøyede inflammasjonsmarkører. Kronisk forløp, oftest kvinner.
- Glaukom: Økt trykk i øyet kan gi hodepine og synsforstyrrelser, men øyesmerter og synsfeltutfall er mer typiske. Uklart syn, farger i synsfeltet.
- Hjerneblødning: Akutt, kraftig hodepine med nevrologiske utfall, ofte ledsaget av kvalme og oppkast. CT/MR av hjernen er diagnostisk.
- Hjernesvulst: Hodepine som gradvis øker i intensitet, ofte med nevrologiske utfall og personlighetsendringer. Andre symptomer: kramper, pareser, redusert sensibilitet, kvalme. MR av hjernen er diagnostisk.
- Hypertoni: Høyt blodtrykk kan gi hodepine, men hypertensiv krise er en akutt, alvorlig tilstand med svært høyt blodtrykk og organskader.
- Juvenil arteritis temporalis er ikke samme sykdom som AT (se under spesielle sykdomsgrupper ovenfor)
- Migrene: Anfallsvis hodepine med kvalme, lysskyhet og aura, men uten systemiske symptomer.
- ANCA-vaskulitt (GPA, MPA, EGPA) og PAN: Systemiske vaskulittsykdommer som kan affisere flere organer, inkludert hjernen og blodkar i hodet. ANCA-assosiert vaskulitt kan gi hodepine og kranialnevropatier, men andre organmanifestasjoner er vanligvis til stede.
- Infeksjoner som tuberkulose og abscesser kan gi hodepine og feber, men fokale nevrologiske utfall og andre infeksjonstegn er vanlige.
- Malignitet: Svulster kan gi hodepine, men andre symptomer avhengig av lokalisasjon er vanligvis til stede.
- Polymyalgia revmatika (PMR): Smerter og stivhet i skuldre og bekken, ofte med feber og tretthet. Opptrer ofte samtidig med AT.
- PRES (Posterior reversibel encefalopati syndrom): Hodepine, synsforstyrrelser, kramper og forvirring forårsaket av hjerneødem. Ofte assosiert med høyt blodtrykk og autoimmune sykdommer, blant annet ved SLE.
- Spenningshodepine: Smertefulle nakkemuskler. Vanlig hodepine med pressende eller strammende smerte, ofte utløst av stress eller muskelspenninger.
- Tempo-mandibulær smerte: Smerter fra kjeveleddet kan stråle til tinningen og etterligne TA, men ledsages av kjeveklikking og ømhet ved palpasjon av kjeveleddet.
- Trigeminusnevralgi: “Strømstøt”, hake eller kinn. Intens, stikkende smerte i ansiktet, utløst av berøring eller bevegelser.
Ekstrakraniale manifestasjoner
Flere av disse tilstandene har også andre ekstra-vaskulære symptomer som kan hjelpe med å skille dem fra AT. For eksempel:
- ANCA-vaskulitt: Lunge-, nyre- og hudaffeksjon.
- Aterosklerose: Hjerte- og karsykdom.
- Autoimmun sykdom av annen årsak: Revmatoid arteritt, hudsykdommer, nyresykdom.
- Behcets sykdom: Munnsår, underlivssår, hudlesjoner, artritt, øyeinflammasjon.
- Cogans syndrom: Øyeinflammasjon og hørselstap.
- IgG4 relatert aortitt: Inflammasjon i aorta og andre store blodkar.
- Infeksjoner: Systemiske symptomer som feber, nattesvette, vekttap.
- HIV, syfilis, tuberkulose, hepatitt
- Polyarteritis nodosa: Affeksjon av mellomstore arterier i forskjellige organer, ofte abdominale smerter (ved iskemi).
- Relapsing polykondritt: Inflammasjon i brusk i ører, nese, luftveier og ledd.
- Revmatoid artritt: Artritt, hudsykdommer, lungesykdom.
- Sarkoidose: Lunge-, hud- og øyeaffeksjon.
- Systemisk lupus (SLE): Artritt, eksem, nyresykdom, hjerte- og lungesykdom.
- VEXAS syndrom: Eldre menn, feber, hudutslett, polykondritt, artritt, lungesykdom.
Skåring av sykdomsaktivitet
Det foreligger ikke gode systemer for å skåre sykdomsaktivitet ved arteritis temporalis eller ekstrakranial storkarsvaskulitt. Ved MR kan en f. eks. se tegn til aktiv vaskulitt til tross for klinisk remisjon hos ca. en tredjedel av pasientene behandlet med tocilizumab (som gir normal CRP) (Reichenbach S, 2018).
Blodprøver som indikerer inflammasjon, spesielt CRP, forventes å være innen referanseområdene når behandlingen er tilstrekkelig (unntatt for tocilizumab). SR er mindre spesifikk og kan være forhøyet av andre årsaker, inklusiv hyper-gammaglobulinemi (høy IgG) ved f. eks MUGS.
EULAR definerer sykdomsaktivitet basert på pågående typiske symptomer (se ovenfor) og minst ett av følgende: sykdomsaktivitet ved bildediagnostikk eller biopsi, iskemiske komplikasjoner eller vedvarende forhøyede inflammasjonsmarkører (Hellmich B, 2020).
Verken BVAS-kriterier utviklet for ANCA-vaskulitt eller NHI/Kerr kriterier (Kerr GS, 1994) som ble utviklet for Takayasus arteritt er dessverre lite anvendelige ved arteritis temporalis (Karmani TA, 2016; Magani L, 2011).
Bildediagnostikk kan brukes i kvantitative analyser for sykdomsaktivitet. For ultralyd foreligger foreløpige OMERACT UL-score (Dejaco C, 2022). PET Vascular Activity Score (PETVAS) kan brukes til å estimere subklinisk sykdomsaktivitet (Grayson PC, 2017).
Naturlig sykdomsforløp
Ubehandlet vil symptomer vedvare og risiko for komplikasjoner øker fortløpende. Ved AT er en spesielt bekymret for blindhet. Både AT og uspesifikk ekstrakranial storkarsvaskulitt kan utvikle aortaaneurismer.
Behandling
Målet med behandlingen er å fjerne symptomer og å hindre sykdomskomplikasjoner, inklusive synstap. Ved sterk mistanke om AT kan en kan starte behandling uten bildediagnostikk eller før svar på biopsi foreligger. Dette for å redusere risiko for irreversibelt synstap. Ellers er behandlingsopplegget likt mellom AT og ekstrakranial sykdom. Behandlingsresponsen på kortikosteroider er god, men det er betydelige individuelle variasjoner vedrørende nødvendige doser og behandlingslengde. Det finnes derfor en rekke ulike doserings-regimer (Dejaco C, 2023). Dersom man forventer et komplisert forløp relatert til kortikosteroider, er tidlig oppstart med tocilizumab eller i noen tilfeller metotreksat aktuelt (Hellmich B, 2020).
Nåværende medikamentell behandling baseres på glukokortikoider. Kombinasjon med tocilizumab, metotreksat eller andre immunsuppresiva er aktuelt i noen tilfeller (Haaversen AB, 2023). Forebyggende tiltak mot komplikasjoner av AT og av behandlingen gis også.
Kortikosteroider. Det er vist at glukokortikoider virker hemmende på proinflammatoriske interleukiner IL-6 og IL-17 som er sentrale mediatorer ved vaskulitt (Hill CL, 2017). Det anbefales å anvende prednisolon fremfor prednison fordi prednison må hydroksyleres i lever til prednisolon som er den aktive substansen. Det er ikke foretatt studier som har evaluert dosering i forhold til pasientens kroppsvekt. Utenom klinisk respons bør CRP i behandlingsforløpet bli nær normal og holdes der. Seponeringsforsøk etter 2 år er aktuelt, tidligere i enkelte tilfeller.
-Ved ukomplisert arteritis temporalis (fravær av synsforstyrrelser, trismus, nevrologiske manifestasjoner eller skalpnekrose) er startdosen oftest 40 mg/dag (for eksempel 30mg morgen + 10 mg ettermiddag). Dose-reduksjon er individuell og persontilpasset og det finnes flere forslag til regimer.
Man kan i utgangspunktet redusere dagsdosen med 5 mg hver- til hver tredje uke til dagsdosen er 15-20 mg innen 1-3 måneder. Man kan deretter redusere dagsdosen med 1,25 mg ukentlig i 4 uker eller med 2,5 mg hver 3. uke til dosen er 10mg/dag. Hvis tilfredsstillende forløp, kan en deretter å forsøke videre reduksjon med 1,25 mg hver tredje uke til dosen er 5mg/dag eller lavere innen ett år fra behandlingsstart (Hellmich B, 2020).
-Behandling av komplisert arteritis temporalis: Startdose med kortikosteroider ved synsforstyrrelser: Kontrollerte studier foreligger ikke, men 60 mg prednisolon daglig anses som en effektiv startdose (Dasgupta B, 2010). Først starter en ofte med 250-1000mg metylprednisolon (SoluMedrol) i.v. daglig i 3 dager. Deretter prednisolon.
Dosen reduseres gradvis over flere uker, tilsvarende som ved ukomplisert sykdom (se ovenfor). Dosereduksjonen må skje under nøye overvåkning av sykdomsutviklingen hos den enkelte.
Vedlikeholdsdose prednisolon 2,5 -10 mg opprettholdes i ofte i minst ett år. Med vedlikeholdsdose forstås den daglige dosen av peroralt kortikosteroid som i rimelig grad kontrollerer sykdomsmanifestasjonene (og CRP) og som ansees a kunne beskytte mot sykdomskomplikasjoner.
Prednisolon behandlingsforslag (Haaversen AB, 2023)
| Uker | Prednisolon dose (mg) | |
| 1 | 60 | Startdose ved oculære/øye manifestasjoner |
| 2 | 50 | |
| 3 + 4 | 40 | Startdose uten oculære/øye manifestasjoner |
| 5 + 6 | 35 | |
| 7 + 8 | 30 | |
| 9 + 10 | 25 | |
| 11 + 12 | 20 | |
| 13 + 14 + 15 | 17.5 | |
| 16 + 17 + 18 | 15 | |
| 19 + 20 + 21 | 12.5 | |
| 22 + 23 + 24 | 10 | |
| 25 + 26 + 27 | 8.75 | |
| 28 + 29 + 30 | 7.5 | |
| 31 + 32 + 33 | 6.25 | |
| 34–52 | 5 |
Supplerende tiltak under behandling med prednisolon
- Acetylsalisylsyre (ASA). Her foreligger usikkerhet for nytte/risiko ratio for å forebygge hjerneslag. EULAR anbefaler ikke rutinemessig bruk av platehemmere eller antikoagulasjon ved storkarsvaskulitt (Hellmich B, 2020), mens andre eksperter gjør det (Gonzales-Gay MA, 2019). Dersom individuell vurdering tilsier risiko for iskemisk cerebrovaskulær eller kardial hendelse, kan tillegg av acetylsalicylsyre 75 mg/d gis forutsatt fravær av kontraindikasjon.
- Syrepumpe-hemmer (for eksempel pantoprazol 20-40 mg) bør vurderes som forebyggende mot ulcus ventriculi. Pasienter med symptomgivende ulcus ventriculi siste seks måneder bør profylaktisk behandles med protonpumpehemmer eller misoprostol. Vær oppmerksom på at syrepumpehemmere kan redusere opptak av kalsium og øke risiko for osteoporose.
- Kalsium og D-vitamin substitusjon. Kvinner bør under kortikosteroid-behandling få tilbud om profylaktisk kalsium og D-vitamin (Calcigran Forte og andre), eventuelt også osteoporosebehandling med bisfosfonater for å motvirke osteoporose.
Supplerende sykdomsdempende medikasjon
Pasienter med behov av høye vedlikeholdsdose som prednisolon > 10 mg daglig bør vurderes for tilleggsbehandling.
Tocilizumab (RoActemra) (IL-6R antagonist) er et bDMARD som kan redusere behovet for kortikosteroider og gi færre sykdomsresidiv (Stone, JH NEJM, 2017). EULAR og Norsk Revmatologisk forening har anbefalt tocilizumab i behandlingsrefraktære tilfeller som et alternativ til metotreksat (Hellmich B, 2020; Haaversen AB, 2023). I Norge er tocilizumab godkjent til behandling av temporalis arteritt hos voksne, men forskrivning er på H-resept (via sykehus eller avtalespesialist). Anbefalt dose er 162 mg/uke s.c. Etter seponering av glukokortikoider, kan tocilizumab brukes alene, men monoterapi skal ikke brukes til behandling av akutt tilbakefall.
En bekymring er at en tredel av pasientene under tocilizumab fortsatt har tegn på vaskulær inflammasjon ved MR angiografi til tross for klinisk remisjon og normal CRP (Reichenbach S, 2018). Også biopsier kan vise vedvarende inflammasjon hos 30% (Riccordi C, 2024), men trolig er andelen lavere enn ved kortikosteroider i monoterapi (Kaymakci MS, 2023). Ulemper er også økt infeksjonsrisiko, supprimert CRP og SR til tross for mulig sykdomsaktivitet, og at medikamentet er kostbart. En Cochrane gjennomgang av tilgjengelige data anbefaler uansett mer forskning for bedre å avklare effekt og mulige bivirkninger over tid (Antonio AA, 2022).
Metotreksat er et alternativ til tocilizumab, selv om studier viser liten eller usikker effekt på gruppenivå (Yates M, 2014). Årsaken til usikker effekt kan være for lave doser (7,5mg/uke) i tidligere studier (van der Veen MJ, 1996). I Norge har en metotreksat-dose på 20mg subkutant/uke ved behov og toleranse vært anbefalt (Haaversen AB, 2023). En må i den aktuelle aldersgruppen da være spesielt oppmerksom på bivirkningsrisikoen.
Andre utprøvende medikamenter
- JAK/STAT hemmere. Upacatidinib 15mg/d i kombinasjon med glukokortikoider er vist å kunne redusere risikoen for sykdomsresidiv etter ett års utprøvende behandling. I tillegg er den kummulative kortikosteroid-dosen lavere. Blant bivirkninger er imidlertid økt risiko for herpes zoster-infeksjon (vurder ev. zoster-vaksine i forkant) (Blockmans D, 2025).
- TNF-alfa-blokkere har i studier av arteritis temporalis til forskjell fra Takayasus arteritt ikke bekreftet behandlingsgevinst (Samson M, 2018).
- IL-1 blokker (anakinra) kombinert med kortikosteroider ser ikke ut til å redusere risikoen for sykdomsresidiv (de Boysson H, 2025).
- PD-1 agonister og MMP-9 blokkerende substanser er under utprøving i studier (Schäfer VS, 2023).
Komplikasjoner under behandling
Aortaaneurisme. Årsaken til aortaaneurisme er sannsynligvis en kombinasjon av svekket aortavegg på grunn av inflammasjon og det høye trykket som befinner seg i arterier. Vennligst se også avsnittet “Symptomer” ovenfor i dette kapitlet.
For ikke å overse aneurismer, kan CT-undersøkelse av aorta gjøres tidlig i sykdomsforløpet og senere med f. eks. 2-3 års mellomrom over 5 – 7 år. Det er rutinemessig ikke behov for kontrastmiddel/angiografi. Aortaaneurisme ved temporalis arteritt medfører 3,4 ganger økt mortalitet (Kermani TA, 2013).
Apopleksi/CNS behandles i samarbeid med nevrologisk avdeling. Cerebrovaskulære katastrofer sees sannsynligvis ikke hos flere enn 3-5 %. Vennligst se under avsnittet “Symptomer” ovenfor.
Artritt: Perifer arteritt kan behandles med intraartikulære injeksjoner med triamcinolon (Lederspan). Ved polyartritt bør utvikling av revmatoid artritt som differensialdiagnose vurderes. Ved behandlingstrengende oligoartritt kan DMARDs i form av metotreksat forsøkes. Se også i avsnittet “Symptomer” ovenfor.
Diabetes mellitus: Pasienter som får kortikosteroider bør sjekkes for utvikling av diabetes innen 1-2 uker (fastende blodsukker, urin stiks, HbA1c).
Divertikulose. Pasienter med symptomgivende divertikulose bør spesielt informeres om faren for gastrointestinale komplikasjoner (perforasjon). Høye doser kortikosteroider kan disponere for perforasjon. Tocilizumab øker også risikoen og kan være kontraindisert.
Infeksjoner. Høy alder og behandling med kortikosteroider antas være årsak til at pasientene har en høyrisiko for infeksjoner. Kortikosteroider antas å være årsak til at infeksjonsrisikoen er 2-3 ganger høyere enn i en referansebefolkning fra samme aldersgruppe (Therkildsen P, 2024).
Kortikosteroider uten effekt: Det er svært sjelden at kortikosteroider ikke har behandlingseffekt. I slike tilfeller bør først diagnosen revurderes. Ved reell manglende respons på prednisolon, kan metylprednisolon gi ønsket effekt. Årsaken kan da være genetisk betinget resistens mot glukokortikoider (Smutny T, 2019). En annen sjelden årsak er redusert gastrointestinale absorpsjon, slik at parenteral administrasjon av tilsvarende doser gir bedre effekt.
Osteoporose: Kortikosteroid-behandling øker risiko for osteoporose, særlig blant kvinner; profylaktisk kalsium og D-vitamin (Calcigran Forte), eventuelt også bisfosfonater og/eller andre tiltak mot osteoporose. Måling av bentetthet/benmasse (DXA-scanning) tidlig i behandlingsforløpet anbefales (Fassio A, 2025).
Persisterende høy SR/CRP til tross for klinisk behandlingseffekt: Det foreligger ingen dokumentasjon på hva en manglende biokjemisk respons på behandlingen skyldes. Tidligere ble det antatt at slike pasienter ofte hadde koeksisterende malign lidelse. Aktiv inflammasjon i store kar er også en mulighet. Indikasjon for videre utredning med PET/CT vurderes i hvert enkelt tilfelle.
Tuberkulose Pasienter med tidligere aktiv tbc. sjekkes med IGRA-test og henvises lungelege dersom positivt funn.
Stenoser eller okklusjon i store arterier forekommer, men er ikke så vanlig som ved Takayasus arteritt. Samtidig bør aterosklerose vurderes.
Synstap kan utvikle seg i sykdomsforløpet: Vennligst se i avsnittet “Symptomer” ovenfor.
Oppfølging
Diagnosen temporalis arteritt og annen vaskulitt i store kar bør vurderes initialt av revmatologisk poliklinikk/avdeling eller hos praktiserende spesialist. Oppfølging etter start av behandling gjøres initialt vanligvis hos spesialist, men et samarbeid med allmennleger er ønskelig (Dejaco C, 2023).
Monitorering gjøres på bakgrunn av symptomer, kliniske funn og CRP (eller SR). Hyppigheten av kontroller baseres på det individuelle forløpet. Norsk Revmatologisk forening har anbefalt månedlige kontroller frem til sykdomsremisjon, deretter etter tre- og seks måneder etterfulgt av årlig oppfølging (Haaversen AB, 2023).
- Månedlige kontroller av CRP til sykdommen er i remisjon med fravær av aktuelle symptomer og normalisering av CRP er aktuelt (Dejaco C, 2023). En kan i tillegg vurdere toleranse for behandlingen, deriblant utelukke steroid-utløst diabetes.
- Kontrollene kan delvis gjøres hos allmennlege/fastlege.
- På lengre sikt er oppfølging for å utelukke aorta-aneurisme (se nedenfor):
Blodsukker bør måles initialt og i begynnelsen av behandlingsforløpet (steroid-utløst diabetes).
Bentetthetsmåling (osteoporose) innen ca. tre måneder er aktuelt.
Månedlige kontroller av CRP til sykdommen er i remisjon med fravær av aktuelle symptomer og normalisering av CRP, samt under reduksjon av prednisolon er aktuelt.
Aortaaneurisme-utvikling kan utelukkes med CT aorta (ikke nødvendigvis med kontrastmiddel) eller ekkokardiografi og CT abdomen som utføres for eksempel hvert annet år i 6-7 år.
Residiv. De vanligste symptomer på tilbakefall er lokalisert hodepine og muskelsmerter (polymyalgia revmatika). I blodprøver vil CRP og senkningsreaksjonen (SR) øke hos ca. 80% ved tilbakefall. Ved et lite alvorlig tilbakefall økes dosen til den som sist fungere bra. Vanligvis kan Prednisolon etter noen uker igjen reduseres gradvis og avsluttes etter 1-3 års behandling. Dersom et tilbakefall omfatter alvorlige komplikasjoner som synstap, velges ofte re-behandling som ved sykdomsdebut.
Bildediagnostikk med ultralyd kan brukes i monitoreringen for å vurdere behandlingseffekt fordi halo-tegn kan korrelere med inflammasjonsparametere (Ponte C, 2021). Man kan også bruke foreløpige OMERACT UL-score (Dejaco C, 2022).
PET/CT er mindre optimal i oppfølgingen. Data viser at >80% har vedvarende patologisk FDG opptak til tross for at de aller fleste er i remisjon (de Boysson H, 2017). Årsaken er trolig at reparasjonsprosesser gir “falsk positive” funn.
Prognose
Tilbakefall/residiv. Forløpet er individuelt. Gjennomsnittlig får omtrent en av tre (34%) tilbakefall av sykdommen i løpet av prednisolon-reduksjonen, de fleste (25%) det første året (Keramni TA, 2015). Dersom PMR og arteritis temporalis eller ekstrakranial storkarsvaskulitt opptrer samtidig, kan sykdommen ha et mer langtrukkent og alvorlig sykdoms forløp enn pasienter med AT alene. Behovet for langvarig behandling øker (Lensen KDF, 2016).
Behandlingsvarighet og seponering: En prospektiv studie viste at de fleste pasientene fikk minst en varig skade av sykdommen, men oftere av behandlingen. Komplikasjoner fra store arterier (29%) og øyne (22%) var vanligst. Bivirkninger av kortikosteroider omfattet katarakt, osteoporose og vektøkning (Karmani TA, 2018). Ved arteritis temporalis også ved ekstrakranial manifestasjon prøves seponering etter langsom medikament-reduksjon, generelt etter ca. 2 år.
Eksaserbasjon etter seponering: Binyrebarken kan bruke opptil 2 år på å opparbeide full funksjon etter langvarig suppresjon gjennom kortikosteroid-behandling. Dette kan være en av grunnene til at pasienter etter seponering klager over symptomer som ikke kan relateres til sykdomsresidiv, men isteden representerer en form for biokjemisk abstinens (sekundært Addisons syndrom). Utredning hos voksne omfatter gradvis reduksjon av dosen til prednisolon 5mg/dag eller lavere. Etter to måneder på lav dose måles serum-kortisol minst 24 timer etter siste prednisolon-inntak. Morgen-kortisol-verdier under referanseområdet tyder på kortisolmangel. Stigende CRP etter seponering tyder imidlertid på eksaserbasjon.
Mortalitet: Det er per i dag usikkert om pasienter med AT har økt mortalitet sammenlignet med normalpopulasjonen. I en studie fra Danmark var mortaliteten lett økt sammenlignet med befolkningen ellers i samme alder (Baslund B, 2014), mens det er ikke funnet noen forskjell i et norsk materiale (Brekke KL, 2019) og en nyere spansk undersøkelse (Molina-Collado J, 2025). Selv om det ikke er statistisk målbart, er det imidlertid klart at enkelte dør av aneurismeblødning (Garen T, 2019).
Retningslinjer / anbefalinger
- ACR/EULAR 2022 klassifikasjonskriterier, Ponte C, 2023
- Dejaco C, 2023. Behandling “treat to target”
- EULAR bildediagnostikk 2023 (Dejaco C, 2023)
- OMERACT sonografi-score (Dejaco C, 2022)
- EULAR 2018 update. Hellmich B, 2019 (Management)
- EULAR 2018: Monti S, 2019
- British Guidelines 2020 Mackie SLE, 2020
- Norsk Revmatologisk Forening/Legeforeningen
Litteratur
Dejaco C, 2024 (bildediagnostikk)
Ponte C, 2023 (klassifikasjonskriterier)
Cid MC, 2020 (Behandling)
Lensen KDF, 2016 (ekstrakranial storkarsvaskulitt)
Skaug HK, 2023 (norske data)
Teksten er basert på aktuell faglitteratur. Den er skrevet og gjennomgått av forfatterne. I bearbeidelsen har vi brukt kunstig intelligens i noen avsnitt.
