BARN MED REVMATISK SYKDOM. BARNEREVMATOLOGI (REV 053-062)
126 Kawasaki sykdom (REV 034)
Ragnar Gunnarsson
Kjennetegn på Kawasakis sykdom
Akutt debut. De fleste er under fem års alder.
Etter noen dager med intermitterende eller konstant feber opptrer konjunktivitt, hovne lepper, munnslimhinner, halslymfeknuter og utslett.
Risiko for koronararterie-affeksjon.
ICD-10: M30.3
Prosedyrekoder: EKG: FPFE15
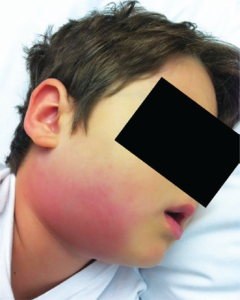
Definisjon
Kawasaki sykdom (KD) som også har vært kalt mucocutaneous lymph node syndrome, forekommer hovedsakelig hos spedbarn og småbarn. KD er den nest hyppigste vaskulitt-sykdommen hos barn (etter Henoch-Schönlein / IgA vaskulitt) hos kaukasiere, men relativt hyppigere hos barn med øst-asiatisk opprinnelse, spesielt fra Japan og Korea. KD er en akutt, monofasisk selvbegrensende vaskulitt av ukjent etiologi. Ved ubehandlet KD utvikler omtrent en av fem affiserte barn koronararterieaneurismer. Nesten all morbiditet og mortalitet relatert til KD forekommer hos pasienter med store koronararterieaneurismer. Året etter COVID-19 pandemien begynte, forårsaket av coronavirus type SARS-CoV2, kom økende rapporter om en tilstand som likner Kawasakis sykdom og makrofag aktiveringssyndrom (MAS)/HLH blant barn med SARS-CoV2 infeksjon (1, 2). Denne betegnes nå som MIS-C (multisystem inflammatory syndrome in children) og kjennetegnes av alvorlig sykdom med feber, sykdomstegn i mange organer og høy inflammasjon / “cytokinstorm” som minner om MAS/HLH. Røde, betente øyne, såre lepper, hovne lymfeknuter på halsen, utslett og magesmerter (Diorio C, 2020)(Hu Y, 2021). Disse nyere erfaringene har på en mange revitalisert hypotesen om at KD er en virusindusert sykdomstilstand til tross man foreløpig ikke har funnet en sikker årsak (1, 3, 4). Illustrasjon: Rossi Fde S, Silva MF, Kozu KT, Camargo LF, Rossi FF, Silva CA, Campos LM – Einstein (São Paulo, Brazil) (2015). CC BY-NC 3.0
Historikk
Sykdomstilstanden er nevnt etter den japanske barnelegen Tomisaku Kawasaki, som i 1967 beskrev sykdomstilstanden i femti barn (5). Dette er ikke den første rapporten om KD, men knapt 9 år tidligere beskrev Munro-Faure nekrotiserende arteritt i koronararterier hos et spedbarn (6). Tidligere har vært en rekke rapporter om spedbarn med det som var referert til infantile polyarteritis nodosa som døde av rupturer av koronarkar. Eldste rapporten om tilstanden som foreløpig er blitt funnet, er fra 1871 fra Storbritannia av dr. Samuel Gee.
Epidemiologi
Det er meget stor variasjon av årlig insidens av KD. Sykdommen opptrer betydelig hyppigere hos personer med øst-asiatisk opprinnelse, spesielt hos de som kommer fra Japan og Korea, men noe færre i Kina, inklusiv Taiwan. I Japan er en særskilt oppmerksomhet om sykdommen og har opprettet et nasjonal KD register. Det anslås at hele 1% av Japanske barn får sykdommen før fem års alder, og der er registret over 250.000 pasienter som har gjennomgått KD de siste 50 årene. I Japan er årlig insidens hos barn yngre en 5 år på 215 per 100.000. Kina inklusiv Taiwan kommer nærmest Japan i henhold til insidens, men de finner færre en 1/3 – 1/4 del av insidensen i Japan på mellom 41-69 per 100.000 per år. Det er vanskelig å sammenligne tall fra Japan med andre land der de virker å ha særskilt fokus på KD men epidemiologiske tall fra England, Israel og USA viser henholdsvis 8, 7, og 12 årlige tilfeller per 100.000 barn yngre en fem år. KD opptrer hyppigere hos gutter (1,4 – 1,6 ganger oftere en jenter) og forekomsten er høyest i alderen 6 – 12 måneder. Sykdommen er sjelden før ½ års alder og opp mot 90% er under 5 år gamle. Det er referert enkelte voksne pasienter som fyller kriteria for KD men det er svært sjelden og da mange som ikke fyller 2004 KD kriteria som er utviklet for barn (11). I Japan har man observert tre særskilte epidemiske episoder på KD i 1979, 1982 og 1986 og har observert at sykdommen opptrer noe hyppigere om vinteren. Det omtrent 10-30 dobbelt økt risiko for å få KD hvis søsken har fått sykdommen og dobbelt risiko hvis ene av foreldrene har blitt affisert.
Patogenese og patologi
En mistenker at KD er i hovedsakelig en infeksjonsutløst tilstand. Selvbegrenset sykdomstilstand med høy feber, utslett, lymfadenopati og hevelse i slimhinner (mukositt) er symptomer ofte assosiert til infeksjon. Både er det sykdomsmanifestasjonen i tillegg til forløpet og behandlingen som skiller seg fra andre vaskulittsykdommer. Relatert til coronavirus sykdom 2019 (COVID-19) har dette fått økt oppmerksomhet pga. betydelig økt sykdomsbilde hos barn smittet av coronavirus (SARS-CoV2) med multisystem inflammatorisk syndrom som har flere likhetstrekk med KD og er tidligere kalt «paediatric inflammatory multisystem syndrome temporally associated with SARS- CoV-2» (PIMS- TS) (12, 13), nå MIS-C (multisystem inflammatory syndrome in children). Som anført er det over 10 dobbelt økt risiko hos pasienter av japansk herkomst å få KD i henhold til kaukasiere. Flere gener er blitt identifisert gjennom giga-genstudier («genome-wide») både med assosiasjon (GWAS) og kobling (GWLS). Genene som er assosiert til KD kan klassifiseres i fire hovedgrupper. Gener som har med T-celle-aktivering (ITPKC, ORAI1, STIM1), gener assosiert til dysregulert B-cellesignalering (CD40, BLK, FCGR2A), gener assosiert til redusert apoptose (CASP3), og gener som er assosiert til endret transformasjonsvekstfaktor beta-signalering (TGFB2, TGFBR2, MMP, SMAD)(14, 15). Immunresponsen assosiert med Kawasaki sykdom er kompleks og involverer aktivering og infiltrasjon av koronararterieveggen av både medfødte og adaptive immunceller. Forskning har avdekket tilstedeværelse av IgA-plasmaceller og en oligoklonal IgA-respons i arterievev fra pasienter med KD som kan antyde at dette er immunrespons blir drevet av inntreden av et patogen fra slimhinne og sannsynligvis fra luftveiene, men kan også være fra tarm via «tarm-vaskulær» aksen (4, 15). Histologi av koronarkar hos barn som døde av sykdommen viser fibrinoid nekrose med ødeleggelse av lamina elastica og aneurismedannelse i karet. Den tidlige uttalte infiltrasjonen av neutrofile i karvegg av koronararteriene, som oppstår i de første 1-2 ukene av sykdom er bli fulgt av forskyvning av nøytrofile med mononuklære celler, med avtakende inflammasjon innen 2 måneder etter sykdomsdebut. Det ses aktivitetstegn fra endotelceller. «Neutrophil extracellular traps» (NETs) er nettverk av ekstracellulære fibre, som er sammensatte av DNA-fibre, histoner og nøytrofile granula proteiner som neutrofil elastase og myeloperoksidase der hovedoppgaven er å fange patogen. Serum fra KD pasienter ser ut til å stimulere NET-dannelse i menneskelige nøytrofile in vitro. NET-dannelse krever konvertering av histon arginin til citrullin med PAD4 og musemodell har viste betydelig PAD4-ekspressjon hos mus med KD-liknende vaskulitt, men ikke i kontrollmus. Dette kan tolkes med at nøytrofile, som har infiltrert kar i KD-lignende mus, er direkte involverte i patogenesen med økt produksjon av NETs (15, 16).
Symptomer
Sykdomsutvikling ved KD deles ofte ned tre sykdomsfaser. Det er akutt febril fase, subakutt og rekonvalesensfase.
Akutt febril fase varer oftest opp mot 2 uker med høy og oftest vedvarende feber som ofte over 40°C og responderer dårlig på febernedsettende. Da utvikles andre symptomer som forkjølelse, oftest bilateral konjunktivitt uten pussdannelse, mukositt ofte med tørrhetsforandringer i lepper og jordbæraktig tunge. Hudutslett med eksantem med rubor som starter på truncus etter hvert bleieområde i perineum med etter hvert hudavskalling («desquamation») der. Det utvikles lymfadenopati som oftest begynner med forstørrelse av lymfeknuter på hals. Lymfadenopatien avtar spontant etter noen få dager. Leddsmerter eller artritt og tar dager.
Neste fase er subakutt fase som rekker frem i uke 3-4 der symptomer avtar og uten behandling vil tilstanden roe seg. Barnet blir afebril og bedring i mukositt og konjunktivitt men oftest økende hudavskalling bla. fra finger, hender og føtter og i denne fasen av sykdommen er oftest første tegn på aneurisme dannelse på koronararterier som forekommer hos rundt 25%. Koronararterieaneurismer utvikles dynamisk over tid og er vanligvis fult utviklet ca. 6 uker etter sykdomsdebut og viktig med ny screening med ekkokardiografi etter 6-8 uker. Risikoen for hjerteinfarkt fra blodpropp i hjertearterien er størst de første 2 årene etter sykdomsdebut, mens stenose og okklusjon utvikler seg imidlertid over flere år (17-19). Hvis intravenøst immunglobulin administreres innen 10 dager etter begynnelsen av feber, reduseres risikoen ca. femdobbelt fra ca. 25% til mindre en 5%.
Myokarditt og CNS. Det er rundt 1/3 del av pasienten som har grad av myokarditt, men som oftest er det lavgradig. Det er rapporter om sentralnervøse manifestasjoner i form av aseptisk meningitt, kranial nevropati.
Leddsmerter, artralgi er relativ vanlig, men det er beskrevet artritt i færre en hos 10% tilfelle og der det vanligvis er enten oligoartikulær eller polyartikulær leddaffeksjon av vanligvis; ankler, kne, hofte, handledd og albue. Artritten avtar innen få uker og som regel uten permanent leddskade.
Forkjølelsessymptomer med symptomer fra øvre luftveier er vanlig tidlig i fasen.
Tarm. Symptomer fra tarm forekommer hos omtrent ¼ av pasientene oftest da med vanntynn diare og sterke smerter og utspilt abdomen. Og fortykkelse i tarmvegg og også galleblærevegg og i sjeldne tilfeller kan invaginasjon forekomme.
Nyrer. Det er beskrevet nyreaffeksjon med nefritt men det er sjelden og det er også sjeldent med nyresvikt og går da mistanken ofte mer mot behandlingen en sykdommen. Svært høye doser av NSAID og eller intravenøs immunglobulin (IVIg) kan gi nyrekomplikasjoner (20). Det er sjeldne rapportert om orkitt
Tredje og siste fasen er rekonvalesensfase der symptomene gradvis forsvinner og langtidskomplikasjonen hos del av pasientene er som følge av skader på koronararterier under sykdomsforløpet.
Undersøkelser
Anamnese. En grundig anamnese og kartlegging av feber samt en grundig klinisk undersøkelse. Infeksjonsutløst tilstand er hoveddifferensiell diagnose se her over.
– SARS-CoV2. Per dags dato er viktig å utelukke coronavirus SARS-CoV2, med PCR utstryk fra øvre luftveier og SARS-CoV2 antistoffer. I tillegg viktig med undersøkelser for å utelukke ovenstående differensial diagnoser med andre virus PCR fra øvre luftveier inklusiv adenovirus og eventuelt meslinger, samt antistoffanalyser og PCR for bla. EBV og Parvovirus B19.
Blodprøver. Inflammatoriske parameterne senkning (SR) og C-reaktivt protein (CPR).
-Anti-nukleær antistoffer (ANA IIF/EliA), komplement faktorer C3 og C4 samt anti-neutrofil cytoplasma antistoffer (ANCA). I tillegg hematologiske parametere med maskinell differensial telling og ha lav terskel for å undersøke blodutstryk. Lever- og nyrefunksjonsparametere og elektrolytter. I tillegg ta albumin, ferritin, triglyserid og fibrinogen med tanke på hemofagocytisk lymfohistiocytose (HLH) som også kalles makrofag aktivering syndrom (MAS) når dette rammer pasienter med juvenil idiopatisk artritt (JIA).
-Urin stiks, mikroskopi og dyrkning.
Halsutstryk for gruppe A beta-hemolytiske streptokokker samt antistreptolysin O (ASO) og/eller antideoxyribonuclease B (ADB). Blodkulturer er oftest indisert som del i differensial diagnosen sepsis/endokarditt.
Gjentatt elektrokardiografi (EKG) og ekkokardiografi (EKKO cor) bør utføres hvis mistanke om KD og gjentas etter 6-8 uker og evt. ytterligere undersøkelser med koronarangiografi evt. CT koronarangiografi og MRI av hjerte kan vurderes.
Koronaraffeksjon medfører til aneurisme-dilatasjon og basert på ekkokardiografi. Dette er oftest presentert som Z-poengsum, som antall standardavvik under eller over indre lumendiameter normalisert for kroppsoverflate. Hvis det foreligger koronaraffeksjon forverres den vanligvis i løpet av de første fire til seks ukene fra sykdomsdebut. Aneurisme utvidelse er usannsynlig når det foreligger normal lumen diameter (Z-score <2). Dette økes med økt Z-score og diameter av utvidelse. Store koronararterieaneurismer (definert som Z-score> 10 eller diameter ≥8 mm) er assosiert med den høyeste risikoen for sykelighet og dødelighet (21).
Diagnosen
Diagnose av klassisk eller komplett KD eller ukomplett KD baserer seg på mønstergjenkjenning. Konferert med aktuelle blodprøver og i visse tilfeller med karforandringer.
Kriterier for klassifikasjon og mål på sykdomsaktivitet
Det ble i 2004 lansert diagnostiske kriteria for KD som baserer seg på at det er minst fem døgn med feber og minst fire av fem følgende kriterier (7, 8).
Det forutsetter at flere mulige differensialdiagnoser er ekskluderte (-> Tabell 2) (9, 10).
Tabell 1 Diagnostiske kriterium for Kawasaki sykdom.
Feber i fem døgn og tilstedeværelse av minst fire av fem følgende:
- Endringer i ekstremiteter:
akutt fase: erythem av håndflater og såler, og ødem av hender og føtter
subakutt fase: hudavskalling på fingre og tær.
- Polymorf eksantem.
- Bilateral konjunktivinjeksjon.
- Endringer i lepper og munnslimhinne: erythematøse og sprukne lepper, «jordbær tunge», og oral og faryngal hyperemi.
- Cervikal lymfadenopati (> 1,5 cm i diameter)
Inkomplett KD når det 2-3 kliniske kriteria uten forklaring (tabell 2).
Differensialdiagnoser ved Kawasaki sykdom
Tabel 2: Differensial diagnoser ved Kawasaki sykdom.
- Adenovirus, parvovirus B19 eller herpesvirusinfeksjoner (HHV) inkl. Herpes simpleks, HHV-6 og -7 samt og cytomegalovirus
- Meslinger
- Mononukleose (Epstein-Barr virus infeksjon (EBV))
- Coronavirus SARS CoV2 infeksjon COVID-19 er assosiert til «paediatric inflammatory multisystem syndrome temporally associated with” SARS- CoV-2» (PIMS- TS) / MIS-C (multisystem inflammatory syndrome in children)
- Streptokokker. Reaksjon på streptokokker ev. stafylokokker
- Polyarteritis nodosa (PAN)/DADA2
- Revmatisk feber
- Rickettsiose som forårsakes av en rekke (over 20) underarter av Rickettsia bakterien, som forårsaker flekkfeber «spotted fever group» (SFG)) (Her er reiseanamnese er viktig der dette er importsykdommer i Norge)
- Skarlagensfeber
- Steven Johnson syndrome
- Systemisk form av juvenil idiopatisk artritt (sJIA) – Stills sykdom.
- Systemisk lupus erythematosus blant barn (JSLE)
- Toxic shock syndrome
Behandling
Intravenøst immunglobulin (IVIg): Hos pasienter med sikker KD eller stor sannsynlighet for KD er indikasjon for IVIg. Behandlingen er en kur med IVIg 2 g/kg administrert i løpet av 8 til 12 timer. IVIg er mest effektiv hvis administreres i løpet av de første 10 dagene fra sykdomsstart som er før aneurismer i koronarkar vanligvis utvikles. IVIg administreres selv utover 10-dagers vinduet hos pasienter med bevis på vedvarende vaskulitt eller systemisk betennelse.
Kobayashi score brukes til prognostisk vurdering i Japan og indikerer manglende effekt på intravenøst gammaglobulin (IVIg) og de som vil ha tilleggseffekt på ytterligere behandling. Kabayasy score er lite kartlagt hos kaukasiere. Scoret baseres på rekke parametere inkludert; hyponatriemi ≤133 mmol/L [2 poeng], forhøyet ASAT≥100 U/L [2 poeng], CRP≥100mg/L [1 poeng], neutrofili≥80% [2 poeng], trombocytter ≤300.000 m3 [1 poeng], alder ≤12 måneder [1 poeng] og tidlig diagnose med klart sykdomsbilde [2 poeng] (22). De som har 0-1 poeng har under 3% sjanse ikke å respondere på IVIg ,mens de som har 6 poeng har nesten 50% sjanse ikke å responder og de som er 10 poeng respondere nesten aldri på IVIg alene.
Aspirin (NSAID): Det foreslås administrering av Aspirin i den akutte sykdomsfasen til tross det er dårligere dokumentert en IVIg. Det er et bredt spekter av aspirindoser (30 – 50 mg/kg/dag), vanligvis i fire delte doser (maksimal dose 4 g per dag).
Glukokortikoid (GC) behandling: har vist seg å redusere frekvensen av koronarkomplikasjoner hos japanske KD pasienter med høyt (≥5) Kobayashi score for IVIG-resistens (22). Det foreslås at GC tilsettes hos kaukasiske barn som oppfyller ett eller flere av høyrisikokriteriene for IVIG-resistens som alder <6 måneder eller Z-score for koronardilatasjon på ≥ 3,0 (21). Som oftest gis intravenøst metylprednisolon 2 mg/kg/d over 5 dager. Deretter byttet til per oral dosering med 2 mg/kg/dag i fem dager, deretter 1 mg/kg/dag i fem dager, og til slutt 0,5 mg/kg/dag i fem dager eller inntil afebril og normalisering av CRP. Hvis pasienten ikke blir feberfri kan høydose intravenøs metylprednisolon 30 mg/kg daglig opp mot 3 dager vurderes.
Ciklosporin behandling: En nylig publisert japansk multisenter randomisert undersøkelse som inkluderte 175 barn med KD og Kobayashi-score ≥5. Der ble sammenlignet behandlingsgruppe som fikk p.o. ciclosporin 5 mg/kg/d i fem dager med placebo fant statistisk signifikant forskjell uten økt bivirkningsprofil på koronararterie affeksjon. Forekomsten av koronararterieaffeksjon halvert i behandlingsgruppen 14% (12/86) sammenlignet med 31% (27/87) som fikk placebo (23).
Prognose
KD er en akutt, monofasisk selvbegrensende sykdom med relativ kort sykdomsforløp. Det rapportert at 2 prosent av tilbakefall av KD i Japan og oftest innen 12 måneder fra sykdomsdebut.
Den rapporterte dødeligheten av KD har vært lav (0,1 til 0,3%) siden tidlig IVIg-terapi har blitt innført. I akutt fasen er uttalt myokarditt, arytmier og aneurisme rupturer og hjerteinfarkt er den hyppigste dødsårsaken.
Pasienter uten koronaraffeksjon har en utmerket prognose. Pasienter med koronar sekvele trenger oppfølging og får ofte antikoagulasjon og blodplatehemming.
Litteratur
Diagnose (AHA scientific statement, 2001)
Referanser
- Koné-Paut I, Cimaz R. Is it Kawasaki shock syndrome, Kawasaki-like disease or pediatric inflammatory multisystem disease? The importance of semantic in the era of COVID-19 pandemic. RMD open. 2020 Jun;6(2). PubMed PMID: 32611651.
- Toubiana J, Poirault C, Corsia A, Bajolle F, Fourgeaud J, Angoulvant F, et al. Kawasaki-like multisystem inflammatory syndrome in children during the covid-19 pandemic in Paris, France: prospective observational study. BMJ. 2020 Jun 3;369:m2094. PubMed PMID: 32493739. PMCID: PMC7500538.
- Sperotto F, Friedman KG, Son MBF, VanderPluym CJ, Newburger JW, Dionne A. Cardiac manifestations in SARS-CoV-2-associated multisystem inflammatory syndrome in children: a comprehensive review and proposed clinical approach. European journal of pediatrics. 2020 Aug 15:1-16. PubMed PMID: 32803422. PMCID: PMC7429125.
- Shulman ST, Rowley AH. Kawasaki disease: insights into pathogenesis and approaches to treatment. Nature reviews Rheumatology. 2015 Aug;11(8):475-82. PubMed PMID: 25907703.
- Kawasaki T. [Acute febrile mucocutaneous syndrome with lymphoid involvement with specific desquamation of the fingers and toes in children]. Arerugi. 1967 Mar;16(3):178-222. PubMed PMID: 6062087.
- Munro-Faure H. Necrotizing arteritis of the coronary vessels in infancy; case report and review of the literature. Pediatrics. 1959 May;23(5):914-26. PubMed PMID: 13645127.
- Newburger JW, Takahashi M, Gerber MA, Gewitz MH, Tani LY, Burns JC, et al. Diagnosis, Treatment, and Long-Term Management of Kawasaki Disease: A Statement for Health Professionals From the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. 2004;114(6):1708-33.
- Marrani E, Burns JC, Cimaz R. How Should We Classify Kawasaki Disease? Frontiers in immunology. 2018;9:2974. PubMed PMID: 30619331. PMCID: PMC6302019.
- Newburger JW, Takahashi M, Gerber MA, Gewitz MH, Tani LY, Burns JC, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. Circulation. 2004 Oct 26;110(17):2747-71. PubMed PMID: 15505111.
- Sánchez-Manubens J, Bou R, Anton J. Diagnosis and classification of Kawasaki disease. J Autoimmun. 2014 Feb-Mar;48-49:113-7. PubMed PMID: 24485156.
- Gomard-Mennesson E, Landron C, Dauphin C, Epaulard O, Petit C, Green L, et al. Kawasaki disease in adults: report of 10 cases. Medicine (Baltimore). 2010 May;89(3):149-58. PubMed PMID: 20453601.
- Riphagen S, Gomez X, Gonzalez-Martinez C, Wilkinson N, Theocharis P. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet. 2020 May 23;395(10237):1607-8. PubMed PMID: 32386565. PMCID: PMC7204765.
- Pouletty M, Borocco C, Ouldali N, Caseris M, Basmaci R, Lachaume N, et al. Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 mimicking Kawasaki disease (Kawa-COVID-19): a multicentre cohort. Ann Rheum Dis. 2020 Aug;79(8):999-1006. PubMed PMID: 32527868. PMCID: PMC7299653.
- Kumrah R, Vignesh P, Rawat A, Singh S. Immunogenetics of Kawasaki disease. Clinical reviews in allergy & immunology. 2020 Aug;59(1):122-39. PubMed PMID: 32200494.
- Noval Rivas M, Arditi M. Kawasaki disease: pathophysiology and insights from mouse models. Nature reviews Rheumatology. 2020 Jul;16(7):391-405. PubMed PMID: 32457494. PMCID: PMC7250272.
- Yamashita K, Takaori-Kondo A, Mizugishi K. Exaggerated neutrophil extracellular trap formation in Kawasaki disease: a key phenomenon behind the outbreak in western countries? Ann Rheum Dis. 2020 Aug 21:annrheumdis-2020-218593. PubMed PMID: 32826275.
- Newburger JW, Takahashi M, Burns JC. Kawasaki Disease. J Am Coll Cardiol. 2016 2016/04/12/;67(14):1738-49.
- Mori M, Hara T, Kikuchi M, Shimizu H, Miyamoto T, Iwashima S, et al. Infliximab versus intravenous immunoglobulin for refractory Kawasaki disease: a phase 3, randomized, open-label, active-controlled, parallel-group, multicenter trial. Scientific reports. 2018 Jan 31;8(1):1994. PubMed PMID: 29386515. PMCID: PMC5792468
- Kuo HC, Guo MM, Lo MH, Hsieh KS, Huang YH. Effectiveness of intravenous immunoglobulin alone and intravenous immunoglobulin combined with high-dose aspirin in the acute stage of Kawasaki disease: study protocol for a randomized controlled trial. BMC pediatrics. 2018 Jun 22;18(1):200. PubMed PMID: 29933749. PMCID: PMC6015467.
- Abbas A, Rajabally YA. Complications of Immunoglobulin Therapy and Implications for Treatment of Inflammatory Neuropathy: A Review. Curr Drug Saf. 2019;14(1):3-13. PubMed PMID: 30332974.
- McCrindle BW, Rowley AH, Newburger JW, Burns JC, Bolger AF, Gewitz M, et al. Diagnosis, Treatment, and Long-Term Management of Kawasaki Disease: A Scientific Statement for Health Professionals From the American Heart Association. Circulation. 2017 Apr 25;135(17):e927-e99. PubMed PMID: 28356445.
- Kobayashi T, Inoue Y, Takeuchi K, Okada Y, Tamura K, Tomomasa T, et al. Prediction of intravenous immunoglobulin unresponsiveness in patients with Kawasaki disease. Circulation. 2006 Jun 6;113(22):2606-12. PubMed PMID: 16735679.
- Hamada H, Suzuki H, Onouchi Y, Ebata R, Terai M, Fuse S, et al. Efficacy of primary treatment with immunoglobulin plus ciclosporin for prevention of coronary artery abnormalities in patients with Kawasaki disease predicted to be at increased risk of non-response to intravenous immunoglobulin (KAICA): a randomised controlled, open-label, blinded-endpoints, phase 3 trial. Lancet. 2019 Mar 16;393(10176):1128-37. PubMed PMID: 30853151.
