BARN MED REVMATISK SYKDOM. BARNEREVMATOLOGI (REV 053-062)
127 Lysosomale lagringssykdommer -En revmatologisk oversikt. Fabry, Gaucher, Krabbe, Niemann-Pick, Sandohoff, Tay-Sachs, Pompe, Mukopolysakkaridose, Mukolipidose (REV 056)
Øyvind Palm
ICD-10: E75
Definisjon
Lysosomale lagringssykdommer (LSD) er en gruppe sjeldne, genetiske sykdommer som skyldes defekter i lysosomenes funksjon. Lysosomer er cellens “resirkuleringsstasjon” som bryter ned avfallsprodukter ved hjelp av enzymer. Ved LSD mangler eller fungerer ikke disse enzymene som de skal, noe som fører til opphopning av ubrutte stoffer i cellene.
Lysosomale lagringssykdommer omfatter omtrent 50 diagnoser, hvorav de fleste er svært sjeldne. De kan inndeles på ulike måter, men en vanlig inndeling er basert på typen stoff som akkumuleres i cellene:
Blant de mest kjente er:
- Mukopolysakkaridoser
- Mukolipidoser
- Oligosakkaridoser
- Pompe sykdom
- Gaucher sykdom
- Fabry sykdom
- Niemann-Pick sykdommer
- Neuronal ceroid lipofuscinoser (Sun A, 2018).
Disse sykdommene påvirker ofte fysisk funksjon, vekst og allmenntilstand fra barnealder. Selv om de ikke er preget av systemisk inflammasjon, kan revmatologer støte på symptomene. Det er derfor viktig å kunne skille disse differensialdiagnostisk fra artritt, systemiske bindevevssykdommer, vaskulitt og andre primære revmatiske tilstander.
Tidligere ble LSD klassifisert og diagnostisert basert på kliniske manifestasjoner. Med nyere teknikker kan sykdommene og deres undergrupper påvises og klassifiseres mer nøyaktig ved hjelp av genanalyser og biomarkører. Til dels gjøres dette også i screening av nyfødte (Parenti G, 2021). De mest alvorlige tilfellene oppdages ved prematur fosterdød eller neonatalt, mens andre påvirker helsen i mindre grad og oppdages i senere barnealder. Symptomer fra ledd og muskulatur er også vanlige i sykdomsforløpet. Ubehandlet medfører sykdommene likevel progressiv skade på lever, milt og hjerte, i noen tilfeller også hjernen.
Lysosomale lagringssykdommer kan inndeles basert på substratet som primært akkumuleres i lysosomene:
- Cystinoser
- Gangliosidoser
- Glykoprotein/glykogenlagringssykdommer
- Leukodystrofier
- Mukopolysakkaridoser
- Mukolipidoser
- Sfingolipidoser (Martina JA, 2020).
Relevans for revmatologi
Enkelte av lagringssykdommene, som glykogen- og lipidlagringssykdommer, medfører uttalt myopati og er også omtalt i kapitlet om non-inflammatoriske muskel-sykdommer. Fabrys sykdom, en sfingolipidose, har også et eget kapittel.
Ervervet lysosomal lagringssykdom med (kardio)myopati kan i sjeldne tilfeller ses ved bruk av hydroksyklorokin (Plaquenil) (Muthukrishnan P, 2011).
Historikk
De første tilfellene av lysosomale lagringssykdommer ble beskrevet på 1800-tallet basert på klinisk observasjon. Cellenes lysosomer ble påvist i 1955/56. De biokjemiske defektene som ligger bak sykdommene ble kartlagt fra 1963 og fremover. Pompes sykdom var den første av sykdommene som ble identifisert som en lysosomal lagringssykdom (Hers HG, 1963). De første forsøkene på å behandle ved å supplere med manglende enzymer begynte i 1990-årene. Senere forskning fokuserer på lysosomenes oppgaver i cellemetabolismen med tanke på å utvikle nye behandlingsmetoder (Parenti G, 2021).
Patogenese
LSD er en gruppe arvelige sykdommer forårsaket av genfeil som påvirker lysosomenes funksjon. Lysosomer er cellulære organeller ansvarlige for nedbrytning og resirkulering av ulike biomolekyler, som proteiner, nukleinsyrer, karbohydrater og lipider. Ved lysosomale lagringssykdommer fungerer ikke disse nedbrytningsprosessene som de skal, noe som fører til opphopning av ufordøyede makromolekyler i cellene. Denne opphopningen kan gradvis svekke organfunksjonen (Parenti G, 2021; Scerra G, 2022).
Epidemiologi
Lysosomale lagringssykdommer er sjeldne, og anslås å angripe omtrent 1 av 7-8000 nyfødte globalt. Noen diagnoser er mer utbredt i spesifikke etniske grupper eller geografiske områder (Mistry PK, 2022).
Symptomer
Symptomer på lagringssykdommer varierer avhengig av hvilket substrat som lagres og hvilke organer som affiseres. Sykdommene kan debutere prenatalt, neonatalt, i barnealder eller, sjeldnere, hos voksne. Tidlig debut indikerer ofte et mer alvorlig forløp, med hyppigere affeksjon av nervesystemet hos de yngste pasientene.
Symptomene kan ligne på andre kronisk progredierende tilstander, med appetittmangel, forsinket fysisk og/eller mental funksjon og vekstforstyrrelser (muskel-skjelett) med kyfose og kontrakturer i ledd. Organmanifestasjoner kan omfatte dyspné (tung pust) ved belastning, hepatosplenomegali (forstørret lever og milt), hjertesvikt, ørebetennelse (otitis media) og nedsatt hørsel og syn (uklar kornea). Nyresvikt og kramper (epilepsi-lignende) kan forekomme sent i forløpet (Kiely BT, 2017)..
Undersøkelser
Prenatal screening er mulig for flere av sykdommene. Senere kan serum- og urintester for lysosomale lagringssykdommer utføres.
Anamnesen omfatter typiske symptomer (se ovenfor), tidligere spontanaborter og arvelige disposisjoner. Tilfeller i nærmeste familie er sjelden, selv om det foreligger genetisk disposisjon.
Klinisk undersøkelse: Vurdering av tegn til avvik fra normal utvikling og sykdomstrekk, samt funn fra øyne, hørselsorgan, ansikt, hud, ledd, skjelett, rygg, hjerte, lunger og abdomen (lever og milt).
Laboratorieprøver: CRP, SR, Hb, leukocytter med differensialtellinger, trombocytter, elektrolytter, lever-, nyre-, og thyreoidea-funksjonsprøver, glukose, kreatin kinase CK. Differensialdiagnostisk kan ANA være aktuelt. Urin-stiks. Spesialdiagnostikk ved gen-panel (genetikkportalen.no).
Bildediagnostikk som ultralyd abdomen (lever, milt, nyrer), røntgen- og MR-undersøkelser ved symptomer.
Diagnose
Ved mistanke om lagringssykdom eller arvelig disposisjon, gjøres blodprøver som undersøkes for enzymdefekt (genpanel).
Differensialdiagnoser til lysosomale lagringssykdommer:
Andre metabolske sykdommer:
- Mitokondrielle sykdommer og myopatier og metabolske myopatier. Disse sykdommene påvirker cellenes energiproduksjon og kan forårsake symptomer som muskelsvakhet, tretthet og utviklingsforsinkelser.
- Peroksisomale sykdommer: Dette er en gruppe sykdommer som påvirker peroksisomene, som er organeller i cellene som er involvert i nedbrytningen av visse stoffer. Eksempler inkluderer Zellweger syndrom og adrenoleukodystrofi.
- Cerebral parese: Dette er en gruppe lidelser som påvirker bevegelse og muskelkontroll.
- Epilepsi: Anfall kan være et symptom på noen LSD.
- Muskeldystrofier
- Multippel sklerose: Dette er en autoimmun sykdom som påvirker sentralnervesystemet.
- Andre nevrodegenerative sykdommer: Det finnes en rekke andre nevrologiske sykdommer som kan ligne på LSD, for eksempel Huntingtons sykdom.
Revmatologiske sykdommer:
- Juvenil idiopatisk artritt (JIA): Dette er en form for leddgikt som rammer barn.
- Juvenil Systemisk lupus erythematosus (jSLE): Dette er en autoimmun sykdom som kan påvirke mange forskjellige deler av kroppen, inkludert leddene, huden og nyrene.
- Andre autoimmune sykdommer: Det finnes en rekke andre autoimmune sykdommer som kan ligne på LSD.
Infeksjonssykdommer: Noen infeksjoner kan forårsake symptomer som ligner på LSD, for eksempel HIV og tuberkulose.
Andre tilstander:
- Utviklingsforsinkelser: Det er mange forskjellige årsaker til utviklingsforsinkelser, og noen av disse kan ligne på LSD.
- Muskelsykdommer: Det finnes en rekke non-inflammatoriske og myositt-muskelsykdommer som kan forårsake muskelsvakhet og andre symptomer som ligner på LSD.
- Skjelettlidelser: Noen skjelettlidelser kan forårsake symptomer som ligner på LSD, for eksempel rakitt og osteogenesis imperfecta.
- Idiopatiske myopatier (uten kjent årsak)
Behandling
Behandlingsmulighetene varierer for de ulike lagringssykdommene (Rajkumar V, 2023).
Enzymerstatningsterapi (ERT).
- Den mest brukte behandlingen, men ikke tilgjengelig for alle typer.
- Kan brukes ved Gaucher, Fabry, Pompe og Wolman sykdom, α-mannosidose, NCL type 2 og mukopolysakkaridose type I, II, IV, VI og VII.
- ERT er ikke helbredende, men kan bremse sykdomsprogresjonen.
Benmargstransplantasjon. I noen tilfeller brukes stamcelletransplantasjon (celler fra benmarg eller navlestrengsblod), særlig ved forventet alvorlig CNS-affeksjon. Dette er en behandling med risiko for betydelige bivirkninger.
Forskning på genterapi som potensielt kan kurere sykdommene pågår.
Lysosomale lagringssykdommer. Ulike typer
Mukopolysakkaridoser ICD-10: E76.0 (Type 1)
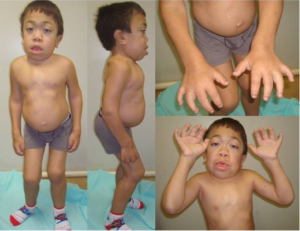
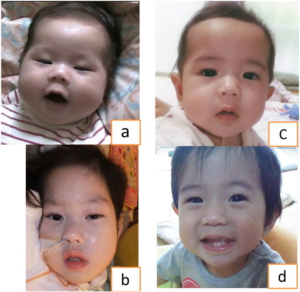
Definisjon: Mukopolysakkaridoser er en gruppe sykdommer karakterisert ved patologisk opphopning av mukopolysakkarider (glykosaminoglykaner). Sykdommene medfører skade på skjelett, brusk, sener, nervesystem, øyne (hornhinner), hud og bindevevet generelt i kroppen. Type I (Hurler, Scheie), type II (Hunter), type III (Sanfilippo), type VI (Maro-Teaux-Lamy), type VII (Sly) og type IX (hyaluronidasemangler) kjennetegnes alle av stivhet og kontrakturer av ledd. Type IV (Morquio) domineres av hypermobilitet. Mukopolysakkaridose er genetisk forårsaket og skilles fra autoimmune bindevevssykdommer. Sykdomsforløpet er ulikt mellom de forskjellige typene.
- -Mukopolysakkaridose I: Omfatter Hurlers sykdom (mest alvorlig), Hurler-Scheies sykdom (intermediær form) og Scheies sykdom (minst uttalt).
- -Sykdomsårsak: Hurler og Gauchers sykdommer skyldes svikt i de lysosomale enzymene. Disse er å finne i lysosomene i Golgi-apparatet. Organismen inneholder flere andre degraderende substanser slik som proteasomer som er multiple protease-komplekser som fordøyer proteiner etter at de er bundet til det evlolusjonsbevarte proteinet ubiquitin
- -Sykdomsdebut: Debuterer i første dekade.
- -Symptomer: Korneaforandringer, triggerfinger, klohånd, nedsatt leddbevegelighet, myopati, karpaltunnesyndroml, radikulopati, hørselstap, hjerteklaffsykdom, lungeinfeksjon og diare. Ingen inflammasjon.
- -Behandling: Behandling med enzym-substitusjon (laronidase).
-Andre typer polysakkaridose
Det finnes også andre typer mukopolysakkaridoser (type II-IX), som har ulike kliniske presentasjoner og sykdomsforløp.
- Mukopolysakkaridose Type II, (Hunters syndrom)
- Mukopolysakkaridose Type III, (Sanfilippo syndrom), deles inn i tye A-D.
- Mukopolysakkaridose Type IV, (Morquio syndrom)
- Mukopolysakkaridose Type V, tilsvarer Type I i form av Scheies syndrom
- Mukopolysakkaridose Type VI, (Maroteaux-Lamy syndrom)
- Mukopolysakkaridose Type VII, (Sly syndrom)
- (Mukopolysakkaridose, Type VIII er tatt ut av klassifikasjonen fordi den dekkes av de andre tilstandene)
- Mukopolysakkaridose, Type IX, (Hyaluronidase-mangel)
-Differensialdiagnoser:
- Mukolipidose: Lagring av fettstoffer. Lignende utseende som mukopolysakkaridose
- Andre lagringssykdommer: Gaucher, Niemann Pick
- Legg-Calve-Pertes sykdom (CLP): Symptomer fra hofter
- Spondyloepifyse dysplasi (SED)
-Litteratur: Muenzer J, 2011
Glykoproteinoser (Mukolipidoser) ICD-10: E77.0
Mukolipidoser består av flere typer som har kliniske og biokjemiske trekk som ligner både mukopolysakkaridoser og sfingolipidoser. De skyldes defekter i nedbrytningen av glykoproteiner og dermed akkumulering av glykoproteiner og glykolipider.
Type I (sialidose) forårsakes av mangel på sialidase som kodes av genet NEU1 (6p21.33). Type II (I-celle sykdom) og III (pseudo-Hurler) skyldes mangel på N-acetylglucosaminyl fosfotransferase som kodes av genet GNPTAB (12q23.2). Type IV skyldes mutasjoner i MCOLN1 genet (locus 19p13.2-13.3) som koder for lysosomal membran kanal og er involvert i Ca2+ signalisering (Kahn SA, 2020). Aspartylglykosaminuri (AGU) og Schindler sykdom er andre eksempler.
Pompe sykdom (Glykogen lagringssykdom type II). ICD-10: E74.0
Pompe er en genetisk nevromuskulær sykdom som også kan påvises hos voksne, til dels på grunn av forsinket diagnostikk. Årsaken er mangel på enzymet sur α-glukosidase, noe som medfører at glykogen ikke metaboliseres i cellene og lagres intracellulært i lysosomene, spesielt i muskelceller. Feilen ligger i GAA genet (17q25.3). Symptomene omfatter muskelsvakhet med kardial- og pulmonal svikt (Meena NK, 2020). Muskel-symptomer gjør at sykdommen også er omtalt i kapitlet om non-inflammatorisk myopati.
Lipidoser, Sphingoidmetabolisme, Ganglosideroser/sphingolipidoser
- -Fabry sykdom. Innlagring av glykolipider. X-kromosomal lysosomal lagringssykdom med mangel på alfa-galactosidase aktivitet. Vennligst les om Fabrys sykdom i eget kapittel
- -Gauchers sykdom ICD-10: 75.2 Gaucher: Lagring av glukocerebrosider. Dette er den vanligste av de lysosomale lagringssykdommene. Mutasjon i kromosom 1 (locus 1q21) gir nedsatt aktivitet av enzymet β-glykocerebrosidase som gir akkumulering av glykocerebrosid i lever, milt og benmarg. Sykdommen angriper lever, milt og benmarg og forekommer i tre varianter. Type 1 er mest vanlig og angriper ikke sentralnervesystemet, men medfører organomegali, skjelett-manifestasjoner og cytopeni. Debut: Debuterer og diagnostiseres oftest i barnealder. Symptomer: Artralgi ofte med leddhevelse. Smerter i hofte, kne eller skulder. Økt tendens til blødninger og blåmerker, forstørret lever og milt. Hos yngre kronisk smerte rundt proksimale tibia eller hofte. Ben-krise gir ømhet, hevelse og erythem over femur eller tibia. Utredning: Senkningsreaksjon (SR), CRP, hvite, perifert blodutstryk, trombocytter, Hb, TSH, T4, Se Fe, TIBC, ferritin, eosinofile, Ca, P, serum elektroforese. Thyreoidea antistoffer, anti-mitokondrie antistoffer, gliadin og endomysium antistoffer. Gen-panel for å sikre diagnosen. Rtg av hender og føtter. Undersøkelsesfunn: Anemi, trombocytopeni (50 %), osteopeni (81 %) og avaskulær nekrose. Splenomegali (95 %), hepatomegali (87 %), vekstretardasjon (34 %), bensmerte og ben-kriser. Økt serumnivå av chitotriosidase og makrofag inflammatorisk protein 1 (MIP-I). Økt insidens av myelom (Weinreb NJ, 2022).
- -Niemann-Pick type A og B: Hel eller delvis mangel på enzymet sur sfingomyelinase. Type A er vanligst og rammer nyfødte, mens type B ofte diagnostiseres hos litt eldre barn. Niemann–Pick Type A er vanligst type. Nyfødte har ikterus, redusert næringsinntak hepatomegali og symptomer på progressiv hjerneskade. Niemann–Pick Type B kjennetegnes ved vekstretardasjon, hepatosplenomegali, redusert lungefunksjon, høye kolesterol/lipid-verdier, men lavt antall trombocytter i blod. Ikke cerebral affeksjon. Diagnostiseres ofte hos litt eldre barn (Schuchman EH, 2017).
- -GM1 gangliosidoser og Tay–Sachs og Sandohoff sykdom (GM2 gangliosidoser) ICD-10; E 75.0; E 75.1: Sykdommene skyldes mangel på enzymene sur β-galaktosidase som kodes av genet GLB1 (3p22) (GM1) og β-hexosaminidase (GM2) som kodes av genene HEXA (15q23) og HEXB (5q13). Sykdommen medfører akkumulasjon av gangliosider. GM1 og GM2 gangliosidoser medfører svært alvorlige nevrologiske symptomer. GM2 gangliosidoser kalles også Tay–Sachs (mangel på hexosaminidase A) og Sandohoff sykdom (mangel på hexosaminidase B) (Cachon-Gonzales MB, 2018).
-Leukodystrofier
En gruppe sjeldne, genetiske sykdommer som påvirker hvit substans i hjernen og ryggmargen, forårsaket av feil i dannelse eller vedlikehold av myelin. Dette kan føre til en rekke nevrologiske problemer, avhengig av hvilken type leukodystrofi man har og hvilke områder av hjernen som er påvirket.
Symptomer på leukodystrofi kan omfatte: Gradvis tap av motoriske ferdigheter (f.eks. problemer med å gå, snakke, svelge), tap av syn og hørsel, kognitive problemer (f.eks. lærevansker, demens), atferdsendringer, kramper og problemer med balanse og koordinasjon.
–Krabbe sykdom ICD-10: 75.2. Innlagring av glykolipider. Sykdomsårsaken er mutasjon i GALC genet (locus 14q31.3) som koder for enzymet galactocerebrosidase. Krabbe sykdom medfører lagring av galakto-lipider inklusiv psykosine. Ubehandlet medfører sykdommen demyelinisering av nerveceller og motorisk og kognitiv svikt (Jain M, 2023).
–Andre typer leukodystrofier: (E71.3) Adrenomyelonevropati; (E75.2) Alexander sykdom; (E75.5) Cerebrotendinøs xanthomatose; Hereditær CNS demyeliniserende sykdom; (E75.2) Metachromatisk leukodystrofi; (E75.2) Pelizaeus–Merzbacher sykdom; (E75.2) Canavan sykdom; (E75.2) Hypomyeliniserende leukodystrofi type 7 (4H syndrom); G93.49) Leukoencefalopati med tap av hvit substans: (E71.3) Adrenoleukodystrofi: (G60.1) Refsum sykdom.
Niemann–Pick type C- ICD-10: 75.2
Årsaken er mangel på enzym som skal transportere kolesterol i lysosomene forårsaket av mutasjon i genene NPC1 (18q11.2) og NPC2 (14q24.3). Niemann–Pick type C medfører patologisk lagring av intralysosomal kolesterol og sphingolipid og gir alvorlige nevrologiske og viscerale symptomer (Newton J, 2018).
Cystinose (aminosyredefekt)
Sykdommen medfører redusert transport av aminosyren cystin ut av lysosomene i cellene. Blant barn er cystinose den vanligste årsaken til Fanconis syndrom (en sjelden nyresykdom). Cystinose finnes i tre ulike former, hvorav nefropatisk type starter i løpet av første leveår, intermediær type begynner i tenårene og en voksen-type som bare har øyne-manifestasjoner (Elmonem MA, 2016).
Neuronal ceroid lipofuscinose (NCLs) (Batten sykdom)
Dette er en gruppe på minst 14 genetisk ulike sykdommer som alle skyldes mutasjon i gener som koder for lysosomale løselige og membranbundene proteiner og ett endoplasmatisk reticulum protein. Sykdommene medfører akkumulering av autofluorescerende pigment og ceroid lipofuscin og gir nerveskader og blindhet (Kohlschütter A, 2019).
Litteratur
Pastores GM 2010 (Behandling)
