ANDRE SYKDOMMER (REV 063-REV 077)
194 Osteoporose (REV 165, REV 167)
Osteoporose
Øyvind Palm
Kjennetegn på osteoporose
Osteoporose er asymptomatisk inntil fraktur tilkommer. Da kan sterke smerter vedvare 2-3 måneder. Oftest vertebrale kompresjonsbrudd.
Kortikosteroider øker risikoen for osteoporose, særlig hos postmenopausale kvinner.
ICD-10: Osteoporose: M80.1 (legemiddelutløst med brudd). M81.5. Idiopatisk osteoporose. M80.5 Idiopatisk osteoporose med patologisk fraktur. M82.8. Osteoporose ved andre sykdommer
Prosedyrekoder: Bentetthetsmåling SNXOXA. Infusjon av legemiddel (Aclasta): WBGM00
Nøkkelord for journalskriving ved osteoporose
Bakgrunn for diagnose: DXA-måling med T-score ≤-2,5, lavenergi-brudd, radiologiske brudd.
- Anamnese:
- Tidligere brudd etter lavenergiskade
- Livsstilsfaktorer (kosthold, fysisk aktivitet, røyking, alkohol)
- Arvelighet (mor, far, søsken)
- bruk av medisiner (kortikosteroider, protonpumpehemmere, antiepileptika, hormoner)
- Underliggende sykdommer som kan påvirke skjelettet (f eks revmatoid artritt, inflammatorisk tarmsykdom, cøliaki, kronisk nyresykdom eller hypertyreose)
- Kvinner: alder ved menarche, menstruasjonshistorikk, alder ved menopause og eventuell bruk av hormonsubstitusjonsterapi.
- Klinisk undersøkelse: Vurder tegn på kyfose, tap av høyde.
- Fallrisiko: Vurder faktorer som kan øke risikoen for fall, inkludert synsproblemer, balansevansker, svimmelhet, polyfarmasi (bruk av mange medisiner) og hjemmemiljøet.
Revmatologer har en sentral rolle i å håndtere osteoporose. Kunnskap om denne tilstanden er viktig for å sikre god pasientbehandling og forhindre alvorlige komplikasjoner.
Osteomalasi er en sjelden tilstand som har mange felles kjennetegn med osteoporose, men annen årsak. Til forskjell fra osteoporose medfører osteomalasi ofte skjelettsmerter, selv uten at frakturer foreligger. Dette kapitlet omhandler osteoporose, mens osteomalasi (og rakitt) er omtalt i eget kapittel
Osteoporose er en systemisk skjelettsykdom karakterisert ved svekket beinstruktur. Dette medfører redusert styrke i benvevet, hovedsakelig på grunn av redusert benmasse og forringet arkitektur i det trabekulære benvevet. Osteoporose forløper vanligvis uten smerter frem til frakturer oppstår.
Definisjon
Osteoporose defineres ved forekomst av lavenergibrudd (brudd i ryggvirvel eller hofte som oppstår etter minimalt traume som fall fra egen kroppshøyde eller lavere) og/eller en T-score ≤ -2,5 i enten lumbalcolumna, lårhalsen eller total hofte ved måling av bentetthet (benmasse) med DXA (Dual-energy X-ray Absorptiometry) (Makitie O, 2022).
T-score. Verdens helseorganisasjon (WHO) har definert osteoporose basert på standardavvik (SD) fra gjennomsnittlig bentetthet (BMD) hos unge, friske voksne (20-40 år). Denne relative verdien kalles T-score.
- Normal bentetthet: T-score > -1,0 SD
- Osteopeni (lav bentetthet): T-score mellom -1,0 og -2,5 SD
- Osteoporose: T-score ≤ -2,5 SD
- Etablert osteoporose: Tilstedeværelse av osteoporose (lav bentetthet) kombinert med ett eller flere lavenergibrudd.
Z-score er en standardisert måleenhet som sammenligner en pasients bentetthet med gjennomsnittsverdien for en referansepopulasjon av samme alder, kjønn og etnisitet. Dette kan være nyttig for å vurdere om det er andre årsaker til lav bentetthet enn aldersrelatert tap av benmasse.
Risikofaktorer for osteoporose og frakturer
Utviklingen av osteoporose og den tilhørende frakturrisikoen er multifaktoriell med bidrag fra både ikke-modifiserbare og modifiserbare faktorer (Eastell R, 2019: Shoback D, 2020).
De tre største risikofaktorene for osteoporotiske frakturer (Chen P, 2009):
- Høy alder
- Lav benmasse (BMD) målt ved DXA. BMD har vist seg å være en svært god surrogatmarkør for frakturrisiko (Black DM, 2020).
- Tidligere lav-energi-frakturer. Studier viser en betydelig risiko på 10-20% for nye frakturer allerede innen ett år (Ferrari S, 2020; Gehlbach SH, 2007).
Ikke-modifiserbare risikofaktorer
-Alder: Høy alder er en uavhengig risikofaktor. Selv med identisk bentetthet vil eldre individer ha en høyere frakturrisiko sammenlignet med yngre.
-Arvelighet: Genetiske faktorer spiller en betydelig rolle i reguleringen av benmasse og benstyrke, og en familiehistorie med osteoporose eller lavenergibrudd øker den individuelle risikoen.
-Kjønn: Kvinner har generelt lavere bentoppmasse og opplever et akselerert bentap etter menopause, noe som gjør dem mer utsatt enn menn.
-Etnisitet: Visse etniske grupper, særlig kaukasiere og asiater, har høyere risiko for osteoporose.
-Tidligere fraktur: En tidligere lavenergibrudd er en sterk prediktor for fremtidige frakturer.
Modifiserbare risikofaktorer
-Kosthold: Utilstrekkelig inntak av kalsium og vitamin D er kritisk, da disse er essensielle for benmineralisering og vedlikehold av benmasse.
-Hormonelle endringer: Vedvarende hypoøstrogenisme hos kvinner (f.eks. tidlig menopause, amenoré), og hypogonadisme hos menn medfører et akselerert bentap.
-Medikamenter: Langvarig bruk av visse medikamenter, spesielt glukokortikoider, men også antiepileptika, heparin og aromatasehemmere kan øke risikoen for osteoporose.
-Livsstil:
–Lav fysisk aktivitet: Inaktivitet fører til redusert mekanisk belastning på skjelettet, noe som er nødvendig for å opprettholde benstyrken.
–Røyking: Sigarettrøyking er assosiert med lavere bentetthet og økt frakturrisiko.
–Høyt alkoholinntak: Kronisk og høyt alkoholinntak kan virke toksisk på osteoblaster (benbyggende celler) og påvirke kalsiummetabolismen.
Lav kroppsvekt: En kroppsmasseindeks (BMI) under 18,5 kg/m² er en risikofaktor, da lavere kroppsvekt er assosiert med lavere bentetthet.
Komorbiditet (Sekundær osteoporose)
En rekke underliggende medisinske tilstander kan bidra til sekundær osteoporose:
-Endokrine sykdommer: Cushings syndrom, hypertyreose, primær hyperparatyreoidisme og diabetes mellitus.
-Gastrointestinale sykdommer: Malabsorpsjonstilstander (f.eks. cøliaki, inflammatorisk tarmsykdom) som fører til nedsatt opptak av kalsium og vitamin D.
-Revmatiske sykdommer: Systemisk lupus erythematosus (SLE), revmatoid artritt, grunnet både sykdomsaktivitet og ofte langvarig bruk av kortikosteroider.
-Nyresykdom: Kronisk nyresvikt kan forstyrre kalsium- og fosfatmetabolismen.
-Hematologiske maligniteter: Multippelt myelom.
Frakturrisiko (Endocrine Society definisjoner 2019-2020)
Lav frakturrisiko (Eastell R, 2019)
- Ingen tidligere lav-energibrudd i columna eller i hofte OG
- T-score >-1 OG
- FRAX MOF <20% og FRAX hofte <3% (se FRAX-score nedenfor)
Moderat frakturrisiko (Eastell R, 2019)
- Ingen tidligere lavenergi-brudd i columna eller hofte OG
- T-score >-2,5 ELLER
- FRAX MOF <20% og FRAX hofte <3%
Høy frakturrisiko (Eastell R, 2019)
- T-score <-2,5 ELLER
- Et lavenergibrudd i hofte eller columna ELLER
- FRAX MOF ≥20% eller FRAX hofte ≥ 3%
Veldig høy frakturrisiko (Shoback D, 2020)
- Multiple lavenergibrudd i columna ELLER
- Lavenergibrudd OG
- T-score ≤ -2,5
Epidemiologi
Osteoporose rammer oftest eldre personer med en betydelig overhyppighet blant postmenopausale kvinner. Sykdommen er asymptomatisk inntil det første lavenergibruddet inntreffer. Dette understreker viktigheten av tidlig diagnostikk og intervensjon for å forebygge alvorlige komplikasjoner som redusert livskvalitet og funksjonstap. Osteoporose medfører også økt mortalitetsrisiko (Mattew A, 2014).
Norge har en av de høyeste forekomstene av osteoporose og osteoporoserelaterte frakturer globalt, basert på bentetthetsmålinger og frakturinsidens. Det er observert en høyere prevalens av osteoporose og brudd i urbane områder sammenlignet med rurale strøk i Norge (Meyer 2004). Dette antas å skyldes multifaktorielle årsaker, inkludert genetiske varianter (Clynes MA, 2020).
De vanligste osteoporotiske frakturene inkluderer vertebrale kompresjonsbrudd, lårhalsbrudd og distale radiusfrakturer. Livstidsrisikoen for lavenergibrudd -definert som frakturer som oppstår etter minimalt traume er estimert til cirka 40% hos kvinner og 20% hos menn (Vestergaard P, 2005; Nasjonal veileder i endokrinologi). Individer med økt falltendens representerer en signifikant risikogruppe med en ni ganger høyere forekomst av brudd (Vranken L, 2022).
Hoftebrudd er den alvorligste kliniske konsekvensen av osteoporose. De fleste hoftebrudd hos eldre skyldes en kombinasjon av redusert bentetthet og fall. I Norge rammes årlig om lag 9000 voksne av hoftebrudd. Det tilsvarer ett brudd hver time. Kvinner er spesielt utsatt, og står for syv av ti hoftebrudd. Risikoen for brudd øker markant fra 70 års alder (Folkehelseinstituttet 20.10.2016; Gregson CL, 2022).
Patogenese
Benresorption og formasjon. Osteoporose kjennetegnes av en forstyrrelse i remodelleringsprosessen. Det oppstår en ubalanse mellom benresorpsjon (nedbrytning av benvev utført av osteoklaster) og benformasjon (nydanning av benvev utført av osteoblaster). Dette fører til et netto tap av benmasse og en forringelse av benets mikroarkitektur og dermed redusert benstyrke og økt frakturrisiko (Liang B, 2022).
Kortikalt og trabekulært benvev. Skjelettet består av omtrent 80% kortikalt benvev (kompakt ben, mest i rørknokler) og 20% trabekulært benvev (spongiøst ben, hovedsakelig i ryggvirvler, ribben, bekken og lange knoklers epifyser). Det trabekulære benvevet har en klart høyere metabolsk aktivitet med en omsetning på rundt 80% av den totale årlige benremodelleringen, sammenlignet med ca. 20% i det kortikale vevet. Omtrent 7% av den totale benmassen fornyes årlig.
Aldersrelatert bentap varierer mellom kjønnene. Hos menn er bentapet gradvis gjennom voksenlivet og utgjør typisk 3-5% av den totale benmassen. Hos kvinner akselererer bentapet markant etter menopausen, primært grunnet redusert østrogenproduksjon. Dette fører til at de horisontale trabeklene i det spongiøse benvevet tynnes ut og perforeres (“trabecular perforation”). Dermed svekkes den indre strukturen og bæreevnen til benet (Smit AE, 2024). Vedvarende ubalanse resulterer i redusert bentetthet og økt fragilitet i skjelettet.
Primær osteoporose
Primær osteoporose refererer til bentap som ikke skyldes en identifiserbar underliggende sykdom eller medikamentbruk. Den deles tradisjonelt inn i tre hovedtyper (Qaseem A, 2023):
Postmenopausal osteoporose (Type I): Denne typen er den hyppigste formen for primær osteoporose hos kvinner. Den er direkte knyttet til det akselererte bentapet som følge av østrogenmangel etter menopausen. Østrogen har en beskyttende effekt på benmassen ved å hemme osteoklastaktivitet og stimulere osteoblastfunksjon. Tap av østrogen fører til økt benresorpsjon, spesielt av trabekulært benvev (Charde SH, 2023).
Aldersrelatert osteoporose (Senil osteoporose / Type II). Denne typen rammer både menn og kvinner, vanligvis etter 70 års alder. Den skyldes primært en kombinasjon av aldersrelaterte endringer (Chandra A, 2021), inkludert:
- Redusert intestinal absorpsjon av kalsium: Tarmen blir mindre effektiv til å ta opp kalsium.
- Redusert nyrefunksjon: Nedsatt renal 1-alfa-hydroksylering fører til lavere produksjon av aktivt vitamin D (kalsitriol).
- Insuffisient vitamin D-status: Som følge av redusert soleksponering og/eller utilstrekkelig kostinntak.
Disse faktorene fører til en negativ kalsiumbalanse og et fall i serumkalsium som igjen stimulerer biskjoldbruskkjertlene til økt produksjon av paratyreoideahormon (PTH). Dette resulterer i sekundær hyperparathyreoidisme som øker benresorpsjon for å opprettholde normale kalsiumnivåer i blodet.
Idiopatisk osteoporose. Dette er en eksklusjonsdiagnose, der årsaken til osteoporosen er ukjent. Den kan forekomme hos unge voksne av begge kjønn og krever grundig utredning for å utelukke sekundære årsaker.
Sekundær osteoporose
Sekundær osteoporose refererer til bentap som er en konsekvens av spesifikke medisinske tilstander, medikamentbruk eller livsstilsfaktorer i motsetning til primær osteoporose som hovedsakelig skyldes alder, genetikk og hormonelle endringer. En rekke tilstander og faktorer kan bidra til utvikling av sekundær osteoporose (Sobh MM, 2022) inkludert:
Glukokortikoid-indusert osteoporose: Dette er den hyppigste formen for medikamentindusert osteoporose. Glukokortikoider (“steroider”) reduserer både osteoblastaktivitet (benformasjon) og øker osteoklastenes levetid (øker benresorpsjon) i tillegg til å påvirke kalsium- og vitamin D-metabolismen negativt. Alvorlighetsgraden avhenger av initial- og kumulativ dose. Glukokortikoid-indusert osteoporose manifesterer seg oftest ved brudd i ryggvirvlene. Risikoen for ryggvirvel- og hoftebrudd kan øke selv ved lave doser prednisolon (2,5 mg daglig). Benmassen kan potensielt øke spontant igjen etter avsluttet inntak av glukokortikoider (Compston J, 2018).
- Primær hyperparatyreoidisme: Overproduksjon av parathyreoideahormon fører til økt benresorpsjon.
- Endogent Cushings syndrom: Kronisk overskudd av kortisol har lignende effekter som eksogent glukokortikoidinntak.
- Hypertyreose: Overskudd av skjoldbruskkjertelhormoner akselererer benremodelleringen med en overvekt av resorpsjon.
- Hypogonadisme: Mangel på kjønnshormoner (østrogen hos kvinner, testosteron hos menn) reduserer benformasjon og øker resorpsjon. Dette inkluderer tilstander som anoreksia nervosa og hyperprolaktinemi.
- Akromegali: For høy veksthormonproduksjon kan paradoksalt nok føre til redusert bentetthet i visse skjelettområder til tross for økt benomsetning.
- Hypofysesvikt: Kan indirekte påvirke benhelsen via mangel på diverse hormoner.
- Hyponatremi: Langvarig hyponatremi er assosiert med økt frakturrisiko.
- Diabetes mellitus: Både type 1 og type 2 diabetes er assosiert med økt frakturrisiko, selv om bentettheten kan være normal eller til og med økt ved type 2.
Inflammatoriske revmatiske sykdommer: Kronisk inflammasjon bidrar til bentap. Eksempler inkluderer revmatoid artritt (RA), ankyloserende spondylitt (Bekhterevs sykdom) og systemisk lupus erythematosus (SLE). Bentapet forverres ofte av høy sykdomsaktivitet og bruk av glukokortikoider.
Gastrointestinale og ernæringsmessige tilstander:
- Intestinal malabsorpsjon: Tilstander som cøliaki, Crohns sykdom og ulcerøs kolitt kan føre til nedsatt opptak av kalsium og vitamin D.
- Kronisk leversykdom og alkoholisme: Leveren er viktig for vitamin D-metabolismen og produksjon av koagulasjonsfaktorer. Kronisk alkoholisme er direkte toksisk for osteoblaster.
- Fedmekirurgi: Kan føre til malabsorpsjon av næringsstoffer essensielle for benhelse.
- Nyresvikt: Kronisk nyresvikt fører til forstyrrelser i kalsium-, fosfat- og vitamin D-metabolismen, ofte med utvikling av renal osteodystrofi.
- Kronisk lungesykdom: Spesielt KOLS på grunn av inflammasjon, inaktivitet og ofte glukokortikoidbruk.
- Malignitet: Visse kreftformer som myelomatose og metastaser til skjelettet kan direkte forårsake betydelig bentap.
Andre faktorer:
- Organtransplantasjon: Immunsuppressiv behandling og underliggende sykdom øker risikoen.
- Langvarig immobilisering: Fravær av mekanisk belastning fører til raskt bentap.
- HIV/AIDS: Både viruset og antiviral behandling kan påvirke benmetabolismen.
Transiente former for osteoporose
Transiente former for osteoporose er sjeldne, men viktige kliniske tilstander. De er karakterisert av forbigående bentap som vanligvis restitueres fullstendig.
Transistent osteoporose i hofteregionen er ofte assosiert med graviditet eller oppstår i postpartum-perioden. Den affiserer typisk hofteleddet, men kan også ramme andre vektbærende ledd som kne, fot og ankel. Klinisk presenteres tilstanden med diffus hevelse, lokal ømhet og progredierende smerter i fremre lår og lyske. Diagnosen stilles ofte ved MR som viser benmargødem. Tilstanden er vanligvis selvbegrensende og stanser oftest innen 2 – 9 måneder. Behandlingen er primært symptomatisk og vektavlastende (Galanis A, 2023).
Svangerskapsosteoporose er en annen transistent form som oppstår på grunn av den økte kalsiumomsetningen under graviditet og amming. Denne tilstanden affiserer primært det aksiale skjelettet med ryggsøylen som det hyppigst affiserte området. Kvinner med ytterligere risikofaktorer kan utvikle vertebrale kompresjonsfrakturer (Hopkinson JM, 2000; Rafey S, 2020). Selv om tilstanden er forbigående, kan frakturene medføre betydelig morbiditet.
Symptomer på osteoporose
Osteoporose er oftest en asymptomatisk tilstand inntil den manifesteres som et lavenergibrudd.
Vertebrale kompresjonsfrakturer
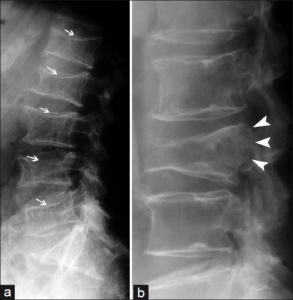
De vanligste osteoporotiske frakturene er kompresjonsfrakturer i ryggvirvlene, spesielt i nedre thorakale og lumbale vertebrae. Disse bruddene kan initialt gi akutte, lokaliserte ryggsmerter, men de kan også oppstå asymptomatisk eller med kun diffuse, uspesifikke smerter. Radiologisk fremstilling, som med konvensjonell røntgen eller Vertebral Fracture Assessment (VFA) med DXA, vil vise sammenfall av vertebrae, oftest anteriort i form av kileformede deformiteter.
Smertene ved vertebrale kompresjonsfrakturer varer vanligvis minst 4-6 uker, men kan persistere i flere måneder. Selv om den akutte smerten avtar, vil de strukturelle deformitetene vedvare radiologisk. Kompresjonsfrakturer kan føre til kyfose og redusert kroppshøyde, mens nerverøtter eller ryggmargen sjelden påvirkes (Patel D, 2022).
Andre frakturlokalisasjoner. Utover vertebrale frakturer kan osteoporose også manifestere seg som frakturer i:
- Collum femoris: Dette er den alvorligste osteoporotiske frakturen, ofte som følge av fall fra egen høyde. Den medfører betydelig morbiditet og mortalitet.
- Distale radius: Frakturer oppstår ofte ved fall med utstrakt hånd.
- Proksimal humerus: Brudd i overarmens øvre del er også vanlig.
- Bekkenet og ribben.
Undersøkelser ved osteoporose
Laboratorieprøver
Laboratorieanalyser kan spille en viktig rolle i utredning, monitorering og differensialdiagnostikk av osteoporose.
-Benmarkører
Benmarkører er biokjemiske parametere som reflekterer kroppens benomsetning, enten ved å måle benformasjon eller benresorpsjon. De er derfor forhøyet ved høy benremodellering, slik som osteoporose, vekstperioder hos barn, etter større frakturer, menopause, hyperparathyreoidisme, inflammasjon, nedsatt nyrefunksjon og Pagets sykdom. Benmarkører er likevel ikke egnet for screening eller diagnostisering av osteoporose. De brukes derimot for å:
- Evaluere behandlingseffekten ved osteoporose: Monitorere respons på medikamentell behandling.
- Monitorere etterlevelse: Indikere om pasienten tar medikamentene som foreskrevet.
- Vurdere behandlingspause: Bidra til å bestemme optimal varighet av medikamentfri periode ved antiresorptiv behandling med bisfosfonater.
Man bør merke seg at kortikosteroid-behandling kan gi falskt lave verdier av benmarkører (Borgen TT, 2021).
–N-terminal Propeptide of Collagen Type I (P1NP)
P1NP regnes som den primære markøren for osteoblastaktivitet (benformasjon). Referanseverdiene varierer med alder og kjønn: for postmenopausale kvinner 16-96 mcg/L, premenopausale kvinner 19-83 mcg/L og voksne menn 22-87 mcg/L.
Respons på antiresorptiv behandling: Etter oppstart av medikamenter som bisfosfonater, østrogener, selektive østrogenreseptormodulatorer (SERM) eller RANKL-hemmere (f.eks. denosumab) forventes P1NP-konsentrasjonen å falle med minst 50% innen 3-6 måneder og bør deretter ligge i den nedre delen av referanseområdet under pågående behandling.
Serumkonsentrasjoner av P1NP < 35 µg/L indikerer at benomsetningen er effektivt supprimert, og at behandlingen har (fortsatt) god effekt.
For pasienter som behandles med zoledronsyre (Aclasta) kan benmarkører følges opp f. eks. ved årlig måling. En ny infusjon kan da være indisert dersom P1NP overstiger 35 µg/L.
Manglende fall i P1NP kan indikere suboptimal effekt eller lav etterlevelse.
Respons på anabol behandling: Ved behandling med anabole medikamenter (f.eks. teriparatid) forventes P1NP å ligge i den øvre delen av referanseområdet (>60,9 mcg/L) etter 6 måneder, som et tegn på økt benformasjon.
Behandlingspause: P1NP kan bidra til å estimere riktig lengde på behandlingspauser ved bisfosfonatbehandling. En økning på over 30% fra et laveste nivå, eller en stigning til over referanseområdet indikerer økende benomsetning og kan signalisere behov for re-oppstart av behandlingen. Dette er spesielt relevant for langvirkende bisfosfonater som zoledronat (Aclasta), hvor behandlingspauser over ett eller flere år kan være aktuelle.
Paget sykdom. P1NP kan brukes til å vurdere sykdomsaktivitet ved Paget sykdom i skjelettet.
Begrensninger: P1NP-testen er ikke pålitelig ved alvorlig leversykdom (pga. leverens metabolisering av P1NP) og kan også påvirkes av nyresvikt.
–CTX-1 (C-terminalt telopeptid fra type 1-kollagen)
CTX-1 er en markør for osteoklastaktivitet (benresorpsjon). Denne markøren er mindre stabil og mer utfordrende å tolke enn P1NP på grunn av betydelige døgnvariasjoner og påvirkning av matinntak. Prøvetaking for CTX-1 bør derfor alltid skje fastende om morgenen for å sikre mest mulig sammenlignbare resultater.
Andre relevante laboratorieprøver
For en omfattende utredning av osteoporose og for å utelukke sekundære årsaker anbefales følgende blodprøver:
- Inflammasjonsparametere: Senkningsreaksjon (SR) og C-reaktivt protein (CRP) for å avdekke systemisk inflammasjon.
- Generell hematologi: Hemoglobin (Hb), leukocytter og trombocytter for å utelukke hematologiske sykdommer.
- Elektrolytter og nyrefunksjon: Kalsium (totalt og ionisert), fosfat, albumin og kreatinin for å vurdere kalsiumhomeostase og nyrefunksjon.
- Leverfunksjon: ALAT og alkalisk fosfatase (ALP) for å evaluere leverstatus. En forhøyet ALP kan også indikere høy benomsetning, men må sees i sammenheng med leverfunksjon.
- Tyreoideafunksjon: Thyreoideastimulerende hormon (TSH) for å utelukke hypertyreose.
- Vitamin D og paratyroidfunksjon: 25-hydroksyvitamin D (25-(OH)vitamin D) for å vurdere vitamin D-status, og parathormon (PTH) for å utelukke primær eller sekundær hyperparatyreoidisme.
- Urinprøver: Døgnurin for kalsium kan være relevant for å vurdere kalsiumutskillelse.
Andre spesifikke tester: Hos menn kan det være aktuelt å måle testosteron for å avdekke hypogonadisme og eventuelt PSA (prostata-spesifikt antigen) ved mistanke om prostatakreft med skjelettmetastaser. Elektroforese kan være aktuelt ved mistanke om myelomatose.
Bildediagnostikk ved osteoporose
Bildediagnostikk er essensielt for å diagnostisere osteoporose, vurdere frakturrisiko og identifisere vertebrale frakturer.
Konvensjonell røntgen av thorako-lumbo-sakralcolumna kan avdekke ellers ukjente vertebrale kompresjonsfrakturer. Disse er klinisk stumme hos 30-50% av pasientene til tross for at de utgjør nesten 50% av alle osteoporotiske frakturer.
Vertebrale frakturer klassifiseres ofte etter grad av sammenfall:
- Grad 1: 20-25% sammenfall
- Grad 2: 25-40% sammenfall
- Grad 3: Over 40% sammenfall
Dessverre er konvensjonell røntgen en lite sensitiv metode for tidlig påvisning av osteoporose, da tegn på redusert bentetthet først blir synlige når minst 30% av benmassen er tapt (Guglielmi G, 2011).
-Dual-energy X-ray Absorptiometry (DEXA/DXA)
DXA regnes som gullstandarden for kvantitativ måling av bentetthet (Bone Mineral Density, BMD), og BMD har vist seg å være en svært god surrogatmarkør for frakturrisiko.
Resultatet av DXA-målinger i hele hofteregionen (total hip) har vist seg å være den beste prediktoren, basert på at resultatene er mer reproduserbar enn måling bare i lårhals (femoral neck) og forstyrres mindre av degenerative forandringer som ved målinger lumbalcolumna/vertebra (Black DM, 2020).
Metoden baserer seg på røntgenstråler med to ulike energinivåer, hvor differansen i absorpsjon mellom de to energiene korrelerer direkte med mengden mineralisert benvev. Det er en sterk korrelasjon mellom BMD målt ved DXA og den mekaniske styrken av skjelettet.
Hensikten med DXA-målinger er å:
- Diagnostisere osteoporose: Basert på T-score (standardavvik fra en ung, frisk referansepopulasjon) eller Z-score (standardavvik fra en alders- og kjønnsmatchet referansepopulasjon).
- Vurdere fremtidig frakturrisiko: Ofte i kombinasjon med andre kliniske risikofaktorer og FRAX®-score (Fracture Risk Assessment Tool) som predikerer 10-års risiko for hoftebrudd og store osteoporotiske frakturer.
- Identifisere pasienter som vil ha nytte av farmakologisk behandling og andre forebyggende tiltak mot brudd.
- Monitorere behandlingseffekt over tid.
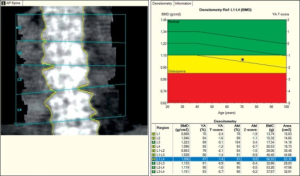
Falskt forhøyede BMD-verdier kan forekomme ved degenerative forandringer, syndesmofytter (som ved ankyloserende spondylitt), tidligere kompresjonsfrakturer eller uttalt aterosklerose i de skannede områdene. Disse tilstandene kan øke den totale absorpsjonen av røntgenstråler, uten at det reflekterer en reell økning i benstyrke.
DXA og glukokortikoid-behandling.
Ved planlagt langvarig glukokortikoid-behandling (mer enn tre måneder) anbefales det at alle pasienter over 18 år får utført en initial DXA-skanning, inkludert Vertebral Fracture Assessment (VFA), ideelt sett ved behandlingsstart. Dette for å kartlegge baseline bentetthet og identifisere preeksisterende vertebrale frakturer. Ved fortsatt glukokortikoid-behandling kan en ny BMD-måling etter ett til to år vurderes med videre kontroller basert på risikoprofil (Nasjonal veileder i Endokrinologi, 2024)
Andre bildediagnostiske metoder
Mens DXA er gullstandarden, finnes også det andre metoder for vurdering av benmasse:
- Single Energy X-ray Absorptiometry (SXA): En eldre metode som primært måler bentetthet i perifere skjelettområder.
- Kvantitativ ultralyd: En ikke-ioniserende metode som kan gi informasjon om benstyrke, men er mindre presis enn DXA for diagnostiske formål.
- Kvantitativ computertomografi (QCT): Kan gi mer detaljert informasjon om volumetrisk bentetthet og separere kortikalt og trabekulært ben, men medfører høyere stråledose.
FRAX-score
FRAX® (Fracture Risk Assessment Tool) er et klinisk verktøy som kan brukes for å estimere 10-års risiko for store osteoporotiske frakturer (vertebrae, humerus, distale radius og hofte; MOF=Major Osteoporotic Fracture). FRAX-kalkulatoren har en ukjent algoritme, men tar hensyn til en rekke kliniske risikofaktorer inkludert bentetthet, alder, kjønn, BMI, tidligere frakturer, familiær historie med hoftebrudd, røyking, alkoholinntak, bruk av glukokortikoider og visse sekundære årsaker til osteoporose. Verktøyet er tilgjengelig via en online kalkulator for enkel tilgang: Kalkulator (FRAX).
- En FRAX MOF-score på under 20% indikerer en lav til moderat risiko for å få et større osteoporotisk brudd i løpet av de neste 10 årene.
- En FRAX MOF-score på over 20% indikerer en høy risiko for å få et større osteoporotisk brudd i løpet av de neste 10 årene. Dette kan indikere at medikamentell behandling for osteoporose bør vurderes.
Differensialdiagnoser
- Homocystinuri: En medfødt metabolsk sykdom som kan gi benskjørhet og dermed ligne på osteoporose.
- Maligne sykdommer i skjelettet: Både primære tumorer og metastaser kan føre til bentap og frakturer som kan ligne på osteoporose.
- Mastocytose: Økt mastcelleaktivitet som i noen tilfeller kan gi benskjørhet og frakturer som må differensieres fra osteoporose.
- Metotreksat-osteopati; Stressfraktur-lignede non-traumatiske skader, oftest i underekstremiteter. Distale tibia angripes os >50%, calcaneus 35% og proksimale tibia 28%. Tilstanden er svært sjelden, men gjenkjennes ved typiske MR-funn med båndformede defekter som ved vekstsone-forandringer (Ruffer N, 2022).
- Multippelt myelom / myelomatose: En type kreft som påvirker plasmaceller og kan gi utbredt bentap, frakturer og hyperkalsemi som kan ligne på osteoporose.
- Osteomalasi (blant voksne): Rakitt (hos barn): Mangelfull mineralisering av benvev som kan gi benskjørhet og frakturer og dermed ligne på osteoporose. Den vanligste årsaken til osteomalasi er mangel på vitamin D.
- Osteopeni: Redusert bentetthet som er et forstadium til osteoporose og deler mange av de samme risikofaktorene.
- Osteitis fibrosis cystica: Tap av benmasse og endret skjelettstruktur som følge av hyperparatyreose som kan forveksles med osteoporose. I blodprøver er parathormon, oftest også kalsium og alkalisk fosfatase forhøyet.
- Osteopetrose: En sjelden, arvelig sykdom med økt bentetthet, men samtidig økt risiko for frakturer som kan forveksles med osteoporose. I blodprøve er alkalisk fosfatase forhøyet.
- Paget sykdom (osteitis deformans): En tilstand med unormal bein-ombygging som kan gi både økt og redusert bentetthet i samme skjelett og dermed ligne på eller maskere osteoporose. Rammer voksne (over 55 års alder), oftest menn. Skjelettsmerter. Gradvis ombygging og fortykkelse i skjelettet, mest i bekken, lår, ryggvirvler og hodeskallen. Alkalisk fosfatase i blod er ofte forhøyet
- Sigdcelleanemi: En arvelig blodsykdom som kan gi benskjørhet som en komplikasjon og dermed ligne på osteoporose.
Behandling av osteoporose
Behandlingsretningslinjer for osteoporose er komplekse og krever en individuell tilnærming. I klinisk praksis vurderes medikamentell behandling oftest hos postmenopausale kvinner og menn over 50 års alder med påvist osteoporose, enten ved DXA-måling eller etter lavenergibrudd (≥ moderat risiko for lavenergibrudd/osteoporotiske frakturer).
Generelle prinsipper og forebyggende tiltak
Alle pasienter med osteoporose eller risikofaktorer, uavhengig av medikamentell behandling, bør motiveres til vektbærende fysisk aktivitet (f. eks. gange, jogging, styrketrening, mens svømming har liten effekt på benbygningen). Livsstilsfaktorer som røyking og høyt alkoholinntak bør elimineres. Ved bruk av glukokortikoider er det essensielt å tilstrebe lavest mulig dose og ideelt sett seponering. Adekvat kosthold er fundamentalt.
-Kalsiumtilskudd: Et daglig totalt kalsiuminntak på 1000-1500 mg via kosthold anbefales. Ved utilstrekkelig kostinntak bør tilskudd på 500-1000 mg/døgn vurderes. Inntak som kveldsdose foretrekkes, da dette kan optimalisere kalsiumtilgjengeligheten under den sirkadiske rytmen av benresorpsjon som starter etter midnatt.
-Vitamin D-tilskudd: Ved vitamin D-mangel (25-(OH)vitamin D < 50 nmol/L) suppleres med vitamin D (400-800 IE/dag, tilsvarende 10-20 µg vitamin D3). Ved normale D-vitaminnivåer har supplerende vitamin D-tilskudd neppe en selvstendig frakturforebyggende effekt (LeBoff MS, 2022).
Kalsium og vitamin D virker sammen fordi Vitamin D er essensielt for kalsiumopptak fra tarmen. Kalsium- og vitamin D-tilskudd alene er imidlertid ikke tilstrekkelig for å øke bentettheten eller forebygge brudd hos personer som allerede har osteoporose. I slike tilfeller er farmakologisk behandling (f.eks. bisfosfonater, denosumab) nødvendig (Helsenorge, 2024).
Det er en pågående debatt om kalsiumtilskudd utenom gjennom kosthold øker risikoen for aterosklerose (hjerteinfarkt og slag). Mange eksperter og retningslinjer er derfor inntil videre mer forsiktige med å anbefale utbredt bruk av kalsiumtilskudd med mindre det er en klar indikasjon.
Det anbefales å prioritere tilstrekkelig inntak av kalsium gjennom et balansert kosthold med kalsiumrike matvarer (f.eks. meieriprodukter og enkelte grønnsaker som grønnkål, brokkoli og spinat).
–Kalsiuminnholdet i kosten kan estimeres ut fra en formel: Kalsium (mg/døgn) = 300 + (150 x antall glass melk) + (150 x antall brødskiver med ost) + (250 x porsjoner surmelksprodukter). Melk inneholder 100 mg per dl og ost 75 mg pr 10 gram.
Informasjon og etterlevelse: Grundig informasjon til pasienten om behandlingsmål, virkemåte og potensielle bivirkninger er viktig for behandlingsetterlevelse. Skriftlig medikamentinformasjon, eksempelvis fra Norsk revmatologisk forening/Legeforeningen kan være et verdifullt supplement.
Generelle indikasjoner for medikamentell behandling
Det er en økende tendens til tidlig medikamentell intervensjon ved osteoporose. Dette er basert på nyere kunnskap om sykdommens konsekvenser og et bredere spekter av effektive behandlingsalternativer.
Behandlingsmål. Man ønsker noen ganger å rette behandlingen mot et på forhånd fastsatt behandlingsmål. Dette kan være å redusere risiko for fremtidige frakturer ved å stabilisere benmassen eller øke den med en viss prosentandel innen et bestemt tidsrom. For eksempel for pasienter med T-score ≤ -2,5 kan behandlingsmålet være å økte BMD til over denne osteoporose-verdien i løpet av 3-5 år (Cosman F, 2024).
Eksempler på medikamentelle behandlingsindikasjoner ved osteoporose:
-Behandlingsindikasjoner uavhengig av bentetthetsmåling/T-score hos personer >50 år:
- Etter lavenergibrudd av vertebrae grad 2 (>25% sammenfall) eller grad 3 (>40% sammenfall) i minst én virvel eller grad 1 (<25% sammenfall) i multiple virvler.
- Etter lavenergifraktur i proksimal femur.
- Multiple lavenergifrakturer distalt eller i bekken.
- Behandlingsmålet er å redusere risikoen for nye brudd.
-Eksempel på medikamentell behandling: Bisfosfonater eller denosumab/Prolia (antiresorptiv medikasjon) vil oftest være førstevalget. Ved behov for en raskere reduksjon av frakturrisikoen vil anabole medikamenter som teriparatid (Forsteo) eller romomuzumab (Evenity) velges.
BMD med T-skår ≤ -2.5 SD (totalt eller i lårhals) eller i columna
Ingen frakturer: Vurder frakturrisiko; Hvis det foreligger risikofaktorer som høy alder, genetisk disposisjon, tidligere lav-energi-fraktur etc. er bisfosfonater ofte førstevalget.
-Behandling som gjør at minst 50% av kvinner kan oppnå T-score >-2,5 innen 3 år basert på laveste baseline T-score:
-Bisfosfonater: T-score i total hofte ned til -2,7 eller i lumbalcolumna ned til -3,0 (Cosman F, 2021).
-Denosumab: T-score i total hofte ned til -2,8 eller i lumbalcolumna ned til -3,1 (Cosman F, 2022).
-Romosozumab eller teriparatide etterfulgt av alendronat (sekvensiell behandling): T-score i total hofte ned til -2,9 eller i lumbalcolumna ned til -3,5 (Langdahl B, EULAR, 2025)
-Romosozumab etterfulgt av denosumab: T-score i total hofte ned til -3,1 eller i lumbalcolumna ned til -3,7 (Langdahl B, EULAR, 2025)
Multiple frakturer: Hvis pasienten siste tre år har hatt lavenergi-frakturer i radius, humerus, columna, bekken eller hofte (spesielt høy frakturrisiko) kan initial behandling med et anabolt medikament, f. eks. romosozumab (Evenity), vurderes som alternativ til bisfosfonater.
Multiple vertebrale frakturer og T-score < -3: Spesielt høy frakturrisiko. Vurder anabol medikasjon f. eks. med teriparatid (Forsteo).
Behandlingsmålet er å redusere risikoen for (nye) osteoporotiske brudd. Med anabole medikamenter som romosozumab, teriparatid vil risikoen for nye frakturer reduseres raskere enn vd antiresorptive medikamenter (bisfosfonater, denosumab).
Sekvensiell behandling: Dette er en strategi der en starter med et anabolt middel for å bygge opp beinmasse og deretter følger opp med et antiresorptivt middel for å “låse inn” den oppnådde gevinsten i bentetthet. Dette kan gi en synergistisk effekt og maksimere bruddforebyggingen (Chandran M, 2022).
–T-skår mellom -1.0 og -2.5 SD (osteopeni) kombinert med høy frakturrisiko: Ikke-medikamentelle tiltak og ny BMD-måling med T-score om 2-3 år, eller vurdere å starte med bisfosfonater (avhengig av antatt reell frakturrisiko som høy alder, genetisk disposisjon, tidligere lav-energi-fraktur etc.). Behandlingsmålet er å redusere risikoen for fremtidige frakturer.
-Glukokortikoider: Behandlingsindikasjon ved planlagt behandling med orale glukokortikoider (prednisolon ≥ 7,5 mg/dag) over mer enn 3 måneder (endocrinology.dk).
–Ved T-score <-1 startes frakturprofylakse med enten bisfosfonat eller denososumab.
–Ved T-score < -3 og ett kompressionsbrudd (>25 %) eller minst to kompresjonsbrudd (>25 %) uavhengig av T-score overveies teriparatid.
Spesifikke medikamentelle alternativer
Det finnes flere medikamentelle alternativer som gir mulighet for persontilpassede behandlingsvalg (Nasjonal veileder i Endokrinologi, 2024). Medikamentene kan deles inn i to hovedgrupper: antiresorptive og anabole medikamenter.
-Antiresorptive medikamenter (bisfosfonater, denosumab): Virker primært ved å hemme nedbrytningen av benvev. De reduserer aktiviteten og/eller levetiden til osteoklastene, cellene som er ansvarlige for å resorbere gammelt ben. Eksempler er bisfosfonater som alendronat, zoledronsyre (Aclasta) og denosumab (Prolia). Ved å redusere beinnedbrytningen tillates en netto økning i bentetthet, da den gjenværende beindannelsen fortsetter i normalt tempo. Antiresorptive medikamenter velges vanligvis som førstevalg ved:
- Generell osteoporose uten ekstremt høy bruddrisiko: Dette gjelder de fleste pasienter som starter medikamentell behandling for osteoporose.
- Osteopeni med høy FRAX-score for MOF (>20%) eller hoftebrudd (>3%): Her vurderes ofte bisfosfonater for å redusere risikoen.
- Forebygging av glukokortikoidindusert osteoporose: Ofte velges bisfosfonater eller denosumab.
Vedlikeholdsbehandling: Etter en periode med anabol behandling brukes antiresorptive midler for å opprettholde og konsolidere bentetthetsøkningen (sekvensiell behandling).
Pasienter som ønsker et enklere doseringsregime: Mange antiresorptive midler har sjeldnere dosering (ukentlig, månedlig, halvårlig eller årlig) enn anabole midler som ofte krever daglige injeksjoner (teriparatid) eller månedlige injeksjoner (romosozumab) i en begrenset periode.
-Alendronat (Fosamax), bisfosfonat:
Dosering: Vanligste dosering er 70 mg peroralt én gang ukentlig.
Praktisk bruk: Må tas på tom mage med rikelig vann, minst 30-60 minutter før første inntak av mat, drikke eller andre medikamenter. Pasienten må holde seg oppreist (sittende eller stående) i minst 30 minutter etter inntak for å unngå øsofagusirritasjon.
Indikasjoner: Førstelinjebehandling ved de fleste former for osteoporose.
Bivirkninger (vanlige) omfatter: halsbrann, magesmerter eller ubehag i magen.
Kontraindikasjoner: Øsofagusanomalier/svelgevansker, manglende evne til å sitte eller stå oppreist i minst 30 minutter etter tablettinntak, hypokalsemi, alvorlig nyresvikt (GFR < 35 ml/min).
Oppfølging: P1NP-måling etter 3-6 måneder, deretter årlig. DXA-måling hvert annet år. Behandlingspause kan vurderes etter 5 års behandling dersom BMD ligger > -2.5 og ingen nye frakturer. Hovedårsaken er risiko for patologiske frakturer etter lengre tids kontinuerlig bruk av bisfosfonater (Reid IR, 2015).
-Zoledronsyre (Aclasta), bisfosfonat
Dosering: 5 mg/100 ml intravenøs infusjon én gang årlig. Administreres poliklinisk eller på dagpost.
Praktisk bruk: Valg ved kontraindikasjoner mot orale bisfosfonater, gastrointestinale bivirkninger eller dårlig etterlevelse. Kan også vurderes ved mangelfull absorpsjon av orale bisfosfonater.
Indikasjoner: Behandling av osteoporose, inkludert glukokortikoidindusert osteoporose.
Bivirkninger (vanlig) omfatter: Influensalignende symptomer (akuttfasereaksjon), hodepine, artralgi, myalgi.
Kontraindikasjoner: Hypokalsemi, alvorlig nyresvikt (GFR < 35 ml/min).
Oppfølging: Som alendronat. Ved mindre alvorlig osteoporose kan intervallet mellom infusjonene økes til 18-24 måneder, eller sjeldnere (hvert 3. år) basert på benomsetning.
-Denosumab (Prolia)
Virkemåte: Denosumab er et monoklonalt antistoff som hemmer RANKL (Receptor Activator of Nuclear Factor-κB Ligand) og dermed reduserer dannelse, funksjon og overlevelse av osteoklaster. Dette fører til en potent hemming av benresorpsjon.
Dosering: 60 mg subkutant hver 6. måned.
Praktisk bruk: Anses som et godt alternativ ved manglende effekt av- eller intoleranse for bisfosfonater eller ved nyresvikt (eGFR < 30 ml/min). Ofte førstevalg for pasienter over 75 år. Effekten er reversibel, og seponering uten overgang til annet antiresorptivt middel medfører raskt tap av BMD og en betydelig økt risiko for multiple vertebrale frakturer.
Indikasjoner: Osteoporose, spesielt hos pasienter med høy frakturrisiko eller hvor bisfosfonater er kontraindisert/ikke tolereres.
Bivirkninger (vanlige) omfatter: Muskel- og skjelettsmerter inkludert smerter i ryggen, hypokalsemi.
Kontraindikasjoner: Hypokalsemi.
Oppfølging: Som hovedregel er denosumab en livslang behandling. I motsetning til bisfosfonater som når et platå, forventes en økning av BMD også etter 5-10 års behandling (Reid IR, 2015). Ved behov for seponering må dette konfereres med spesialist, og overgang til et bisfosfonat (oftest zoledronsyre i.v.) er obligatorisk for å forhindre “rebound”-fenomen. Behandling med zoledronsyre bør da starte 6 måneder etter siste denosumab-injeksjon og benmarkører bør monitoreres tett.
-Anabole medikamenter (teriparatid, romuzumab) virker ved å stimulere nydannelse av benvev. De øker aktiviteten til osteoblastene, cellene som bygger opp nytt bein. Eksempler er teriparatid (Forsteo) som er en syntetisk versjon av parathyreoideahormon (PTH) og romosozumab (Evenity) (et anti-sklerostin antistoff som både øker beindannelse og reduserer beinnedbrytning). Denne direkte stimuleringen av beindannelse fører til en raskere og ofte større økning i bentetthet sammenlignet med antiresorptive midler.
Anabole medikamenter skal bruks i en begrenset periode og etterfølges av et antiresorptivt medikament, f.eks. bisfosfonat. Anabole medikamenter velges ofte ved:
- Alvorlig osteoporose med svært høy bruddrisiko:
- Pasienter med svært lav T-score (f.eks. ≤ -3.5 eller -4.0).
- Pasienter med multiple vertebrale frakturer (spesielt to eller flere eller mer alvorlige kompresjonsbrudd).
- Pasienter som har opplevd nye brudd under pågående behandling med antiresorptive midler (behandlingssvikt).
- Glukokortikoidindusert osteoporose med spesielt høy risiko og ved alvorlige kompresjonsbrudd.
- Intoleranse eller kontraindikasjoner mot antiresorptive midler.
- Når det er ønskelig med raskere beinoppbygging og en mer signifikant økning i bentetthet.
-Teriparatid (Forsteo)
Virkemåte: Teriparatid er en rekombinant form av humant paratyreoideahormon (PTH). Ved intermitterende administrasjon stimulerer det primært osteoblastenes aktivitet og fremmer ny benformasjon (anabol effekt).
Dosering: 20 µg subkutant én gang daglig.
Praktisk bruk: Førstevalg ved svært alvorlig osteoporose, definert som svært lav BMD (T-skår < -3.5), multiple lavenergibrudd eller frakturer under pågående antiresorptiv behandling. Effekten forventes å være bedre enn bisfosfonater (Kendler DL, 2018). Behandlingen gis som en injeksjon som pasienten selv administrerer.
Indikasjoner: Alvorlig osteoporose hos postmenopausale kvinner og menn med høy frakturrisiko eller glukokortikoid-indusert osteoporose.
Bivirkninger (vanlige) omfatter: Smerter i ekstremitetene, kvalme, hodepine, svimmelhet og reaksjoner på injeksjonsstedet.
Kontraindikasjoner: Hyperkalsemi, alvorlig nyresvikt (GFR < 30 ml/min), metabolske skjelettsykdommer (f.eks. Pagets sykdom, uforklart forhøyet alkalisk fosfatase), tidligere skjelettstrålebehandling, uforklarte forhøyede ALP og tidligere kreft i skjelettet eller metastaser.
Varighet: Behandlingsvarigheten er begrenset til maksimalt 24 måneder. Etter avsluttet teriparatid-behandling må pasienten umiddelbart overføres til et antiresorptivt medikament (bisfosfonat eller denosumab) for å bevare den oppnådde benmasseøkningen.
-Romosozumab (Evenity)
Virkemåte: Romosozumab er et monoklonalt antistoff som hemmer sklerostin, et protein som normalt hemmer benformasjon. Ved å blokkere sklerostin øker romosozumab benformasjon og reduserer samtidig benresorpsjon.
Dosering: 210 mg som to subkutane injeksjoner à 105 mg én gang per måned.
Praktisk bruk: Brukes ved svært alvorlig osteoporose. Behandlingen gis i en begrenset periode på 12 måneder og må umiddelbart etterfølges av et antiresorptivt middel (f.eks. bisfosfonat eller denosumab) for å opprettholde effekten (Saag KG, 2017).
Indikasjoner: Alvorlig osteoporose hos postmenopausale kvinner med svært høy frakturrisiko, som ikke har responderte på annen osteoporosebehandling.
Bivirkninger (vanlige) omfatter: Artralgi og myalgi, hodepine, reaksjoner på injeksjonsstedet. hypokalsemi. Kardiovaskulære hendelser.
Kontraindikasjoner: Hypokalsemi og er kontraindisert ved tidligere hjerteinfarkt eller hjerneslag på grunn av økt kardiovaskulær risiko i kliniske studier.
Varighet: Maksimalt 12 måneder.
Kjeveosteonekrose er en sjelden, men alvorlig tilstand der kjevebeinet dør. Risikoen ved antiresorptiv eller anabol osteoporose-medikasjon er lav, men øker ved dårlig munnhygiene, tidligere tannproblemer, innvasiv tannbehandling eller ved samtidig bruk av glukokortikoider (Gehrke B 2023).
Atypiske femurfrakturer forekommer særlig ved langtidsbehandling med bisfosfonater. Risikoen er generelt lav (1/10.000-1/100.000) og påvirker sjelden initialt risk/benefit ratio for disse legemidler i betydelig grad. Ved langtids behandling øker imidlertid risikoen (Gehrke B 2023).
Yngre postmenopausale kvinner (45-60 år):
Hormonbehandling (HT): Kan vurderes ved signifikante menopausale plager og/eller osteoporose. Transdermal østrogen kan være førstevalg. Ved bevart uterus kombineres østrogen med et gestagen (f.eks. gestagenspiral eller peroralt/kombinasjonsplaster).
Raloksifen (Evista): 60 mg peroralt daglig (selektiv østrogenreseptormodulator, SERM).
Alternativer som alendronat, zoledronsyre, teriparatid og romosozumab er også aktuelle, avhengig av alvorlighetsgrad.
Eldre postmenopausale kvinner (> 60 år):
Bisfosfonat. Oralt alendronat eller årlig zoledronsyre er ofte førstevalg.
Denosumab kan vurderes ved manglende effekt/intoleranse for bisfosfonater, ved nyresvikt (eGFR < 30 ml/min) og ofte foretrukket ved alder > 75 år, men krever livslang behandling.
Teriparatid og Romosozumab ved alvorlige tilfeller. Unngå romosozumab ved risiko for kardiovaskulære hendelser.
Menn:
Bisfosfonater. Behandlingen følger i stor grad retningslinjene for kvinner med Alendronat, Zoledronsyre og Denosumab som vanlige alternativer.
Teriparatid og Romosozumab ved alvorlige tilfeller. Unngå romosozumab ved risiko for kardiovaskulære hendelser.
Testosterontilskudd (f.eks. Nebido injeksjon hver 3. måned eller testosteron gel) er indisert ved påvist hypogonadisme.
Premenopausale kvinner og menn < 50 år:
Krever individualisert behandling og spesialkompetanse f. eks. innen endokrinologi for å utelukke og behandle sekundære årsaker til osteoporose (se nærmere: Metodebok endokrinologi).
Behandling av glukokortikoid-indusert osteoporose (GIOP) / Profylakse ved steroidbehandling (basert på Nasjonal veileder i Endokrinologi, 2024)
Kalsium og vitamin D-tilskudd anbefales til alle pasienter som starter langvarig glukokortikoidbehandling, med mindre det foreligger kontraindikasjoner som hyperkalsemi.
Ved T-score < -1.0 før oppstart av glukokortikoidbehandling bør antiresorptiv behandling vurderes.
Varighet. Behandlingen med antiresorptive midler bør vedvare 6-12 måneder etter seponering av systemiske glukokortikoider.
Alendronat peroralt er ofte førstevalg. Zoledronsyre intravenøst er indisert ved kontraindikasjoner mot orale bisfosfonater, gastrointestinale bivirkninger eller redusert absorpsjon.
Ved svært alvorlig GIOP (T-skår < -3.5, multiple lavenergibrudd eller grad 3 vertebrale frakturer) kan direkte oppstart med teriparatid vurderes, etterfulgt av et bisfosfonat (sekvensiell behandling).
Denosumab kan vurderes ved nyresvikt, men den raske effektreverseringen ved seponering må tas med i betraktningen.
Behandlingsvarighet og seponering. Behandlingsvarigheten med bisfosfonater er ofte langvarig, men behandlingspauser må vurderes:
Bisfosfonater: P1NP van være nyttig å måle etter 3-6 måneder, deretter årlig. En 50% reduksjon i benmarkører er forventet. Behandlingspause kan overveies etter 5 års behandling med alendronat eller 3 år med zoledronsyre, dersom BMD i hoften er > -2.5 og ingen nye frakturer har oppstått. Hvis T-skår fortsatt er ≤ -2.5, anbefales lengre behandling (f.eks. 6 infusjoner med zoledronsyre eller 10 års peroral behandling) før pause. Under behandlingspause bør frakturrisiko evalueres hvert 2-4 år, DXA hvert 2-3 år, og P1NP årlig. Ved nytt lavenergibrudd eller signifikant fall i BMD, bør behandling re-startes eller endres. Ved sviktende behandlingsrespons vurderes også å skifte medikament.
Denosumab (Prolia): Som hovedregel er denosumab livslang behandling grunnet risikoen for raskt bentap og multiple vertebrale frakturer ved seponering. Sikkerhetsdata foreligger for opptil 10 års bruk. Seponering skal alltid skje i samråd med spesialist, og overgang til et bisfosfonat (oftest zoledronsyre i.v.) er essensielt for å forhindre “rebound”-fenomen.
Teriparatid (Forsteo): Skal aldri brukes mer enn 2 år ved osteoporoseindikasjon og må umiddelbart etterfølges av et antiresorptivt middel for ikke å tape den oppnådde effekten.
Romosozumab: Brukes i 12 måneder og må umiddelbart etterfølges av antiresorptiva for ikke å tape den oppnådde effekten. Seponeres ved akutt hjerteinfarkt eller apopleksi.
| Forekomst av patologiske brudd under behandling med bisfosfonater (Pearce O, 2021) | |
| Behandlingsvarighet | Prevalens / 100.000 person-år |
| inntil 2 år | 1,78 |
| 6-8 år | 38,9 |
| >10 år | 107,5 |
Behandlingssvikt (basert på Nasjonal veileder i Endokrinologi, 2024)
Behandlingssvikt defineres som signifikant fallende BMD (>3% i rygg målt i g/cm²) eller minst to nye lavenergibrudd etter minst ett års adekvat behandling. Dårlig etterlevelse må utelukkes, og benmarkører bør kontrolleres. Ved behandlingssvikt vurderes bytte til mer potent antiresorptiv eller anabol terapi. Hos pasienter > 75 år, der teriparatid ikke er praktisk, kan bytte fra bisfosfonat til denosumab være et godt alternativ. Endring i BMD skal sammenlignes i g/cm² og ikke i T- eller Z-skår.
Manglende oppnåelse av adekvate behandlingsmål kan også anses som behandlingssvikt.
Fraktur-tilhelning. Studier indikerer at osteoporosebehandling generelt ikke påvirker frakturheling negativt (Chandran M, 2024).
Oppfølging etter seponering eller ved behandlingspauser (basert på Nasjonal veileder i Endokrinologi, 2024). Kontrollene omfatter evaluering av medikamentbivirkninger og smerteproblematikk, blodprøver (kalsium, 25-OH vitamin D, eGFR, P1NP) og monitorering av behandlingseffekter (benmarkører, nye frakturer, høydetap, DXA).
- Det forventes en BMD-stigning på 5-10% i columna og 2-6% i hoften etter tre års bisfosfonat- eller denosumab-behandling, med størst effekt det første året. Etter 5 års bisfosfonat-behandling forventes liten ytterligere BMD-økning utenfor columna. Denosumab forventes derimot å gi en kontinuerlig BMD-økning over en periode på minst 10 år.
- Teriparatid i 24 måneder forventes å gi ca. 3% BMD-økning i lårhalsen og ca. 9% i columna.
- Romosozumab forventes å gi ca. 6% BMD-økning i total hofte og 13% i LS columna etter 12 måneder.
- Pasienter som er forbehandlet med antiresorptiva kan vise noe lavere BMD-stigning med anabole preparater.
| Tabell: Osteoporose-medikamenter. (fra Nasjonal Veileder i Endokrinologi, 2024) | |||
| Legemiddel-
gruppe |
Virknings-mekanisme | Viktigste kontraindikasjoner* | Bivirkninger/ kommentarer. |
| Østrogen/
(gestagen) |
Antiresorptiv,
Påvist effekt på vertebrale og nonvertebrale brudd. |
Mamma cancer (også tidligere), endometriecancer. Økt risiko for DVT og lungeemboli (for eks. Leiden mutasjon pos.) | Det er påvist en liten økt risiko for brystkreft i amerikanske, men ikke i europeiske randomiserte, prospektive studier ved bruk av kombinert østrogen/gestagen behandling. Østrogen monoterapi er ikke assosiert med økning av risiko for brystkreft. Hos kvinner som starter hormonbehandling før 60-års alder er risiko for kardiovaskulær sykdom nedsatt, mens kvinner som starter etter 60 års alder synes å ha økt risiko. Økning av risiko for tromboemboli ved bruk av perorale preparater, men ikke påvist ved bruk av transdermal administrasjon. |
| Selektive estogen receptor modualor (SERM) Raloxifen / Evista | Antiresorptiv,
Kun vist effekt på vertebrale brudd |
Økt risiko for DVT og lungeemboli | Lett økt risiko for slag. Reduserer risiko for brystkreft |
| Perorale og intravenøse bisfosfonater | Antiresorptiv,
vist effekt på hoftebrudd og vertebrale brudd |
eGFR < 35 ml/min, hypokalsemi, 25-OH vitamin D < 25 nmol/L). I tillegg gjelder for peroral: Alvorlige refluks plager, øsofagusstenose, akalasi. Manglende evne til å være oppreist 30 minutter etter inntak. | Kjeveosteonekrose, særlig ved iv administrasjon og samtidig malignitet/dårlig tannstatus/diabetes mellitus/glukokortikoider.
Atypiske femurfrakturer (særlig ved langtidsbehandling). Risikoen (1/10.000-1/100.000) påvirker ikke risk/benefit ratio for disse legemidler i betydelig grad. |
| RANKL-hemmer (denosumab) | Antiresorptiv | Hypokalsemi, 25-OH vitamin D < 25 nmol/L). | Som bisfosfonater. Effekten av medikamentet opphører raskt etter seponering med høy risiko for nye frakturer. |
| PTH-analog (teriparatide) | Anabol, forebyggende effekt på frakturer i columna | Hyperkalsemi, Mb.Paget, uavklart høy ALP, eGFR < 30 ml/min, stråling mot skjelett. Malignitet eller metastaser i skjelettet. Forsiktighet ved aktiv cancersykdom. | Smerter i ekstremitetene muskelkramper, kvalme takykardi, nyresvikt, forbigående hyperkalsemi.
Ingen økt risiko for osteosarkom. Effekten av medikamentet opphører raskt etter seponering |
| Sklerostin-hemmer (romosozumab) | Anabol/Anti-resorptiv. Effekt på vertebrale og ikke-vertebrale brudd. | Hypokalsemi.
Tidligere hjerteinfarkt eller hjerneslag. |
Nasofaryngitt og artralgi. Sjeldent ONJ og atypiske femurfrakturer. Kardiovaskulær risiko bør tas i betraktning.
Risiko for hypokalsemi er hyppigere ved GFR< 30. |
Retningslinjer
Nederland, (van den Bergh JP, 2024)
Danmark: Dansk Selskab for endokrinologi
Storbritannia, Gregson CL, 2022
Europeiske guidelines, postmenopausal osteoporose, Kanis JE, 2019
Nasjonal veileder i Endokrinologi
Litteratur
Nasjonal veileder i Endokrinologi, 2024
Rosen CJ, 2020 (epidemiologi og patogenese)
Syversen U, 2003 (behandling)
Teksten er skrevet og gjennomgått av forfatterne. I bearbeidelsen har vi brukt kunstig intelligens i deler av teksten.
