ARTRITT (REV 006-REV 020)
35 Revmatoid artritt (RA), leddgikt (REV 006)
Øyvind Palm and Jan Tore Gran
Diagnosekoder ICD-10: M05.8 (annen seropositiv); M06.0 (seronegativ)
Prosedyrekoder: Leddpunksjon/artrocentese (klikk for å spesifisere ledd:) TN_10. UL veiledet leddpunksjon: NXA10K. Mikroskopi av leddvæske: NXFT05. EKG FPFE15
ATC koder: Behandling med immunsuppressive legemidler: etanercept: L04AB01, adalimumab: L04AB04, triamcinolon (Lederspan): H02AB08, betametason (Celeston Chronodose): H02AB04, rituksimab: L01XC02, abatacept: L04AA24, tocilizumab: L04AC07, infliksimab: L04AB02. tofacitinib: L04AA29
Nøkkelord for journalskriving ved revmatoid artritt
Diagnosen er basert på:
-
- Perifer artritt i MCP, PIP, MTP
- Symmetrisk affeksjon
- Andre perifere artritter, kjeveledd, atlantoaksialt
- Radiologisk påvist usurerende artritt
- RF, anti-CCP, CRP, SR
- Subkutane noduli
- Tidligere sykdommer
- Tidspunkt for artritt-debut (første symptom som relateres til artritt)
- Lunge-noduli, ILD, pleuritt
- Feltys syndrom
- Nevropati
- Osteoporose
- Gjennomgått behandling
- csDMARDs
- Biologiske midler
- JAK-hemmere/tsDMARDs
- Kortikosteroider per oralt
- Revmakirurgi
- Allergier
- Hensikten med konsultasjonen
Innhold
- Definisjon (oversikt)
- Historikk
- Epidemiologi
- Etiologi og patogenese
- Symptomer
- Ledd, muskel og sener ved RA
- Ekstraartikulære manifestasjoner
- Utredning
- Diagnose og klassifikasjonskriterier
- Ulike typer RA
- Differensialdiagnoser
- Mål for sykdomsaktivitet
- Svangerskap ved RA
- Behandling
- Forebyggende tiltak
- Ikke-medikamentell behandling
- Medikamenter
- Oppfølging under behandling
- Avslutte DMARDs
- Medikamenter ved kirurgi
- RA som er vanskelig å behandle
- Prognose
- Retningslinjer og prosedyrer
- Litteratur
Definisjon
Revmatoid artritt (RA) er en av de vanligste inflammatoriske artrittsykdommene hos voksne. Tilstanden karakteriseres av en kronisk immunmediert synovitt i synovialhinner på innsiden av leddkapsler og i seneskjeder.
Det kliniske bildet domineres av smerte, stivhet og hevelse i affiserte ledd, samt periartikulær inflammasjon.
Ubehandlet kan RA føre til irreversibel destruksjon av leddbrusk og underliggende skjelett gjennom erosjoner, noe som igjen kan resultere i store funksjonstap og deformiteter (Smolen JS, 2016).
Diagnosen stilles av lege, vanligvis revmatolog, basert på en samlet vurdering av sykehistorie, kliniske funn, laboratorieprøver og bildediagnostikk. Det finnes ingen enkeltstående test som alene bekrefter RA (Schett G, 2012).
Utover leddmanifestasjoner kan RA gi generelle symptomer som fatigue, lavgradig feber og vekttap og systemiske manifestasjoner fra ger, hjerte og blodårer. I blodprøver ses ofte forhøyede inflammasjonsmarkører (SR, CRP, trombocytose). Autoantistoffene anti-CCP (ACPA) og revmafaktor (RF) påvises hos en stor andel av pasientene, men både seropositiv og seronegativ RA forekommer (Hyldgaard C, 2017).
Behandlingen er individualisert og består vanligvis av en kombinasjon av sykdomsmodifiserende antirevmatiske legemidler (csDMARDs, bDMARDs, tsDMARDs) samt analgetika eller NSAIDs ved behov. Ikke-medikamentelle tiltak som fysioterapi og ergoterapi. er viktige supplementer.
Introduksjonen av nye antirevmatiske legemidler siden 1980-tallet har betydelig forbedret prognosen. Hos mange pasienter kan moderne behandling stoppe sykdomsaktiviteten helt. Optimal behandling krever god sykdomsforståelse og tett samarbeid mellom pasient og behandlere (Uhlig T, 2014; Smolen JS, 2016; Provan SA, 2020).
Historikk
Artrittsykdommer har vært kjent i flere tusen år. Artritt ble beskrevet allerede rundt 1500 f.Kr. i Ebers papyrus, og karakteristiske leddforandringer er funnet i egyptiske mumier. Hippokrates beskrev artritt rundt 400 f.Kr., men skilte ikke mellom ulike artrittformer, og før ca. 1000 e.Kr. finnes ingen sikre beskrivelser som entydig identifiserer RA. Det er derfor usikkert om RA faktisk forekom i denne perioden. Begrepet «revmatisme» ble introdusert av Galen (129 – 216 e. Kr.).
Den tidligste mulige beskrivelsen av RA anses ofte å være Michael Psellos’ skildring (i Chronographia) fra 1063 av en kronisk, invalidiserende artrittsykdom hos keiser Konstantin IX (980-1055) som i ettertid har blitt tolket som RA. På 1600-tallet finnes flere beskrivelser av artritt i europeiske kilder, blant annet i private brev fra den flamske maleren Peter Paul Ruben (1577-1640) som i perioden 1622–1640 dokumenterte egne leddplager. Artrittforandringer i enkelte av Rubens’ malerier er tidvis tolket som RA, men denne tolkningen er omdiskutert (Scott DL, 2020).
Systematiske medisinske beskrivelser kom først på 1700- og 1800-tallet. Augustin Jacob Landre Beauvais (1772-1840) beskrev i sin doktoravhandling fra 1800 en tilstand han kalte «Goutte Asthenique Primitive» som i dag regnes som den første moderne kliniske beskrivelsen av RA hos en kvinnelig pasient (Marguerite Garnier). Sir Alfred Baring Garrod (1819-1907) postulerte i 1858 at RA var en egen sykdomsenhet, distinkt fra både artrose og urinsyregikt. RA ble offisielt anerkjent som diagnose i England i 1922 (Entezami P, 2011).
Det er foreslått at RA kan ha oppstått i Vest-Europa i løpet av middelalderen. En hypotese går ut på at sykdommen kan ha spredd seg som en infeksiøs tilstand fra prekolumbianske arkaiske indianere i Nord-Amerika, hvor symmetrisk småleddsartritt er påvist i skjelettmateriale fra bosetninger vest for Tennessee River. Disse gruppene hadde ingen kontakt med europeere før midten av 1700-tallet, noe som kan indikere senere introduksjon av RA i Europa.
Behandlingshistorien strekker seg fra tidlige og ofte lite målrettede intervensjoner til moderne immunmodulerende terapi. Årelating var en utbredt behandlingsform fra oldtiden til langt inn på 1800-tallet, mens behandlingsmetoder i Øst-Asia tradisjonelt inkluderte akupunktur, kopping, varmebehandling og soneterapi. På 1800- og tidlig 1900-tallet ble ulike tungmetallsalter, blant annet gull-, vismut- og kobbersalter samt arsenikk, prøvd ut etter mislykkede behandlingsforsøk med andre midler. Gullsalter, introdusert av Jacques Forestier i 1929, forble i bruk helt inn i 1990-årene (Myocrisin). Sulfasalazin ble utviklet på 1940-tallet og brukes fortsatt som et sentralt DMARD.
Det moderne behandlingsskiftet kom etter introduksjonen av kortison som i 1949 ble brukt med betydelig klinisk effekt av Philip Hench og Edward Kendall. Metotreksat, syntetisert på 1950-tallet og opprinnelig brukt mot leukemi, ble fra 1980-årene etablert som hjørnesteinen i RA-behandling.
En ny æra i RA-terapien startet med utviklingen av biologiske legemidler. TNF-hemmere viste effekt i en studie fra 1993 og ble tatt i bruk i Norge fra slutten av 1990-tallet (etanercept, infliksimab) (Mandal A, Medical News). Deretter har flere biologiske DMARDs og senere JAK-hemmere blitt introdusert, noe som har betydelig forbedret mulighetene for å oppnå lav sykdomsaktivitet eller remisjon (Radu A-F, 2021).

Epidemiologi
RA kan ramme personer i alle aldre, men er vanligst blant kvinner (3:1). Den mest utsatte alderen for kvinner er 30-40 år, mens menn oftere får RA i 60-80 årsalderen.
Prevalens. Den globale prevalensen av RA er ca. 0,24 % basert på data fra “The Global Burden of Disease 2010”. Forekomsten er høyest i Vest- og Nord-Europa, Nord-Amerika, Australia og New Zealand som er regioner med befolkning av europeisk avstamning. I Mellom- og Sør-Amerika er forekomsten lavere, og den er enda lavere i Øst-Asia og Afrika (Cross M, 2013).
I Norge er prevalensen av RA estimert til 0,5% (Kvien TK, 2004). Nyere danske registerdata viser litt høyere prevalens på 0,6-0,8% blant kvinner og 0,3% blant menn. Data tyder også på at forekomsten har økt med ca. 50% mellom år 2000 og 2018 (Soussi BG, 2022). En økende forekomst kan delvis skyldes et økende antall eldre personer i befolkningen (Wang J, 2024).
Insidens og livstidsrisiko. Insidensen av RA er estimert til 25-50 nye tilfeller per 100 000 per år og er høyest hos kvinner. Livstidsrisikoen for å utvikle RA er beregnet til 2,3-3,4 % for kvinner og 1,1-1,5 % for menn (Uhlig T, 2004; Soussi BG, 2022).
Etiologi og patogenese
RA er en kronisk, immunmediert inflammatorisk sykdom som oppstår gjennom et samspill mellom genetiske faktorer, miljøeksponeringer og immunologiske mekanismer. Utviklingen av RA er et trinnvis forløp der pasienten først har en predisposisjon, deretter utvikler autoimmune responser, før klinisk sykdom til slutt manifesterer seg i leddene. Sykdommen har derfor både en etiologisk fase (årsaksforhold) og en patogenetisk fase (mekanismer som driver sykdommen).
Genetiske faktorer
Genetiske forhold utgjør omtrent 50–60 % av risikoen for å utvikle RA. Den viktigste genetiske risikoen er knyttet til spesifikke HLA-DRB1-alleler, særlig de som inneholder den såkalte shared epitope-sekvensen (Chauhan K, 2021). Disse allelene øker risikoen for seropositiv RA og virker å påvirke utviklingen av ACPA-responser. Andre genvarianter, inkludert PTPN22 og STAT4, bidrar ytterligere til sykdomsrisikoen ved å påvirke antigenrespons, lymfocyttaktivering og inflammatoriske signalveier (Orozco G, 2014).
Multigenetisk. Sykdomsutvikling bestemmes ikke av ett enkelt gen, og mange av de involverte genene er også assosiert med andre autoimmune sykdommer (Scherer HU, 2020). Studier har vist at det å ha en førstegradsslektning (foreldre, søsken eller barn) med RA tredobler risikoen, mens en andregradsslektning dobler risikoen (Frisell T, 2013). Omtrent 10 % av førstegradsslektninger til personer med RA har også sykdommen.
Tvillingstudier. Arveligheten kommer tydelig frem i tvillingstudier. Konkordansen (sannsynligheten for at begge tvillinger utvikler sykdommen) hos monozygote tvillinger er 15-30%, mens den bare er 5% blant søsken og dizygote tvillinger. Denne sammenhengen er sterkest (40-65%) hos personer med antistoffer mot sykliske citrullinerte peptider antistoff (anti-CCP/ACPA), mens den er ca. 20% ved seronegativ sykdom.
X-kromosomer. Årsaken til at kvinner er mest utsatt kan skyldes tilstedeværelsen av to X-kromosomer som til sammen kan øke risikoen for autoimmune sykdommer. Denne kjønnsforskjellen utjevnes imidlertid ved debut i høyere alder.
Epigenetiske faktorer regulerer genekspresjonen uten å endre DNA-sekvensen. Disse kan være viktige koblinger mellom genetisk disposisjon og miljøfaktorer i sykdomsutviklingen (Klein J, 2015).
Miljøfaktorer
Flere miljøfaktorer kan utløse eller akselerere sykdom hos genetisk disponerte individer. De best dokumenterte er røyking og infeksjoner.
Røyking er den sterkeste enkeltstående miljøfaktoren og øker risikoen særlig for ACPA-positiv RA. Røyking induserer post-translasjonelle modifikasjoner (særlig citrullinering) i lungevev, noe som kan generere nye autoantigener og dermed trigge autoimmunitet. Røyking øker risikoen 1,4-2,2 ganger ved et forbruk på over 40 pakke-år (Costenbader KH, 2006). En hypotese er at sigarettrøyk induser oppregulering av gener som koder for enzymet peptidylarginin deiminase (PAD) i alveolære makrofager i lungene (Makrygiannakis D, 2008). PAD omdanner aminosyren arginin til citrullin og fører til dannelse av “neoantigener”. Disse neoantigenene kan utløse en immunrespons og produksjon av anti-CCP/ACPA (Derksen VFAM, 2017).
Infeksjoner. Flere mikroorganismer har vært foreslått som triggere. Mest studert er Porphyromonas gingivalis ved periodontitt (Deane KD, 2017) som både kan citrullinere proteiner og stimulere en vedvarende immunaktivering (Klareskog L, 2009; Hensvold AH, 2015; Derksen VFAM, 2017).
Andre faktorer som støv- og silika-eksponering, luftforurensning og hormonelle forhold (bl.a. postpartum-endringer) er assosiert med økt risiko. Kvinner som har født har lavere risiko for å utvikle RA enn kvinner som ikke har født (RR 0,61) (Guthrie KA, 2010; Karlson EW, 2004). Bruk av p-piller er imidlertid ikke assosiert med økt risiko for RA (Karlson EW, 2008). Siden beskrivelsen til Hench i 1938 har det vært kjent at mange med RA blir bedre i svangerskap (Hench P. 1938). Årsaken kan være fysiologisk økt immunologisk toleranse under graviditet (Kaaja RJ, JAMA. 2005). Enkelte kostmønstre og fedme er også foreslått som risikofaktorer.
Mikrobiota (tarmflora). Tarmens mikrobiota utgjør en sentral del av immunsystemet og spiller en viktig rolle for immunologisk toleranse og balanse. Redusert biologisk mangfold i tarmfloraen, såkalt dysbiose, er assosiert med flere kroniske inflammatoriske tilstander, inkludert RA (Jetwa H, 2017).
Hos personer med RA er det påvist endrede mikrobiota-profiler med økt forekomst av blant annet Actinobacteria, Collinsella, Eggerthella og Faecalibacterium. Særlig Collinsella har fått oppmerksomhet i nyere forskning fordi bakterien kan påvirke intestinal permeabilitet og modulere immunresponsen. Økte nivåer av Collinsella er foreslått å kunne bidra til høyere sykdomsaktivitet og mer alvorlig klinisk forløp.
Det pågår forskning for å avklare om målrettet manipulering av tarmfloraen kan ha terapeutisk effekt ved RA. Tiltak som probiotika, prebiotika og fekal mikrobiota-transplantasjon undersøkes som mulige strategier for å gjenopprette et mer gunstig mikrobiom og potensielt dempe sykdomsaktivitet (Chauhan K, 2023; Abebaw D, 2025).
Utvikling av autoimmunitet
Den tidlige fasen av RA kjennetegnes av en gradvis utvikling av autoimmune mekanismer, ofte flere år før symptomdebut.
Immunresponsen ved RA starter ikke primært i leddene, men i perifere vev som lunger, munnslimhinne og mage-tarmkanalen (Klareskog L, 2020). Der oppstår modifiserte proteiner som for eksempel citrullinert protein. Denne fasen er preget av produksjon av anti-CCP (ACPA), produksjon av revmafaktor (RF), økende bredde i autoantistoffer (epitope spreading) og subklinisk inflammasjon i slimhinner, spesielt i luftveier og gingiva. Disse immunologiske endringene oppstår som regel før synovial inflammasjon utvikler seg.
Synovial inflammasjon
Overgangen fra autoimmunitet til klinisk sykdom markeres av inflammasjon i synovialhinnene. Denne prosessen domineres av:
- Innvandring av immunceller. T- og B-lymfocytter, plasmaceller, makrofager og dendrittiske celler akkumulerer i synoviet og danner ofte lymfoide celleaggregater.
- Cytokin- og signalaktivering. Inflammasjonen drives av sentrale cytokiner som TNF-α, IL-1, IL-6, IL-17 og GM-CSF. Dette skaper en positiv feedback-loop som opprettholder og forsterker inflammasjonen.
- Synovial hyperplasi (pannusdannelse). Synoviale fibroblaster prolifererer med utvekster (villi) og danner et tykt, invasivt vev (pannus) som kan infiltrere og bryte ned brusk og bein (Lopez-Meijias R, 2019; Scott DL, Lancet. 2010).
Symptomer
RA kjennetegnes av en kronisk, symmetrisk polyartritt som hovedsakelig affiserer små ledd, men som også kan involvere større ledd og gi systemiske manifestasjoner. Sykdomsbildet varierer i debut, intensitet og progresjon, men følger ofte et karakteristisk mønster med inflammasjonsbetingede smerter, stivhet og funksjonstap.
Debut-symptomer og symptomer ved tidlig RA
RA kan forutgås av en prodromalfase som strekker seg over flere måneder og er preget av uspesifikke symptomer som generell sykdomsfølelse, diffuse leddsmerter og tretthet. Etter hvert utvikles et mer karakteristisk klinisk bilde som kjennetegner tidlig RA.
- Morgenstivhet: Et tidlig symptom og gjenspeiler underliggende inflammasjon i ledd, omkringliggende bløtdeler og synovialt vev. Stivheten er typisk mest uttalt om morgenen eller etter perioder med inaktivitet og varer gjerne minst én time før den gradvis gir seg. Varighet av morgenstivhet korrelerer ofte med graden av inflammatorisk aktivitet. Varigheten kan defineres ved tiden fra oppvåkning til stivheten er på sitt minst uttalte.
- Leddsmerte og artritt. I tidlig sykdomsfase er artritt vanligst i små ledd. Typisk rammes MCP-, PIP- og håndledd i hender, MTP og ankler i føttene. Sykdommen debuterer vanligvis som en ikke-erosiv synovitt i de første sykdomsukene, og destruktive forandringer forventes ikke i denne fasen. Fordelingen av de angrepne leddene er karakteristisk for sykdommen, og symmetrisk affeksjon av MCP- og PIP-leddene er et klassisk funn. Sannsynligheten for RA øker med antall involverte ledd (Wassermann AM, 2011).
- Tenosynovitt. Synovial inflammasjon affiserer ikke bare ledd, men også sener og seneskjeder. Tenosynovitt i tidlig RA kan gi synoviale hevelser over sener, smerter ved bevegelse og gradvis redusert bevegelsesutslag. Kliniske manifestasjoner inkluderer stenoserende tendovaginitt (“trigger finger”) og svekket ekstensjon i håndledd eller albue. Etter hver blir hevelse, smerte, friksjonsfenomener og redusert bevegelse tydeligere.
- Myalgi. Muskelsmerter forekommer hyppig, særlig hos eldre pasienter. RA-debut hos denne gruppen kan dermed være klinisk utfordrende å skille fra polymyalgia revmatika (PMR), spesielt ved uttalt stivhet og smerter i proksimale muskelgrupper.
- Systemiske symptomer. Mange pasienter opplever generell sykdomsfølelse og betydelig utmattet (fatigue) (“influensafølelse”), selv om dette ikke alltid er til stede. Andre systemiske manifestasjoner i tidlig fase omfatter nattesvette, lavgradig feber.
Palindrom revmatisme. Hos noen pasienter kan RA debutere som palindrom revmatisme. Dette er en type artritt med anfallsvis, selvbegrensende artritt i bl.a. håndledd og fingre. Episodene kan vare fra dager til uker før symptomene forsvinner helt. Personer med palindrom revmatisme har økt risiko for å utvikle RA, og anti-CCP-antistoffer kan ofte påvises flere år før manifest sykdom (Smolen JS, 2016).
Ledd-, muskel- og seneaffeksjon ved RA
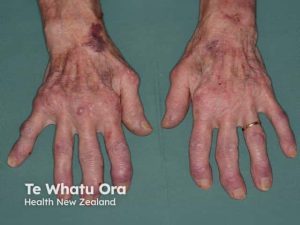
Etablert RA er kjennetegnet av vedvarende leddsmerter, kronisk synovitt og gradvis utvikling av strukturelle leddskader. Sykdommen manifesterer seg som en symmetrisk polyartritt med redusert bevegelighet i særlig MCP- og PIP-ledd i hendene, MTP-ledd i føttene samt håndledd, ankler og albuer. Også kjefteledd (TMJ) og cervicalcolumna kan affiseres, mens hofteledd som regel er spart. I columna affiseres primært de øvre cervicale segmentene.
Ved langvarig sykdom kan det utvikles karakteristiske deformiteter, som ulnar deviasjon i fingrene, svanenhalsdeformitet, boutonnière-deformitet, subluksasjoner i MCP- og MTP-ledd og prominent caput ulnae ved avansert håndleddsaffeksjon. Disse forandringene skyldes kombinasjonen av erosiv beinødeleggelse og svekkelse av leddbånd, sener og omkringliggende bløtdeler.
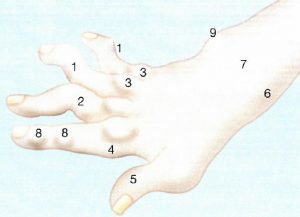
- Svanehalsdeformitet: Karakteriseres av hyperekstensjon i PIP og fleksjon i DIP
- Knapphullsdeformitet (“Boutonniere”): Defineres av hyperekstensjon i MCP, fleksjon i PIP og ekstensjon i DIP-leddet.
- Ulnar deviasjon i grunneledd (MCP): Fingrene avviker mot lillefingersiden.
- Volar subluksasjon i MCP: Leddhodet glir ut av leddskålen på håndflatens side.
- Z-konfigurasjon (“skomakertommel”, “90-90 deformitet”): Innebærer fleksjon i tommelens MCP-ledd i tommelen kombinert med ekstensjon i tommelens DIP-ledd.
- Processus styloideus radii og radial deviasjon i håndledd: Håndleddet bøyes mot tommelsiden.
- Ekstensorseneskjeder
- Revmaknuter (noduli)
- Processus styloideus ulnae
Jaccouds artritt. Ved utilstrekkelig kontrollert sykdom kan både leddkapsel og seneapparat svekkes, noe som medfører ustabilitet, feilstillinger og karakteristiske deformiteter i hender og føtter. Jaccouds artritt har et deformitetsmønster med subluksasjoner og ulnar deviasjon av fingrene. Denne skyldes ikke primært erosjon av benvev, men skade på det stabilserende seneapparatet.
Muskelatrofi og revmaknuter. Generalisert muskelatrofi er vanlig som følge av inaktivitet og kronisk inflammasjon. Revmatoide knuter (noduli) sees hos omtrent 20 % av pasientene, ofte lokalisert over trykkutsatte områder (Chauhan K, 2023). Knuter over DIP-ledd må differensieres fra Heberdens knuter ved artrose og tofi ved kronisk urinsyregikt.
Prominens av caput ulnae. Fremstående distale ende av ulna ved håndleddet er et klassisk tegn ved avansert synovitt i håndleddsregionen og kan bidra til smerte, instabilitet og funksjonstap.
Tendovaginitt og tendinopati. Senebetennelser og seneskader forekommer hyppig som følge av synovial inflammasjon i seneskjeder. Tenosynovitt bidrar til smerte, hevelse og redusert funksjon, og kan gi opphav til fenomener som “triggerfinger”.
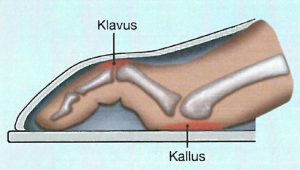
Bakers cyste (popliteal cyste). Bakers cyste ble først beskrevet av William M. Baker (1839-1896) og forekommer hos omtrent 50 % av pasienter med RA. Cysten representerer en synovial herniering eller væskefylt utposning i knehasen som følge av økt synovialvæske i kneet. Tilstanden er ofte asymptomatisk, men kan rupturere og føre til akutt inflammasjon, smerte og hevelse i leggen. Dette kan klinisk imitere dyp venetrombose (DVT), men samtidig forekomst av DVT ses hos opptil 25 %. Diagnosen stilles klinisk og bekreftes ved ultralyd; MR er sjelden nødvendig. Behandlingen retter seg mot underliggende kneleddssynovitt, og artrocentese med påfølgende intraartikulær injeksjon kan være effektivt ved aktiv artritt (Nakamura J, 2019).
.
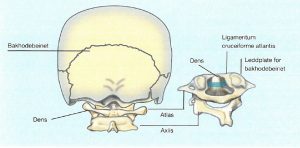
Atlantoaksial nakkeaffeksjon.
Forekomst og risikofaktorer. Artritt i atlantoaksialleddet (mellom atlas, C1, og aksis, C2) opptrer hos over 20 % av RA-pasienter allerede innen det første sykdomsåret. Risikofaktorer for progresjon inkluderer høy inflammatorisk sykdomsaktivitet, tilstedeværelse av anti-CCP-antistoffer og generell erosiv sykdomsutvikling ( (Carotti M, 2019). Omtrent halvparten av pasientene er asymptomatiske i tidlig fase.
![]()
Ved progresjon kan cervical instabilitet utvikles. Cervikal myelopati påvises hos omtrent 2,5 % av RA-pasienter etter gjennomsnittlig 14 års sykdomsvarighet. De vanligste formene for instabilitet er:
- Anterior atlantoaksial subluksasjon (ca. 75 %)
- Posterior subluksasjon mellom bakre bue av C1 og densaksen (7–20 %)
- Vertikal subluksasjon (sjeldnere)
- Subaksiale glidninger nedover i C3–C7-nivået
Kliniske manifestasjoner. Pasienter kan oppleve nakkesmerter med nevrogen utstråling til bakhodet, samt parestesier eller nummenhet i armer ved nakkebevegelser. I alvorlige tilfeller kan instabilitet føre til pareser og i ytterste konsekvens død.
Vurdering av mulig atlantoaksial instabilitet er obligatorisk før generell anestesi, da muskelrelaksering kan forverre subluksasjon og medføre akutt myelopati (Manczak M, 2017).
Ekstraartikulære manifestasjoner ved RA
Ekstraartikulære manifestasjoner er symptomer og tegn på RA som oppstår utenfor leddene. Omtrent 40 % av RA-pasienter opplever ekstraartikulære manifestasjoner i sykdomsforløpet. Disse kan oppstå både tidlig i sykdomsforløpet og sent i forløpet og indikerer ofte et behov for mer intensivert behandling (Turesson C, 2003) fordi de er assosiert med økt sykelighet og dødelighet (Giles J, 2019). Manifestasjonene kan ses på som et resultat av den systemiske inflammatoriske inflammasjonen der bl. a. cytokiner i blodet spiller en sentral rolle.
Ekstraartikulære manifestasjoner er symptomer og tegn på RA som oppstår utenfor leddapparatet. Man har estimert at omtrent 40 % av pasientene utvikler slike manifestasjoner i sykdomsforløpet, men forekomsten kan være synkende fordi stadig flere får mer effektiv sykdomsdempende behandling.
Ekstraartikulære manifestasjoner kan opptre både tidlig og sent og er ofte uttrykk for mer alvorlig og systemisk sykdom. Dette innebærer vanligvis behov for intensivering av behandlingen (Turesson C, 2003) og er assosiert med økt sykelighet og mortalitet (Giles J, 2019). Manifestasjonene kan forstås som uttrykk for den systemiske inflammatoriske responsen, der sirkulerende cytokiner spiller en sentral rolle.
Revmatiske knuter (noduli) har tradisjonelt vært den vanligste ekstraartikulære manifestasjonen, men lungemanifestasjoner er generelt mer prognostisk alvorlige.
Rutinemessige spørreskjemaer og standardiserte mål for sykdomsaktivitet fanger ikke alltid opp ekstraartikulære komplikasjoner, noe som understreker behovet for grundig klinisk undersøkelse og systematisk organrettet screening.
Hematologiske manifestasjoner
Anemi er den vanligste hematologiske manifestasjonen ved RA. Den kan skyldes gastrointestinal blødning på grunn av NSAID-bruk eller hepcidinmediert hemming av jerntransport på grunn av kronisk inflammasjon (Chen Y, 2021).
Andre hematologiske forstyrrelser er nøytropeni, eosinofili, trombocytopeni og trombocytose. Trombocytose, og mer sjelden lymfocytose og lymfadenopati kan gjenspeile systemisk inflammasjon.
Feltys syndrom er en kombinasjon av leukopeni (ofte neutropeni) og splenomegali ved seropositiv RA. Tilstanden er sjelden, men en alvorlig komplikasjon med betydelig infeksjonsrisiko (Cojocaru M, 2010; Turesson C, 2013).
RA medfører økt risiko for hjerte- og karsykdom, inkludert myokardinfarkt og slag (MACE = Major Adverse Cardiovascular Events). Dette er en viktig årsak til morbiditet og mortalitet (Roman MJ, 2007), selv om prognosen er bedret med moderne behandling (Provan SA, 2020). De kardiovaskulære manifestasjonene kan inkludere:
-Aterosklerose: Akselerert aterosklerose er sentralt i RA-assosiert kardiovaskulær risiko. Kronisk inflammasjon bidrar til endotelial dysfunksjon og plakkutvikling. Risikoen øker proporsjonalt med graden av sykdomsaktivitet (Myasedova E, 2016).
-Arteriell stivhet: Økt stivhet i arterieveggene markerer subklinisk aterosklerose og øker risikoen for kardiovaskulære hendelser.
-Koronararteriearteritt. Inflammasjon i koronararteriene forekommer, men er en sjeldnere årsak til iskemisk hjertesykdom enn aterosklerose.
-Hjertesvikt: RA pasienter har økt risiko for både systolisk og diastolisk hjertesvikt, uavhengig av koronarsykdom. Mekanismene inkluderer inflammasjon, myokardfibrose og medikamentbivirkninger.
-Klaffesykdom: Inflammasjon kan medføre fortykkelse og funksjonsforstyrrelser i hjerteklaffene.
-Perikarditt er den vanligste primære hjertemanifestasjonen ved RA (Roman MJ, 2007). Den kan være asymptomatisk eller gi stillingsavhengige brystsmerter. Perikardtamponade er en sjelden, men alvorlig komplikasjon.
-Revmatoide knuter i endokard og hjerteklaffer. Noduli i endokard og klaffer er sjeldne, men kan i enkelte tilfeller forårsake hjertesvikt (Vantrease A, 2017).
-Risiko for hjerteinfarkt. RA gir omtrent 1,5–2 ganger økt risiko for hjerteinfarkt, tilsvarende risikoen ved diabetes mellitus. Langvarig bruk av kortikosteroider i doser > 5 mg prednisolon/dag øker risikoen ytterligere (So H, 2023). Den generelle risikoen er likevel fallende, trolig som følge av bedre RA-kontroll og mer fokus på tradisjonelle risikofaktorer (Schieir O, 2017; Alsing CL, 2023).
Ved mistanke om koronar sykdom bør vurderingen inkludere tradisjonelle risikofaktorer som røking, hypertensjon, diabetes og hyperlipidemi (Semb AG, 2020). Hos pasienter med høy kardiovaskulær risiko bør JAK-hemmere brukes med forsiktighet (Aymon R, 2024).
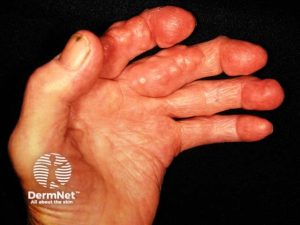
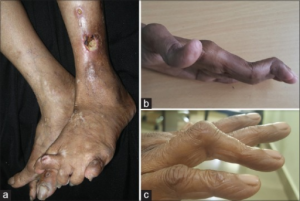
Hudmanifestasjoner ved RA varierer fra milde til alvorlige og kan gi diagnostiske og prognostiske holdepunkter (Diaz MJ, 2023).
Revmatoide knuter (noduli). Den vanligste hudmanifestasjonen (ca. 20 %). Oppstår ofte over trykkpunkter på ekstensorsider, særlig hos RF- og/eller anti-CCP-positive pasienter. Røykere og eldre er spesielt utsatt. Noduli er assosiert med mer aggressiv sykdom (Ljung L, 2024).
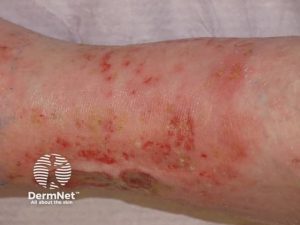
Andre hudsymptomer:
- Periungual inflammasjon: Inflammasjon i vevet rundt neglene, ofte som erythem og hevelse. En form for vaskulitt i små kar i neglefolden eller neglebåndsområdet.
- Negleforandringer. Inflammasjonen kan føre til forandringer også i selve neglen i form av striper, riller (longitudinal ridging), sprø negler eller at neglen løsner fra neglesengen (onykolyse).
- Splint blødninger er små, rød-brune flekker under neglen som ligner fliser.
- Periunguale infarkter: Små områder med nekrose rundt neglene som et tegn på en mild form for vaskulitt.
- Ulcerasjoner og digitalt gangren. Ved alvorlige sirkulasjonsforstyrrelser(Cojocaru M, 2010).
- Revmatoid vaskulitt i huden ses oftest ved langvarig og alvorlig sykdomsforløp og hos pasienter med RF/anti-CCP-antistoffer (seropositiv RA).
- Vaskulitt i små kar kan gi hudblødninger, slik som små petekkier. Ved purpura er større områder (og små-mellomstore kar) angrepet.
- Vaskulitt i større kar er uvanlig, men kan føre til mer omfattende og alvorlige vevsnekroser som krever umiddelbar medisinsk intervensjon (vennligst se også eget kapittel om iskemi).
- Ekkymoser. På grunn av den kronisk inflammasjon og ofte langvarig bruk av kortikosteroider kan huden bli skjør, tynn med subkutane blødninger.
- Neutrofile dermatoser som Sweet’s syndrom og pyoderma gangrenosum.
- Interstitiell granulomatøs dermatitt og palmart erythem kan forekomme.
Infeksjonsrisiko
RA-pasienter har økt infeksjonsrisiko grunnet immunsystemets dysfunksjon, alder, skrøpelighet og komorbiditet (diabetes mellitus, kronisk lungesykdom, alkoholisme) og immunsuppressiv behandling (Dorian MF, 2002). Risikofaktorer inkluderer høye doser kortikosteroider,tidligere infeksjoner og nyresvikt (Strangfeld A, 2011). Høy sykdomsaktivitet øker risikoen ytterligere.
Tabell: Middels-høy sykdomsaktivitet ved CDAI mer enn dobler infeksjonsraten ved RA (Accortt NA, 2018)
| CDAI (Clinical Disease Activity Index) | Alvorlige infeksjoner per 100 pasient-år |
| Remisjon | 1,03 |
| Lav sykdomsaktivitet | 1,92 |
| Middels-høy sykdomsaktivitet | 2,51 |
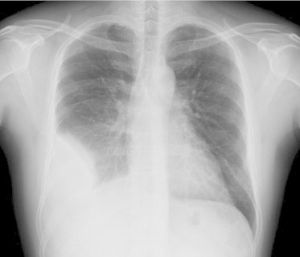
Lungesykdom (revmatoid lungesykdom)
Lungemanifestasjoner er blant de mest alvorlige ekstraartikulære komplikasjonene og kan indikere dårlig prognose. Forløpet kan være akutt eller gradvis (Kadura S, 2021).
Pleuritt og pleuravæske: Inflammasjon i pleura med pleuravæske er relativt vanlig. Den er ofte ensidig og forårsaker smerter ved respirasjon. Pleuritt kan være det første symptomet på RA eller debutere samtidig med artritt (Yokosuka T, 2013).
Interstitiell lungesykdom (ILD) Kan debutere før RA-diagnose (Hyldgaard C, 2017), men oftest senere i forløpet. Risikofaktorer inkluderer MUC5B-genvariant, høy alder, mannlig kjønn, tobakksrøyking og seropositivitet (Junge PA, 2018). Symptomer omfatter belastningsdyspné og tørrhoste. Livstidsrisiko er 7,7 % (vs. 0,9 % hos kontroller). Lungesykdommen begynner etter RA-debut hos over 80%. Eldre pasienter, menn og de med alvorlig RA er spesielt utsatt (Bongartz T, 2010; Kelly CA, 2014).
Revmaknuter (noduli) i lungene. Forekommer særlig ved aCCP-positiv, langtkommen RA. Knutene er typisk lokalisert i interlobære septa og subpleurale områder. De varierer i størrelse fra få millimeter til flere centimeter, kan rupturere og gi pleuravæske, fistel eller infeksjon. Differensialdiagnostisk kan sarkoidose, granulomatose med polyarteritt (GPA), bronkialcancer, pulmonalt lymfom, histiocytose og metastaser vurderes.
Caplans syndrom. Kombinasjon av RA og pneumokoniose (lungesykdom forårsaket av innånding av støv, f.eks. kullstøv) med karakteristiske lungenoduli. Syndromet ble beskrevet blant kullgruvearbeidere i 1953 av den britiske legen Antony Caplan (Schreiber J. 2010).
Andre Lungesykdommer:
- Bronkial hyperreaktivitet: Astma-lignende tilstand
- Follikulær bronkiolitt. HRCT viser sentrolobulære peribronkiale mikronoduli uten “honeycombing”, ofte relatert til kronisk infeksjon.
- Obliterativ bronkiolitt: Raskt progredierende og alvorlig; ofte kvinner med langvarig RA, aCCP-positive. Sulfasalazin kan være en utløsende faktor i noen tilfeller. HRCT viser sentrolobulært emfysem, bronkiektasier, bronkial veggfortykkelse og et mosaikk-mønster. Lungefunksjonstester viser obstruksjon med normal DLCO (diffusjonskapasitet for karbonmonoksid).
- Lungekreft er ingen direkte komplikasjon, men seropositiv RA øker risikoen for lungekreft med ca. 50% (Brooks RT, 2024).
Diagnostikk av Revmatoid Lungesykdom
- Anamnese: Grundig kartlegging av symptomer som belastningsdyspné, tørrhoste og ubehag i brystet.
- Klinisk undersøkelse: Inkluderer auskultasjon av lungene (krepitasjoner).
- Bildediagnostikk: Høyoppløselig CT (HRCT) av lungene for å påvise og kartlegge lungesykdom ved RA. Konvensjonell røntgen er lite sensitiv, slik at bare 5% av tilfellene oppdages ved vanlig røntgen thoraks (Ascherman DP, 2010). HRCT av lunger innebærer lavere radiologisk stråling enn konvensjonell CT og bør benyttes for å kartlegge lunge-manifestasjoner hos pasienter med risikofaktorer (f.eks. aCCP-positivitet) og ved symptomer (Hyldgaard C, 2023). Vanlige mønstre på HRCT inkluderer (Kelly C, 2016):
- Usal interstital pneumonia (UIP): Vanligere og har generelt dårligere prognose.
- Nonspecific interstitial pneumonia (NSIP): Generelt bedre prognose enn UIP (Yunt ZX, 2017).
- Organized/organiserende pneumonia (OP): Sjeldnere.
| RA-ILD med fordeling av radiologiske kjennetegn (Kelly CA, 2014) | ||
| Subtype | % | Mønster |
| Usual interstitiell pneumoni (UIP) | 66% | Fibrose og bikake-mønster (honeycombing) |
| Non-spesifikk interstitiell pneumoni (NSIP) | 24% | Mattglass som tegn på variabel alveolitt |
| Kryptogen organiserende pneumoni (COP) | 4% | Multifokale perifere fortetninger |
| Overlapp syndromer | 6% | Blandet |
- Lungefunksjonstester: Flere målinger over tid er viktig for å vurdere progresjon.
- 6-minutters gangtest: For å vurdere funksjonell kapasitet.
- Lungelegevurdering: Spesialistvurdering er ofte nødvendig.
Ubehandlet er det risiko for at inflammatoriske, interstitielle lungemanifestasjoner progredierer og danner irreversibel fibrose med lungesvikt på sikt (Atzeni F, 2014).
Medikamentrelatert lungesykdom. Skilles fra primær RA-ILD, men kan være klinisk lik. Hypersensitivitetspneumonitt utløst av metotreksat og leflunomid er mest kjent, men sjelden (Fragoulis GE, 2019; Dawson JK, 2021). TNF-hemmere og leflunomid kan en sjelden gang forverre ILD, særlig ved preeksisterende lungesykdom (Holroyd CR, 2019).
-Symptomer på metotreksat-pneumonitt
- Oftest innen første året fra behandlingsstart
- Lav feber hos 90%
- Ny hoste (akutt/subakutt)
- Dyspne
- Lungeforandringene går tilbake etter seponering av medikasjonen hos omtrent 50%.
Behandling og monitorering av revmatoid lungesykdom
Behandling av revmatoid lungesykdom ved RA retter seg mot å dempe inflammasjon og bremse fibroseutvikling gjennom immunsuppressiva i form av csDMARDs (som mykofenolat, azathioprin, eller cyklofosfamid) og rituksimab, eventuelt andre biologiske legemidler eller JAK-hemmere. En kan i noen tilfeller supplere med nøye vurdert metotreksatbruk og antifibrotisk terapi som nintedanib. Behandlingen følges med regelmessig monitorering av lungefunksjon og billeddiagnostikk.
Tabell: Behandling og monitorering av lungemanifestasjoner ved revmatoid artritt
| Tiltak / Medikamentgruppe | Eksempler | Indikasjoner / Kommentarer | Referanser |
|---|---|---|---|
| Immunsuppressiva (førstelinje eller ved progresjon) | Mykofenolat, azathioprin, rituksimab | Anbefalt ved inflammatoriske RA-lungemanifestasjoner som RA-ILD. Rituksimab har dokumentert effekt på stabilisering/progresjonsbremsing. | (Mena-Vazqueres N, 2022) |
| Cyklofosfamid | Brukes ved alvorlig eller raskt progredierende lungesykdom. Kombineres med kortikosteroider. | (Mena-Vazqueres N, 2022) | |
| Tocilizumab | Alternativ ved utilstrekkelig effekt av andre immunsuppressiva. Kan stabilisere sykdomsforløpet. | Johnson SR, 2024 | |
| Abatacept | Kan gi stabilisering av RA-ILD hos enkelte. | Tardella M, 2022 | |
| JAK-hemmere | Kan vurderes ved inflammatoriske lungemanifestasjoner der annen terapi ikke har tilstrekkelig effekt. | Tardella M, 2022 | |
| Metotreksat (MTX) | MTX | Tradisjonelt omdiskutert pga. risiko for MTX-indusert pneumonitt, men nyere studier viser forbedret prognose og overlevelse ved RA-ILD. Bør brukes med nøye vurdering og dokumentert indikasjon. | Kiely P, 2019; Rojas-Serrano J, 2017 |
| Antifibrotisk behandling | Nintedanib (Ofev) | Reduserer progresjon av fibrose ved RA-ILD, men stopper ikke utviklingen. Anbefales ved fibrotisk fenotype, særlig UIP-mønster. | Matteson EL, 2022 |
| Kortikosteroider | Prednisolon (varierende doser) | Brukes alene ved milde inflammatoriske manifestasjoner eller i kombinasjon med immunsuppressiva ved moderat–alvorlig sykdom. | Klinisk praksis / inngår i flere behandlingsstudier |
| Monitorering | Lungefunksjonstester (spirometri, DLCO), HRCT ved indikasjon | Oppfølging individualiseres. Ved forverring: hver 3. måned. Stabil sykdom: årlig lungefunksjon, klinisk vurdering og HRCT ved symptomendring. | Klinisk konsensus / praksis |
Muskler
RA affiserer primært leddene, men kan også påvirke musklene, ofte som en konsekvens av artritt, den generelle inflammatoriske prosessen og inaktivitet.
- Myalgi: Muskelsmerter er vanlig ved RA.
- Muskelatrofi: Redusert muskelmasse, ofte relatert til inaktivitet, kronisk inflammasjon, medisinbruk og inaktivitet (f.eks. kortikosteroider).
- Myositt: Sjelden, men ekte muskelbetennelse kan forekomme ved RA, selv om den er mer typisk for andre autoimmune sykdommer som polymyositt.
- Fibromyalgi kan påvises hos ca. 20 % med RA (mot ca. 2% i den generelle befolkningen. Årsaken kan være at grunnsykdommen (RA) virker sensitiviserende (Minhas D, 2023).
Nervesystemet
RA kan også affisere nervesystemet, primært det perifere, men i sjeldne tilfeller også sentralnervesystemet (CNS). Nevrologiske manifestasjoner skyldes oftest mekanisk kompresjon sekundært til inflammasjon i ledd, sener og bløtvev, men kan også oppstå som direkte konsekvens av vaskulitt eller autoimmune mekanismer.
Noen pasienter med RA utvikler perifer nevropati i armer og ben. Tilstanden kan gi parestesier, smerter, sensoriske forstyrrelser og muskelsvakhet i affiserte områder. Nevropatien oppstår ofte som følge av nervekompresjon, men kan også skyldes vaskulitt eller kronisk inflammasjon.
-KarpaItunnelsyndrom. Dette er den hyppigste formen for nevropati ved RA. Kompresjon av nervus medianus i karpaltunnelen kan gi smerte, nummenhet og parestesier i tommel, pekefinger, langfinger og deler av ringfingeren. Ødem, synovitt og tenosynovitt i håndleddet bidrar til økt trykk i tunnelen.
-Flere andre nerver kan rammes av kompresjon ved RA:
- Nervus medianus (pronator teres syndrom): Kompresjon proksimalt i underarmen, mellom hodene i pronator teres, kan gi smerter og parestesier i medianus innervasjonsområde.
- Nervus tibialis (tarsal tunnel syndrom): Kompresjon bak den mediale malleolen kan føre til smerter og sensoriske forstyrrelser i tær, hæl og fotsåle.
- Nervus ulnaris (cubitaltunnelsyndrom). Vanlig kompresjonsnevropati i albueområdet ved sulcus nervi ulnaris. Dette gir nummenhet i lillefinger og ulnare del av ringfingeren, samt redusert håndstyrke og håndkoordinasjon.
Klinisk skilles perifer nevropati fra cervikal myelopati assosiert med RA-affeksjon i nakkevirvler (se eget avsnitt om dette) (Nadkar MY, 2001).
Sentralnervesystemet (CNS). Sentralnervesystemet (hjerne og ryggmarg) påvirkes i sjeldne tilfeller, men kan være alvorlig. Disse omfatter:
- CNS-vaskulitt: Inflammasjon i cerebrale eller spinalvaskulære strukturer, ofte som ledd i systemisk vaskulitt.
- RA-noduli i hjernen: Sjeldne revmatiske knuter i hjernevevet som kan gi fokale nevrologiske utfall.
- Meningitt: Inflammasjon i meningene, som kan være aseptisk eller relatert til vaskulitt.
- Demyeliniserende sykdom: Skade på myelinskjeder, der en mulig assosiasjon til bruk av TNF-α-hemmere fortsatt diskuteres (Atzeni F, 2018).
RA og Alzheimers sykdom. Epidemiologiske studier tyder på en redusert forekomst av Alzheimers sykdom hos pasienter med RA. Mekanismene er uklare, men mulige forklaringer inkluderer effekten av NSAIDs, DMARDs eller TNF-α-hemmere (Policcchio S, 2017). Det er også foreslått en sammenheng med nivåer av proinflammatoriske cytokiner og GM-CSF i cerebrospinalvæsken som kan påvirke nevrodegenerative prosesser. Dersom denne sammenhengen bekreftes, kan den åpne for nye terapeutiske tilnærminger ved Alzheimers sykdom (Taipa R, 2019).
Psykisk
Hos mange kan de kroniske symptomene føre til depresjon (Matchham F, 2013).
Psykiske manifestasjoner
Kroniske smerter, funksjonsnedsettelse og langvarig betennelsesaktivitet gjør at mange pasienter med RA utvikler psykiske plager, særlig depresjon (Matchham F, 2013).
Forekomst. Metaanalyser anslår prevalensen av depresjon ved RA til 16,8%, mens studier basert på selvrapporteringsverktøy viser betydelig høyere forekomst: 38,8% ved bruk av PHQ-9 og 34,2% ved HADS. Dette innebærer at depresjon forekommer klart hyppigere hos RA-pasienter enn i den generelle befolkningen.
Klinisk betydning. Depresjon kan ha en negativ innvirkning på sykdomsforløpet ved å forsterke smerteopplevelse, øke graden av utmattelse (fatigue) og ytterligere redusere fysisk funksjon. Samlet kan dette bidra til en ond sirkel med økt sykdomsbyrde og lavere livskvalitet (Matchham F, 2013).
Nyremanifestasjoner
Primær nyreaffeksjon som direkte følge av RA er sjelden. Likevel kan nyrene påvirkes gjennom flere mekanismer, der både legemiddelbruk, vaskulitt og sekundær amyloidose er viktige årsaker:
–Medikamentutløst nyrepåvikning. Bivirkninger av RA-behandling er den hyppigste årsaken til nedsatt nyrefunksjon hos RA-pasienter. NSAIDs kan redusere produksjonen av prostaglandiner og dermed svekke nyregjennomblødningen, noe som øker risikoen for akutt og kronisk nyreskade. Enkelte DMARDs, som ciclosporin, kan gi direkte nefrotoksisitet. I tillegg kan redusert nyrefunksjon medføre toksiske nivåer av legemidler som metotreksat og JAK-hemmere, ettersom disse elimineres renalt (Tyczynska KM, 2024).
-Vaskulitt. Systemisk vaskulitt assosiert med RA er sjelden, men er en alvorlig form for nyreaffeksjon. Inflammasjon i små og mellomstore blodkar kan gi direkte skade på nyrevevet og rask utvikling av nyresvikt dersom tilstanden ikke behandles (Nadkar MY, 2001).
-Nyreamyloidose (sekundær AA-amyloidose) har blitt mindre vanlig i takt med mer effektiv RA-behandling, men kan fortsatt forekomme ved langvarig og utilstrekkelig kontrollert sykdom (Shinichi IADA, 2002). Tilstanden skyldes avleiring av serumamyloid A (SAA) i ulike organer, inkludert nyrene, der amyloid akkumuleres i glomeruli og fører til proteinuri, progredierende nyreskade og i mange tilfeller nyresvikt.
Skjelettaffeksjon
RA kan påvirke skjelettet både lokalt og systemisk gjennom inflammatoriske mekanismer, redusert aktivitet og bivirkninger av behandlingen. De viktigste manifestasjonene omfatter osteoporose, periartikulær osteopeni og aseptisk bennekrose.
- Osteoporose. RA er en etablert risikofaktor for utvikling av systemisk osteoporose. Kronisk inflammasjon medfører økt produksjon av proinflammatoriske cytokiner som stimulerer osteoklastaktivitet og hemmer osteoblaster, noe som gir økt benresorpsjon og redusert benoppbygging. Fysisk inaktivitet som følge av smerte og funksjonstap bidrar ytterligere til bentap. I tillegg øker bruk av kortikosteroider risikoen for osteoporose gjennom både direkte og indirekte effekter på benmetabolismen.
- Periartikulær osteopeni/osteoporose: Redusert bentetthet i området rundt inflammerte ledd er en tidlig og karakteristisk manifestasjon ved RA. Periartikulær osteopeni oppstår som følge av lokal inflammasjon, økt osteoklastaktivitet og redusert mekanisk belastning på det affiserte leddet. Denne prosessen kan være et av de første radiologiske tegnene på sykdommen.
- Aseptisk bennekrose (osteonekrose) er en alvorlig komplikasjon som kan forekomme ved RA. Tilstanden skyldes manglende blodtilførsel til benvev og ses hyppigst i hofter og skuldre. Osteonekrose kan være relatert til selve sykdomsprosessen, men forekommer også i sammenheng med bruk av kortikosteroider som er en kjent risikofaktor for vaskulær skade og påvirket skjelettperfusjon.
RA kan affisere flere strukturer i øyet, og manifestasjonene varierer fra milde og reversibile tilstander til alvorlige, synstruende komplikasjoner. Oftalmologisk vurdering er derfor viktig ved både akutte og kroniske øyesymptomer.
- Tørre øyne (keratoconjunctivitis sicca, xeroftalmi) er den vanligste øyemanifestasjonen ved RA og forekommer hos ca. 16% av pasientene (Tuck MA, 2016). Tilstanden er ofte uttrykk for sekundært Sjøgrens syndrom og skyldes redusert tåreproduksjon som følge av autoimmun affeksjon av tårekjertlene. Ubehandlet kan tørre øyne gi epiteldefekter, økt risiko for hornhinneinfeksjoner og i alvorlige tilfeller irreversible skader på kornea.
- Skleritt. Dette er en alvorlig og potensielt synstruende komplikasjon. Tilstanden gir betydelige smerter, lysskyhet, uttalt rødhet og redusert visus. Forekomsten er lav (0,25–2 % ved RA), men skleritt korrelerer ofte med høy sykdomsaktivitet og forekomst av anti-CCP-antistoffer. Den er blitt enda sjeldnere etter innføring av biologiske DMARDs (bDMARDS) (Vergouwen DPC, 2023; Promelle V, 2021). Kronisk eller utilstrekkelig behandlet skleritt kan føre til at sklera blir tynn og perforerer (skleromalacia perforans) med betydelig synstap på sikt.
- Episkleritt er en mildere, overfladisk inflammasjon i vevet mellom konjunktiva og sklera og forekommer hos anslagsvis 3–11 % av RA-pasienter. Tilstanden gir rødhet og lett ubehag, men er vanligvis ikke smertefull og gir sjelden synspåvirkning. Episkleritt er ofte selvbegrensende, men enkelte pasienter kan ha behov for lokal anti-inflammatorisk behandling.
- Keratitt kan forekomme som følge av uttalt xeroftalmi, men kan også være uttrykk for vaskulitt eller annen RA-relatert inflammatorisk aktivitet (Giles JT, 2019). Symptomene omfatter smerte, lysskyhet, tåreflod og nedsatt syn. Keratitt krever rask vurdering og behandling for å hindre hornhinneskade og infeksjonskomplikasjoner.
Utredning
Utredningen av RA omfatter en systematisk vurdering basert på anamnese, klinisk-, laboratorie- og bildediagnostiskk. Biopsi er sjelden nødvendig for diagnostisk avklaring.
EULAR (European Alliance of Associations for Rheumatology) anbefaler at alle pasienter med artritt får revmatologisk vurdering innen seks uker, og at DMARD-behandling startes innen seks måneder ved bekreftet RA (Combe B, 2016).
Anamnese. Diagnosen RA bygger på en målrettet anamnese med vurdering av typiske leddsymptomer, varighet, forløp, funksjonstap, samt kartlegging av risikofaktorer som arv, røyking og miljøeksponering. Det henvises til eget kapittel om målrettet anamnese for ytterligere detaljer.
Klinisk undersøkelse. Den kliniske vurderingen omfatter inspeksjon og palpasjon av perifere ledd, identifikasjon av synovitt, tegn på ekstraartikulære manifestasjoner og vurdering av mulige differensialdiagnoser. Hos pasienter med nyoppdaget RA bør det registreres variabler som inngår i standardiserte sykdomsaktivitetsmål, da dette gir et viktig grunnlag for strukturert oppfølging.
Artritt kan klassifiseres som monoartritt (ett ledd), oligoartritt (2–4 ledd) eller polyartritt (≥5 ledd). Ved etablert RA foreligger oftest polyartritt. For mer utfyllende beskrivelse av disse artritt-formene vises det til eget kapittel om artritt-diagnoser.
Laboratorieprøver
Ved utredning av revmatoid artritt tas en standardisert laboratoriepakke som inkluderer akuttfasereaktanter (CRP, evt. SR), celletellinger (hemoglobin, leukocytter med differensialtelling, trombocytter), lever- og nyrefunksjonsprøver (ALP, ALAT, albumin, kreatinin), samt urinsyre, thyreoideaprøver, IgG og serum-elektroforese. I tillegg vurderes immunologiske tester (anti-CCP, RF, ANA), infeksjonsserologi (hepatitt B/C, IGRA, HIV ved risikoadferd) og urin-stiks for protein og blod som del av utredningen.
Anti-CCP antistoffer og revmatoide faktorer (RF):
Anti-CCP
- Anti-CCP (første- og annengenerasjons) kan påvises hos 50-60% av pasienter med tidlig RA (3-6 måneders sykdom) og har høy spesifisitet (95-98%).
- Anti-CCP kan foreligge flere år før sykdomsdebut (pre-klinisk fase) og ved palindrom revmatisme som disponerer for revmatoid artritt (Hensvold AH, 2015). Nye pasienter med denne kombinasjonen bør vurderes av revmatolog helst innen 2-4 uker, spesielt ved også forhøyet CRP.
- Revmatoide faktorer (RF) er ofte positive sammen med anti-CCP, men har en underordnet betydning. Sensitiviteten stiger til 70% hos pasienter med etablert RA.
- Selv om anti-CCP har høy spesifisitet for RA, kan antistoffet også påvises hos enkelte med SLE (RA/SLE=”Rhupus”), Sjøgrens eller psoriasisartritt. Disse har da ofte erosive, RA-lignende leddforandringer. Anti-CCP ses også ved aktiv tuberkulose.
- Ved tidlig RA utvikler pasienter med anti-CCP oftere radiografisk progresjon enn CCP-negative. Høye verdier av serum IgA RF og a-CCP er assosiert med høy sykdomsaktivitet, ledd-destruksjon og forekomst av ekstra-artikulære komplikasjoner.
- Når RF er positiv og anti-CCP er negativ, kan det indikere mulighet for andre revmatiske sykdommer som Sjögrens syndrom, SLE eller MCTD. RF kan også være tilstede ved en rekke infeksjoner (f.eks. kronisk hepatitt) eller hos eldre friske personer.
Jansen LM, van Schaardenburg D, 2003
Revmatoide Faktorer (RF) er autoantistoffer rettet mot kroppens egne IgG-antistoffer og påvises hos 80-90 % av pasienter med erosiv RA.
- RF kan være av IgM, IgG eller IgA type. RF produseres lokalt i leddvæske og er assosiert med ekstraartikulære manifestasjoner.
- De kan også produseres ved ulike infeksjoner, leversykdommer, sarkoidose m.m. og hos 1-5% blant friske personer. Særlig eldre har RF i lave titere. Høye titer defineres som 2-3 ganger over øvre referanseområde. Data tyder på at seronegativ RA (RF-) har bedre prognose enn seropositiv RA (RF+) som i større grad assosieres med ekstra-artikulære manifestasjoner i lunger, hud og RA-vaskulitt (Derksen VFAM, 2017).
Anti-nukleære antistoffer: ANA (vanligvis uten subgrupper) påvises hos 25% ved RA.
- ANA er uten spesiell betydning dersom det ikke også foreligger symptomer på systemisk bindevevssykdom. Høy ANA (ofte med subgrupper) ses ved overlapp mot systemisk lupus (“Rhupus”) eller ved myositt (Pipili C, 2009).
Tabell. Laboratorieprøver ved utredning av RA:
🔴 Rødt = prøver som forventes å være patologiske ved RA
🔵 Blått = prøver tatt for differensialdiagnostiske årsaker eller ekstraartikulære manifestasjoner
🟢 Grønt = prøver som kan være av prognostisk betydning
| Prøve/undersøkelse | Type | Forventet funn ved RA | Klinisk betydning/Tolkning | Referanser | Fargekode |
|---|---|---|---|---|---|
| CRP | Akuttfase | ↑ | Marker inflammasjon, predikerer erosiv sykdom, følger behandlingsrespons | Jonsson MK, 2017 | 🔴 |
| SR | Akuttfase | ↑ | Kombinasjon med CRP styrker vurdering av inflammasjon og sykdomsaktivitet | Jonsson MK, 2017 | 🔴 |
| Calprotectin | Akuttfase | ↑ | Korrelasjon med sykdomsaktivitet og radiologisk progresjon | Jonsson MK, 2017 | 🔴 |
| Hemoglobin (Hb) | Celletelling | ↓ ved inflammasjonsanemi | Hepcidin-indusert jernmetabolisme, redusert EPO | – | 🔴 |
| Leukocytter/differensial | Celletelling | Normal–↑, neutropeni ved Feltys/LGL | Infeksjonsrisiko, residiv eller medikamentbivirkning | Gazitt T, 2017 | 🔴 |
| Trombocytter | Celletelling | ↑ ved aktiv RA | Markerer inflammasjon, sykdomsaktivitet | Farr M, 1983 | 🔴 |
| ALAT, ASAT | Lever | ↑ ved myositt eller leversykdom | Viktig før DMARD; ASAT ↑ → vurder CK | Craig E, 2017 | 🔵 |
| ALP, g-GT | Lever | ↑ ved cholestase | Vurder leverfunksjon før csDMARD/biologisk behandling | Craig E, 2017 | 🔵 |
| Albumin | Lever/nyre | ↓ ved inflammasjon eller proteinuri | Del av akuttfase-respons; lavt albumin → nyreskade | Kapoor T, 2018 | 🔵 |
| Kreatinin, eGFR | Nyre | Normal ved frisk nyrefunksjon | Viktig før DMARD/JAK-hemmere; ↓ nyrefunksjon → toksisitet | Kapoor T, 2018 | 🔵 |
| Urin-stiks (protein/blod) | Nyre | Protein/hematuri ved glomerulonefritt/amyloidose | Ekstraartikulære manifestasjoner med nyrepåvirkning | Kapoor T, 2018 | 🔵 |
| Urat (urinsyre) | Differensialdiagnose | Normalt eller ↑ ved urinsyregikt | Differensialdiagnose til RA | – | 🔵 |
| CK (kreatin-kinase) | Differensialdiagnose | ↑ ved myositt | Artritt-overlapp eller muskelsymptomer | – | 🔵 |
| IgG, elektroforese | Differensialdiagnose | Normal | Utelukke blodsykdommer/immunsvikt | – | 🔵 |
| fT4, TSH | Differensialdiagnose | Normalt | Screening for tyreoideasykdom | – | 🔵 |
| Anti-CCP | Immunologi | Positiv hos 50–60% tidlig RA | Høy spesifisitet (95–98%), predikerer erosiv sykdom og radiografisk progresjon | Hensvold AH, 2015 | 🟢 |
| RF (IgM/IgG/IgA) | Immunologi | Positiv hos 70–90% ved etablert RA | Seropositiv RA → høyere risiko for ekstraartikulære manifestasjoner | Jansen LM, van Schaardenburg D, 2003; Derksen VFAM, 2017 | 🟢 |
| ANA | Immunologi | Positiv hos 25% RA | Overlapp med SLE/myositt vurderes ved høy ANA | Pipili C, 2009 | 🔵 |
| Hepatitt B/C antistoffer | Infeksjon | Negativ | Obligatorisk før immunsuppressiv behandling | – | 🔵 |
| IGRA (tuberkulose) | Infeksjon | Negativ | Obligatorisk før immunsuppressiv behandling | – | 🔵 |
| HIV-test | Infeksjon | Negativ | Vurderes ved risikoadferd før immunsuppressiv behandling | – |
Bildediagnostikk
Ultralyd, CT og MR er etablerte metoder i diagnostikken av RA. De har langt høyere presisjon enn konvensjonelle røntgenbilder som brukes mindre enn tidligere (Aletaha D, 2010).
-Røntgen: Konvensjonelle røntgenbilder av begge hender og føtter kan imidlertid brukes for å vurdere eventuelle skjelett- og leddskader og kan gi et sammenligningsgrunnlag for å følge sykdomsutviklingen fremover. Røntgen av ledd kan typisk vise tegn på RA i form av leddnær osteoporose, avsmalning av leddspalten (tyder på brusksvinn) og erosjoner. Disse forandringene kan imidlertid være vanskelige (eller umulig) å oppdage på røntgen tidlig i sykdomsforløpet. Røntgen thoraks kan utelukke åpenbar lungesykdom (HRCT er mer sensitiv og spesifikk), mens røntgenbilder av cervicalcolumna i fleksjon og ekstensjon kan brukes til å undersøke for tegn på artritt og instabilitet i nakken.
Larsens røntgengradering er en skala som brukes til å klassifisere alvorlighetsgraden av leddskade ved RA og baseres på røntgenbilder (Larsen A, 1995):
- Grad 0: Normalt ledd
- Grad 1: Bløtdelshevelse / osteoporose / avsmalning
- Grad 2: En eller to erosjoner
- Grad 3: Flere erosjoner, leddspaltereduksjon
- Grad 4: Store erosjoner, leddspalten er nesten borte
- Grad 5: Totalt destruert ledd
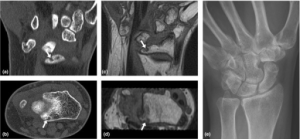
-CT-undersøkelser: CT viser i prinsippet de samme forandringene som røntgen, men gir mer detaljerte bilder og er mer spesifikt (se illustrasjon ovenfor). Ulemper med CT er at de bruker relativt mye ioniserende stråling som kan skade DNA i cellene. Spesielt hos barn og unge er man tilbakeholdende, og CT unngås hos gravide. I tillegg fremstilles ikke bløtvev like godt som på MR og ultralyd (Døhn UF, 2007).
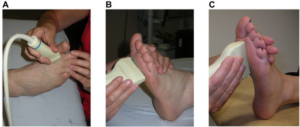
–Ultralyd-undersøkelser: Med ultralyd kan man tidlig i forløpet påvise tegn på RA. Artritt kan vises som væskeansamling i leddet (hydrops) og inflammasjonstegn i leddhinnen (synovitt), samt små erosjoner i benvev og brusk (Wakefield RJ, 2000). Ultralyd er dermed et nyttig verktøy i utredningen. Undersøkelsen er imidlertid tidkrevende, noe som begrenser nytten for rutinemessig oppfølging av pasienter med kjent diagnose (Haavardsholm EA, 2016; Hammer HB, 2012). Vennligst les om ultralydundersøkelse også i eget kapittel.
| Ultralydundersøkelse av perifere ledd Ultralyd metode og atlas ved RA (Hammer HB 2011). | |
| Ledd | Proben og leddenes posisjon |
| MCP 1-5 | Dorsal, longitudinal. Hånden hviler på et lite bord. Fingrene er ekstendert. |
| Håndledd, radio-carpale og intercarpale ledd | Dorsal, longitudinal på nivå med lunatum capitatum. |
| Håndledd, radio-ulnart | Dorsal, longitudinal på nivå med distale ulna. Hånden hviler på et lite bord. |
| Albue | Anterior, longitudinal på nivå med distale humerus og proksimal radius. |
| Kne | Anterior, longitudinal og lateral longitudinal av suprapatellar recess og den laterale recess. Pasienten hviler på benk med aktiv ekstendert kne. |
| Ankel | Anterior, longitudinal over midtre del av leddet. Pasienten hviler med kneet flektert ca. 90 grader og foten hviler på benk. |
| MTP 1-5 | Dorsal longitudinalt. Pasienten hviler med kne flektert ca. 90 grader og foten hviler på benken. |
-MR-undersøkelser: MR gir relativt detaljerte bilder av alle deler av leddene og omkringliggende strukturer (leddkapsel, synovialhinne, brusk, ligamenter, sener, bursa, fettputer, nerver og blodårer). Undersøkelsen er spesielt nyttig for å vurdere inflammasjon og strukturell leddskade. MR gir informasjon for diagnostisering, prognostisk vurdering og monitorering av behandlingsrespons.
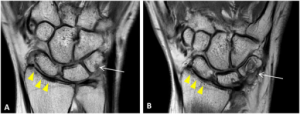
Studier har vist at MR kan identifisere pasienter med høy risiko for erosiv sykdom. Funn som erosjoner, synovitt og benmargsødem på MR predikterer senere leddskader (Haavardsholm et al, ARD 2008 Hetland et al, ARD 2009). MR kan også brukes til å vurdere om ryggmargen og hjernestammen er påvirket ved RA. Supplerende CT er imidlertid nødvendig før eventuell kirurgisk intervensjon (Manczak M, 2017).
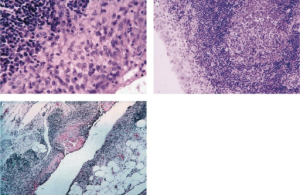
Biopsi
Selv om biopsi sjelden er nødvendig for å diagnostisere RA, kan den i noen tilfeller bekrefte diagnosen eller utelukke andre tilstander. En synovialbiopsi kan gi informasjon om patogenesen ved RA. Allerede tidlig i sykdomsforløpet kan man påvise inflammatoriske celler i synovialmembranen. Histologisk kjennetegnes RA av økt antall monocytter og en fortykkelse av synovialhinnen med villøse utvekster (synovitt) som vokser inn mot leddhulen.
Vaskulitt i små kar kan påvises i revmatiske knuter (noduli) hos noen pasienter med RA. Biopsi av en slik knute kan vise tegn på vaskulitt og kronisk granulomatøs betennelse.
Diagnose og klassifikasjonskriterier
Diagnosen RA stilles vanligvis når følgende fire punkter foreligger:
- Inflammatorisk artritt i tre eller flere ledd
- Positiv anti-CCP
- Forhøyet CRP
- Ikke funn forenelig med psoriasisartritt, viral polyartritt, krystallartitt eller systemisk lupus (SLE) (se også differensialdiagnoser nedenfor)
Mange bruker også klassifikasjonskriteriene for å diagnostisere i klinisk hverdag, hvorav 2010 ACR/EULAR kriteriene er mest aktuelle (se nedenfor).
ACR/EULAR 2010 kriterier
Forutsetning for bruk av kriteriene er minst ett sikkert artritt-ledd som ikke kan forklares ut i fra annen sykdom. Sum-score på minst 6/10 er nødvendig for klassifisering av RA
| A. Ledd-affeksjon | Score |
| -Ett stort ledd (skulder, albue, hofte, kne, ankel) | 0 |
| -2-10 store ledd | 1 |
| -1-3 små ledd (med eller uten affeksjon også av store ledd) | 2 |
| -4-10 små ledd (med eller uten affeksjon også av store ledd) | 3 |
| -mer enn 10 ledd (minst ett lite ledd) | 5 |
| B. Serologi (minst ett test-resultat: med lavt menes: ≤ 3 x øvre ref. område. Høyt > 3x referanseområdets øvre grense
-Negativ RF og negativ ACPA/anti-CCP |
0 |
| -Lav-positiv RF eller lav ACPA/CCP | 2 |
| -Høy-positiv RF eller ACPA/CCP | 3 |
| C. Akutt-fase reaktanter (minst en positiv test) | |
| -Normal CRP og SR | 0 |
| Unormal CRP eller SR | 1 |
| D. Varighet av symptomer | |
| -mindre enn 6 uker | 0 |
| -Mer enn 6 uker | 1 |
ACR 1988 (American College of Rheumatology). Krever minst 4 av følgende:
- Morgenstivhet minst en time
- Artritt i minst tre ledd observert av lege
- Artritt i håndledd, MCP eller PIP
- Symmetrisk artritt i håndledd, MCP, PIP el. MTP
- Revmatoide knuter
- Forandringer i håndledd eller fingre
- Revmatoide faktorer
Punktene 1-4 skal ha en varighet på minst 6 uker
Ulike typer RA
Ulike typer revmatoid artritt omfatter preklinisk RA før klinisk artritt oppstår, tidlig og veldig tidlig RA hvor tidlig behandling er avgjørende, seropositiv og seronegativ RA med ulik serologi men potensielt lik sykdomsbyrde, samt spesielle varianter som non-erosiv RA, senil RA (LORA) og den sjeldne, aggressive systemiske/maligne formen.
Tabell. Sammenligning av ulike RA-typer
| Type RA | Definisjon / karakteristikk | Typiske funn | Diagnostiske utfordringer / merknader | Referanser |
|---|---|---|---|---|
| Preklinisk RA | Tidlig fase før klinisk artritt; ofte anti-CCP positive eller genetisk disponert. | Leddsmerter uten objektiv artritt; ev. MR-funn på subklinisk artritt eller forhøyet CRP. | Avgrensning mot tidlig RA kan være vanskelig. | Frazzei G, 2022 |
| Tidlig RA | Artritt i tidlig fase; vanlig definisjon <6 måneder, men varierer. | Smerte, stivhet, hevelse i flere ledd; ofte symmetrisk affeksjon av MCP, PIP, MTP. | Ufullstendig sykdomsbilde gir diagnostisk usikkerhet; klassifikasjonskriterier mindre sensitive. DD: infeksiøs artritt, reaktiv artritt, andre spondyloartritter, krystallartritt eller systemiske bindevevssykdommer | Singh JA, 2012; Radu R-F, 2021; Mjaavatten MD, 2013; Mil A, 2006. |
| Veldig tidlig artritt | <12 uker fra første symptom. | Kan ha erosjoner allerede i denne fasen. | Viktig for tidlig behandling («Window of Opportunity»). | Bosello S, 2010 |
| Tidlig RA – norsk studie | Definert som <2 år + RF/anti-CCP/CRP. | Inflammatoriske leddsymptomer; positiv serologi eller forhøyet CRP. | Bredere definisjon enn vanlig; brukes i enkelte kohorter. | Hetland LM, 2020 |
| Seropositiv RA | RF og/eller anti-CCP positiv. | Ofte mer aggressiv sykdom og større erosjonstendens (tradisjonelt). | Behandlingsbehovet likt med seronegativ i nyere studier. | Norberg LG, 2018 |
| Seronegativ RA | RF og anti-CCP negativ. | Kan utvikle erosjoner og funksjonstap som seropositiv RA. | Krever eksklusjon av flere differensialdiagnoser; diagnostiske kriterier fra Gran & Husby. | Boer AC, 2018; Gran & Husby J Rheumatol 1987 |
| Non-erosiv RA | RA uten erosjoner etter flere års sykdom. | Manglende strukturelle skader. | Reell RA-diagnose kan være usikker; differensialdiagnoser viktige. | – |
| Senil RA / LORA | Debut etter 60–65 år. | PMR-lignende symptomer, systemisk inflammasjon, store ledd affisert, høyere IL-6/CRP. | Komorbiditet og polyfarmasi kompliserer bildet; TNFα, RF og anti-CCP ofte lavere. | Korkmaz C, 2017; Serhal L, 2020 |
| Malign/systemisk RA | Sjelden, aggressiv variant (spesielt menn 60–70 år). | «Tørr artritt», serositt, hudvaskulitt, noduli; systemiske komplikasjoner som pleuritt, perikarditt, koronar-angiitt, polynevropati, interstitiell Iungesykdom, glomerulonefritt, episkleritt og skleritt. Vekttap er vanlig | Bredt organengasjement; rask progresjon. | Lilleby V & Gran JT, 1997 |
Diagnostiske kriterier for seronegativ RA
- Oppfyller de fire første ACR kriteriene (1988) (1-4).
- Radiologiske forandringer forenelige med RA.
- Sykdomsvarighet i minst tre år hvor mange pasienter er testet negativ for RF x 3.
- Eksklusjon av andre sykdommer som kan gi lugnende symptomer som sakroiliitt, psoriasis, symptomgivende IBD (Ulcerøs kolitt eller Mb. Crohn), andre artritt-sykdommer ekskluderes og psoriasis, IBD, ankyloserende spondylitt eller reaktiv artritt blant første grad slektninger.
Litteratur Gran & Husby J Rheumatol 1987
Differensialdiagnoser
Mange tilstander kan klinisk ligne på RA, spesielt i den tidlige sykdomsfasen og ved seronegativ RA der anti-CCP er negativ (Paalanen R, 2020). Et kjennetegn på RA er at mange ledd angripes. Vurdering av både antall og lokalisasjon av affiserte ledd er derfor en del av diagnostikken. Det er også viktig å være kjent med “mimickers” for RA, slik at korrekt diagnose og behandling sikres.
Blant mange seronegative “mimikers” er psoriasisartritt en av de vanligste differensialdiagnosene:
| Forskjell mellom psoriasisartritt (PsA) og RA: Tabell tilpasset etter Coates LC, Clinical Medicine 2017 |
||
| Symptomer | RA | PsA |
| Antall affiserte ledd | Polyartritt vanligst | 30-50% har oligoartritt |
| Ledd-affeksjon | Ikke DIP ledd | Hvilket som helst, inkludert DIP |
| Entesitt | Uvanlig | Klinisk hos 60-80% |
| Daktylitt | Uvanlig | Klinisk hos 30% |
| Aksial affeksjon | Erosiv cervikal affeksjon | Aksial fenotype |
| Kutan / negle affeksjon | Ikke økt forekomst | Psoriasis: 80% hud, 60% negler |
| Serologiske antistoff | RF og CCP oftest positive | RF og CCP vanligvis negative |
| Bildediagnostikk | Erosjoner og osteopeni | Periostal ny benformasjon |
Liste (alfabetisk) over differensialdiagnoser til RA:
- Artrose (CMC-1, PIP, DIP og MTP-1, normale inflammasjons-parametere). Degenerativ leddsykdom som primært rammer leddbrusk i vektbærende ledd og ofte debuterer med smerter og stivhet, men uten systemisk inflammasjon. Kan ramme lignende ledd som RA, spesielt i hendene, men mangler ofte symmetrisk affeksjon og systemiske symptomer. Normale inflammasjonsparametere og fravær av a-CCP skiller den også fra RA.
- Borrelia-artritt: Oftest artritt i ett kne noen uker etter bitt av skogflått, særlig der flåtten ikke ble fjernet raskt. Artritt er forårsaket av Borrelia burgdorferi-bakterien som overføres via skogflått. Borrelia-artritt forløper oftest monoartikulært og er assosiert med erythema migrans.
- Erosiv osteopati (mixed arthritis/blandet artrose og artritt): En form for artrose med radiologiske tegn på både degenerasjon og inflammasjon som kan føre til erosjoner og ligne RA.
- IBD- artritt ved inflammatoriske tarmsykdommer (IBD): Spondyloartritt assosiert med Crohns sykdom eller ulcerøs kolitt. Perifer artritt eller aksial spondyloartritt er vanligste ekstraintestinale manifestasjon. Gastrointestinale symptomer og assosiasjon med IBD skiller den fra RA.
- Infeksiøs/septisk artritt: Akutt artritt forårsaket av bakteriell infeksjon i leddet er ofte preget av sterke smerter, hevelse, rødhet og feber. Borrelia- og tuberkulose-artritt og forløper ofte mindre dramatisk. Feber, ensidig affeksjon, purulent leddvæske, svært høy CRP og leukocytose (neutrofile) skiller den fra RA.
- Kreftbehandling med sjekkpunkthemmere; Immunrelaterte bivirkninger av sjekkpunkthemmere inkluderer artralgi, artritt og myalgi. Anamnese med aktuell kreftbehandling, rask debut og fravær av anti-CCP-antistoff skiller den fra RA (Steven NM, 2019).
- Kryoglobulinemi syndromet: Systemisk vaskulitt forårsaket av kryoglobuliner. Kan være assosiert med hepatitt C. Kan gi artritt, vaskulitt og revmatoid faktor (men oftest negativ anti-CCP), men hudmanifestasjoner, systemiske symptomer og assosiasjon med hepatitt C skiller den fra RA.
- Palindrom revmatisme: Episodisk artritt med selvbegrensende anfall av leddhevelse og smerter. Kan presentere seg med polyartikulær artritt, men det episodiske forløpet og fravær av ledderosjoner skiller den fra RA. Anti-CCP kan være positiv ved begge tilstander.
- Paramalign artritt: Artritt assosiert med malignitet. Debut før, samtidig med eller etter kreftdiagnose. Kan etterligne (seronegativ) RA klinisk, men anamnese med malignitet og rask debut skiller den fra RA.
- Polymyalgia revmatika (PMR): Preget av smerter og stivhet i proksimale muskler, alltid eldre individer (alltid ≥50 år, oftest >60 år). Presenterer seg med raskt innsettende stivhet i proksimale muskler og forhøyede inflammasjonsparametere. Vanligvis fravær av synovial inflammasjon/artritt og negativ anti-CCP skiller den fra RA.
- Psoriasisartritt: Assosiert med psoriasis. Typisk med perifer artritt, men hudmanifestasjoner av psoriasis, negativ anti-CCP, ofte asymmetrisk leddaffeksjon og affiserte DIP-ledd skiller den fra RA.
- Pyrofosfat-artritt (kondrokalsinose, pseudogikt): Akutt artritt forårsaket av krystaller av kalsiumpyrofosfat i leddet. Ofte monoartikulær og rammer oftest ett kne hos eldre personer. Akutt artritt er vanligst, selv om kroniske artrose-lignende forløp også forekommer. Karakteristisk radiologisk bilde med bruskkalk og identifikasjon av krystaller i leddvæsken skiller den fra RA.
- Reaktiv artritt: Inflammatorisk artritt utløst av en forutgående (uker) infeksjon i mage-tarmkanalen eller urogenitaltrakten. Anamnese med forutgående infeksjon, noen få affiserte store ledd, negativ a-CCP og noen ekstraartikulære manifestasjoner (øye, hud, entesitt, genitalier) skiller den fra RA. Rammer oftest yngre menn.
- Retikulohistocytose, multisentrisk: Sjelden systemisk sykdom med nodulære hudlesjoner og destruktiv artritt. Polyartikulær artritt og erosjoner, men hudlesjoner, systemiske manifestasjoner og fravær av anti-CCP skiller den fra RA.
- RS3PE: Inflammatorisk sykdom preget av symmetrisk hevelse/ødem i hender og føtter, daktylitt og palmart erytem hos eldre personer. Symmetrisk hevelse i hender, men daktylitt og fravær av erosjoner skiller den fra RA.
- Sarkoidose: Granulomatøs inflammasjon i forskjellige organer, inkludert lunger, hud og ledd. Kan presentere seg med artritt, men lunge- og hudmanifestasjoner, hiluslymfadenopati og forhøyet ACE-nivå er typisk. Løfgrens syndrom; Akutt form for sarkoidose med erythema nodosum, bilateral hiluslymfadenopati og artritt/artralgi i begge ankel-områder. Akutt debut, erythema nodosum og hiluslymfadenopati skiller den fra RA.
- Systemisk lupus (SLE) og andre systemiske bindevevssykdommer: Autoimmune sykdommer med multiorgan affeksjon, inkludert artritt, hudutslett, renal involvering og hematologiske avvik. Systemiske manifestasjoner, spesifikke autoantistoffer og karakteristiske kliniske funn skiller dem fra RA.
- Urinsyregikt: Inflammatorisk artritt forårsaket av urinsyrekrystaller i leddet, ofte monoartikulær og rammer ofte stortåens grunnledd (MTP-1) i form av podagra. Ofte akutt leddinflammasjon og karakteristisk affeksjonen av stortåen, hyperurikemi og identifikasjon av krystaller i leddvæsken skiller den fra RA.
- Viral akutt polyartritt: Akutt artritt utløst av viral infeksjon, ofte polyartikulær og selvbegrensende. Den akutte debuten, assosiasjon med viral infeksjon og selvbegrensende forløp skiller den fra RA. Parvovirus B19, Hepatitt -B og -C, rubella (blant ikke-vaksinerte). Alfa-virus inklusiv Chikungunya: reise-anamnese: Triade: feber, smertefull artritt, utslett.
- Whipples sykdom: Lavgradig infeksjonssykdom med seronegativ, intermitterende artritt som forutgår generelle og gastrointestinale symptomer med opp til flere år.
Mål for sykdomsaktivitet
Det er utarbeidet standardiserte metoder. Vennligst les i eget kapittel om skåring av sykdomsaktivitet og organskade.
Svangerskap ved RA
Svangerskap hos kvinner med RA krever nøye planlegging og individuell oppfølging fordi sykdomsaktiviteten kan variere betydelig gjennom graviditeten. Omtrent 60 % av gravide med RA opplever bedret sykdomsaktivitet under svangerskapet (Jethwa H, 2019), trolig på grunn av immunologiske mekanismer som demper inflammasjonen. Den fysiologiske hensikten antas å være økt toleranse for fremmede proteiner, inkludert føtalt antigen (Østensen M, 2015).
Svangerskapsutfall. For de fleste kvinner med RA forløper svangerskap og fødsel normalt. En norsk studie viste en noe økt risiko for tidlig og sen spontanabort (RR 1,2 og RR 1,4), men ingen økt risiko for dødfødsel (Wallenius M, 2015). Metaanalyser viser samtidig en moderat økt risiko for preeklampsi (OR 1,48), lav fødselsvekt (OR 1,45) og tidlig fødsel (OR 1,58) (Huang W, 2022). Disse risikoene reduseres når sykdommen er godt kontrollert ved konsepsjon.
Sykdomsaktivitet etter fødsel. Etter fødselen opplever ca. 50 % av kvinnene en forverring av RA-aktiviteten (Jethwa H, 2019). Årsaken til postpartum-oppbluss er ikke fullt ut kjent. Dette understreker behovet for klar behandlingsplan både før og etter fødsel.
Behandling under svangerskap. Selv om mange kvinner får symptomlindring i svangerskapet, har rundt halvparten aktiv RA i tredje trimester (de Man YA, 2008). Optimal behandling er derfor viktig, og sykdomsaktiviteten bør være stabil lav i minst tre måneder før graviditet. Legemidler bør ikke seponeres uten god grunn, ettersom dårlig sykdomskontroll utgjør en større risiko enn mange av de anbefalte medikamentene.
Medikamenter som kan brukes i svangerskap:
csDMARDs og andre legemidler: Sulfasalazin, Hydroksyklorokin (Plaquenil), Ciclosporin-A, Takrolimus, Azathioprin, Kolkisin, Kortikosteroider (prednisolon, metylprednisolon), Immunglobuliner iv (IViG)
Biologiske legemidler: TNF-hemmere.
NSAIDs kan brukes intermitterende, men skal seponeres etter uke 28. Ikke-selektive NSAIDs med kort halveringstid (f.eks. ibuprofen) foretrekkes. De bør vurderes avsluttet hos kvinner som har vansker med å bli gravide.
Legemidler som bør unngås på grunn av utilstrekkelige sikkerhetsdata: Apremilast, avakopan, baricitinib, bosentan, filgotinib, leflunomid, mepakrin, tofacitinib, upadacitinib, voklosporin, anifrolumab, ekulizumab, guselkumab, mepolizumab og risankizumab.
Legemidler som er kontraindisert i svangerskap:
- Metotreksat
- Mykofenolat
- Cyclofosfamid
- Selektive COX-2-hemmere (pga. manglende sikkerhetsdata)
- NSAIDs i tredje trimester
Vaksinasjon av spedbarn. Levende vaksiner bør unngås hos barnet de første 6 månedene dersom mor fikk biologisk behandling sent i svangerskapet, avhengig av type bDMARD og tidspunkt for eksponering (Rüegg L, 2025).
Medikamenter som kan brukes ved amming
Trygge legemidler. Azathioprin/merkaptopurin, celekoksib, klorokin, kolkisin, ciklosporin, hydroksyklorokin, IVIG, IV metylprednisolonpulser, ibuprofen og andre ikke-selektive NSAIDs, prednison/prednisolon, sulfasalazin, takrolimus og alle bDMARDs.
For intravenøs metylprednisolon anbefales å utsette ammingen i 2–4 timer etter administrasjon.
Legemidler som ikke skal brukes ved amming. Apremilast, avakopan, baricitinib, cyclofosfamid, etoricoxib, filgotinib, iloprost, leflunomid, mykofenolat, tofacitinib, upadacitinib og voklosporin.
Mindre sikre, men potensielt brukbare ved mangel på alternativer: Bosentan, sildenafil og metotreksat ≤25 mg/uke kan vurderes dersom ingen sikrere alternativer finnes (Rüegg L, 2025).
Mer informasjon om svangerskap, amming og medikamenter
For mer informasjon om svangerskap og revmatisk sykdom, se egen side i dette kompendiet og nettsidene til Nasjonalt kompetansenettverk for svangerskap og revmatiske sykdommer (NKSR).
Behandling
Overordnede behandlingsprinsipper er å tilpasse tiltakene etter sykdomsaktivitet, pasientsikkerhet, komorbiditet og sykdomsforløp. Pasientmedvirkning i valg av behandling er også viktig. Revmatologer er spesialistene som vanligvis initierer og følger opp spesifikk (DMARD-) medikasjon (Smolen JS, 2020).
Forebyggende tiltak.
Hos genetisk disponerte individer kan livsstilsmodifikasjoner være av betydning for å redusere risikoen for å utvikle RA. Det viktigste forebyggende tiltaket er å unngå kjente risikofaktorer.
- Røykestopp er særlig sentralt, ettersom røyking er en tydelig og uavhengig risikofaktor for sykdomsutvikling (Deane KD, 2017).
- Et balansert kosthold anbefales generelt. Inntak av omega-3-fettsyrer, eksempelvis gjennom fisk, kan ha gunstig effekt. Dette skyldes at fiskeoljer inkorporeres i plasmamembraner og bidrar til langvarig antiinflammatorisk påvirkning (Costembader KH , 2024 ; Kremer JM, 2024).
- Vitamin-D-mangel er ugunstig, men tilskudd utover korrigering av mangeltilstander har ikke vist sikker langtidseffekt (Costembader KH , 2024).
Metotreksat som forebyggende behandling har ikke vist effekt blant disponerte, a-CCP positive personer (Dumoulin QA, 2024).
Ikke-medikamentell behandling
- Kosthold/ernæring: Mange pasienter etterspør informasjon om hvordan kosthold påvirker RA, men dokumentasjonen for spesifikke kostholdstiltak er begrenset. Et balansert og variert kosthold anbefales, mens enkelte studier antyder at omega-3-fettsyrer kan gi en moderat antiinflammatorisk effekt (Gioa C, 2020; Costembader KH , 2024).
- Mikrobiota. Tarmfloraens sammensetning kan influere sykdomsaktivitet, men det er fortsatt uklart om direkte påvirkning av mikrobiotaen kan brukes som behandling for RA (Zhao T, 2022).
- Tverrfaglig behandling. Optimal håndtering av RA forutsetter ofte et tverrfaglig samarbeid. Relevante faggrupper inkluderer revmatologer, ortopeder, fysioterapeuter, ergoterapeuter, sosionomer og sykepleiere, som alle bidrar med komplementær kompetanse i behandlingsforløpet (Steultjens EJM, 2002).
- Revmakirurgi. Kirurgiske inngrep kan være aktuelt ved vedvarende smerte, feilstillinger eller funksjonstap. Målet er å lindre symptomer, korrigere deformiteter og forhindre videre leddødeleggelse. Aktuelle prosedyrer omfatter blant annet synovektomi, artroskopi, osteotomier, artrodeser, metatarsalhode-reseksjoner og innsetting av totalproteser (Trieb K, 2009). For mer informasjon vises det til eget kapittel om revmakirurgi i eget kapittel.
- Cervikal affeksjon: Ved instabilitet i nakken som følge av RA kan bruk av stiv nakkekrage være nødvendig. Kirurgisk stabilisering vurderes ved glidning over 8 mm og/eller kliniske tegn på myelopati, som kraftsvikt eller parestesier. Slike inngrep har generelt lav komplikasjonsrate og gir ofte betydelig symptomlindring (Wolfs JF, Kloppenburg M, 2009).
Medikamentell behandling
Behandlingsmulighetene for RA er blitt betydelig utvidet de siste tiårene. Dette har ført til bedring i både fysisk funksjon og prognose. Sykdomsremisjon uten radiografisk skade eller progresjon er nå et realistisk behandlingsmål.
Behandlingsmål: Målet med RA-behandling har endret seg fra å lindre symptomer til å oppnå remisjon, det vil si fravær av sykdomsaktivitet og progresjon, samt kontroll på leddsmerter og inflammasjon. Behandlingen skal også å forhindre varig leddskade.
Behandlingsstrategi: Den sykdomsspesifikke behandlingen starter vanligvis med et csDMARD, oftest metotreksat så snart diagnosen er sikker. Kortikosteroid (prednisolon) kan gis forbigående i tillegg for rask symptomlindring. Dersom metotreksat ikke gir tilstrekkelig effekt innen 3 måneder eller remisjon ikke er oppnådd etter 6 måneder, velger en ofte å supplere behandlingen med et biologisk DMARD (bDMARD) som f. eks. en TNF-hemmer. Dersom biologisk behandling ikke tolereres, har utilstrekkelig effekt eller er kontraindisert, kan en JAK-hemmer (tsDMARD) være et godt alternativ. I noen tilfeller velger en å begynne med bDMARDs som førstelinje behandling (Burgers LE, 2019; Smolen JS, 2023). Behandlingsprosedyre er mer detaljert beskrevet i Metodeboken til Norsk Revmatologisk Forening.
Utfordringer. RA-behandling skal vanligvis pågå i flere år. Det er da spesielt viktig å unngå bivirkninger og sikre at pasientene følger behandlingsanbefalingene. Studier har vist at pasientmedvirkning i behandlingsvalg (“shared decision making”) kan øke etterlevelsen av behandlingen (Barton JL, 2020).
Pasientinformasjon. Det er viktig å gi pasienten grundig informasjon om sykdommen, behandlingsalternativer og mulige bivirkninger. Det kan redusere uheldig autoseponering, manglende oppfølging fra pasientens side og annen behandlingssvikt. Mange revmatologiske avdelinger tilbyr tilrettelagte kurs for pasienter og ledsagere, og det arrangeres møter og kurs i samarbeid med pasientorganisasjonene. I tillegg ligger pasientinformasjon om sykdommer på Norsk Revmatikerforbunds hjemmesider. Informasjon om legemidler kan hentes fra Norsk Revmatologisk Forening/Legeforeningen. Når behandlingen styres av spesialist i revmatologi og etter anbefalte retningslinjer, har norske data vist at remisjon oppnås hyppigere. Dette er ofte avgjørende for god prognose (Aga AB, 2013).
Før behandlingen er det viktig å informere om hensikten med behandlingen og hvorledes medikamenter virker. Pasientinformasjon fra legeforeningen/Norsk Revmatologisk Forening kan brukes. Retningslinjer for behandling er et godt utgangspunkt for medikamentvalg. I tillegg gjøres individuell vurdering (tilpasset legemiddelbehandling) i forhold til alder og vekt, medikament-anamnese og komorbiditet, vaksinasjoner og svangerskap eller svangerskapsønske. Velger en behandling utenfor godkjent indikasjon / utprøvende behandling tas også spesielle hensyn.
Tabell. Medikamentgrupper, eksempler, virkning, dosering, bivirkning.
🟢 Grønn = vanlig førstevalg / standardbehandling
🟡 Gul = brukt ved moderat til alvorlig sykdom eller ved manglende effekt av førstevalg
🔴 Rød = eksperimentell/utprøvende behandling eller høyrisiko medikament
| Medikamentgruppe | Eksempler/Legemidler | Indikasjon/Startfase | Formål/Effekt | Startdose/Administrasjon | Typiske bivirkninger/Forsiktighet | Referanser | Fargekode |
|---|---|---|---|---|---|---|---|
| Analgetika og NSAIDs | Paracetamol, NSAIDs, opioider (kortvarig) | Førstevalg for smerte | Symptomlindring; NSAIDs hemmer prostaglandinsyntese, påvirker ikke sykdomsprogresjon | Paracetamol: 500–1000 mg x 3–4/dag; NSAIDs etter preparat | Opioider: avhengighet ved langtidsbruk; NSAIDs: GI-bivirkning, nyrepåvirkning | NICE Guideline, 2018; Eberhardt A, 2025 | 🟢 Grønn |
| Kortikosteroider | Prednisolon, triamcinolon (intraartikulært) | Bridging / akutt fase | Reduserer inflammasjon og smerte; rask symptomlindring | Prednisolon 15 mg x 1 uke → trapp ned som beskrevet; Intraartikulære injeksjoner 20–40 mg triamcinolon per ledd | Langvarig bruk: osteoporose, diabetes, infeksjon; seponeres så raskt som mulig | Krause D, 2022; Norberg LB, 2018 | 🟢 Grønn |
| csDMARDs | Metotreksat, azathioprin (Imurel), ciclosporin (Sandimmun Neoral) og mykofenolat (CellCept) | Førstevalg sykdomsmodifiserende | Reduserer sykdomsaktivitet, hindrer leddskade; effekt etter 6–8 uker | MTX: 15 mg/uke, kan økes til 25 mg/uke; folsyre 1 mg/dag eller 10 mg/uke | MTX: kvalme, stomatitt, hepatotoksisitet, hypersensitivitetspneumonitt; kontraindisert ved leversykdom, alvorlig nyresvikt, svangerskap | Bertrand D, 2024); Alethaha D, Smolen JS, JAMA 2018; Turesson, 2024; Smolen JS, 2023; Kjørholt KE, 2024; Kerrigan SA, 2020 | 🟢 Grønn |
| bDMARDs – TNF-hemmere | Etanercept, infliksimab, adalimumab, golimumab, certolizumab pegol | Etter utilstrekkelig csDMARD-respons | Reduserer sykdomsaktivitet raskt (uker) | Subkutan/infusjon etter preparat | Økt infeksjonsrisiko, oppbluss latent TB, reaksjon på injeksjonssted, tretthet, hodepine | Wysocki T, 2022; Zhang Z, 2017 | 🟡 Gul |
| bDMARDs – IL-6-hemmere | Tocilizumab, sarilumab | Etter utilstrekkelig csDMARD-respons | Hemmer interleukin-6; moderat til alvorlig sykdom | Subkutan/infusjon | Som TNF-hemmere; risiko for leverpåvirkning | Wysocki T, 2022 | 🟡 Gul |
| bDMARDs – B-celle-hemmere | Rituximab | Etter utilstrekkelig effekt eller intoleranse mot TNF-hemmere | Reduserer B-celle-mediert inflammasjon | Infusjon etter protokoll | Infeksjonsrisiko, infusjonsreaksjon | Wysocki T, 2022 | 🟡 Gul |
| bDMARDs – T-celle-hemmere | Abatacept | Etter utilstrekkelig effekt av TNF-hemmere | Modulerer T-celle-aktivering | Infusjon/subkutan injeksjon | Infeksjoner, injeksjonsreaksjon | Wysocki T, 2022 | 🟡 Gul |
| tsDMARDs (JAK-hemmere) | Tofacitinib (Xeljanz), baricitinib (Olumiant), upadacitinib (Rinvoq) og Jyseleca (filotini | Alternativ til bDMARD | Tablettbehandling; effekt som bDMARD | Tablett, daglig dose etter preparat | Infeksjon, herpes zoster, hyperlipidemi, leverpåvirkning, MACE hos kardiovaskulær risikopasient | Goll GL, 2020; Genovese MC, 2016; Combe B, 2021; Taylor PC, 2019; Smolen JS, 2023; Aymon R, 2024 | 🟡 Gul |
| Eksperimentell / utprøvende behandling | CAR T-celleterapi, BiTE (blinatumomab, teclistamab) | For høy sykdomsaktivitet / behandlingsresistente pasienter | Kan gi remisjon og fall i anti-CCP; T-celler dreper B-celler | Protokollbasert, klinisk utprøving | Kort oppfølgingstid, ukjent langtidseffekt | Haghikia A, 2024; Humby F, 2024; Bucci L, 2024 | 🔴 Rød |
| Vaksiner / tester før DMARDs | Influensa, COVID-19, pneumokokker, hepatitt, herpes zoster, RSV | Forebygging av infeksjoner | Reduserer risiko under immunsuppressiv behandling | Se vaksinasjonsanbefalinger | Ingen spesielle, vurder allergi og kontraindikasjoner | Winthrop KL, 2022 | 🟢 Grønn |
Oppfølging under behandling
Regelmessig oppfølging hos revmatolog er sentralt i behandlingen av RA for å monitorere sykdomsaktivitet, evaluere behandlingsrespons og justere terapien ved behov. Behandlingen bør styres etter en “treat-to-target”-strategi, der man på forhånd definerer klare behandlingsmål og systematisk vurderer om disse er oppnådd.
Ved aktiv sykdom anbefales kontroll hos revmatolog eller spesialisert avdeling hver 1–3 måned (Fautrel B, 2024; Smolen JS, 2016, EULAR ). Studier viser at tett og strukturert oppfølging i perioder med høy sykdomsaktivitet er assosiert med bedre langtidsprognose (Burmeister GR, 2017). Supplerende bildediagnostikk med ultralyd kan avdekke subklinisk inflammasjon, men metoden er mer resurskrevende og fører ikke nødvendigvis til bedre behandlingsresultater (Sundin U, 2020).
RA er forbundet med økt risiko for kardiovaskulær sykdom. I tråd med dette anbefaler EULAR regelmessig screening for kardiovaskulær risiko, minst hvert femte år (R Agca, 2016). Statiner kan bidra til å redusere denne risikoen både gjennom kolesterolsenkende egenskaper og via antiinflammatoriske og antioksidative effekter (Soulaidopoulos S, 2018).
Avslutte DMARDs
Vurdering av om DMARD-behandling kan avsluttes gjøres først når pasienten har vært i stabil remisjon eller svært lav sykdomsaktivitet i minst 6–12 måneder eller lengre. Remisjon bør vurderes både klinisk og ved normalisering av CRP og kan i tillegg dokumenteres med etablerte scoringssystemer som DAS28, SDAI, CDAI eller EULAR/ACR Boolean-kriteriene. Fravær av radiologisk progresjon er en viktig forutsetning før nedtrapping vurderes.
Den største utfordringen ved avslutning av DMARDs er den betydelige risikoen for sykdomsoppbluss. Tilbakefall krever som regel gjenoppstart av behandling. For å redusere risikoen for akutte forverringer anbefales gradvis dosenedtrapping, vanligvis én medisin om gangen. Under nedtrappingen følges pasienten med regelmessige kontroller og laboratorieprøver for raskt å fange opp tegn til residiv. De fleste tilbakefall oppstår innen ett år etter behandlingsstopp (D’Onofrito B, 2022).
Mange revmatologer avslutter rutinemessig oppfølging når pasienten har hatt vedvarende remisjon uten DMARDs i minst ett år, forutsatt at det ikke foreligger tegn til ny sykdomsaktivitet.
Medikamenter ved kirurgiske inngrep
Håndtering av DMARDs i forbindelse med kirurgi krever nøye vurdering for å balansere risikoen for infeksjon mot faren for sykdomsoppbluss. Norske prosedyrer (Albrecht K, 2022: NRF/legeforeningens norske prosedyrer) angir følgende anbefalinger:
- Glukokortikoider: Systemiske kortikosteroider, som prednisolon, bør om mulig trappes ned i løpet av 2–3 måneder før operasjonen til lavest mulig dose, helst <10 mg/døgn, da høyere doser er assosiert med økt infeksjonsrisiko.
- Metotreksat kan vanligvis videreføres, men dosen bør ligge på ≤15 mg/uke før kirurgi.
- Leflunomid (Arava): Leflunomid kan vaskes ut etter standard prosedyre (kolestyramin-behandling) dersom pasienten har særlig høy infeksjonsrisiko.
- Azathioprin, mykofenolat og ciklosporin A: Disse legemidlene anbefales pauset 1–2 dager før kirurgi.
- Biologiske DMARDs bør settes på pause i minst ett doseringsintervall før inngrepet. For TNF-hemmere anbefaler norske prosedyrer minst to ganger legemidlets halveringstid.
- Biologiske legemidler (bDMARDs) settes på pause i minst ett doseringsintervall
- JAK-hemmere bør stoppes 3–4 dager før større inngrep.
- Apremilast (Orencia) kan vanligvis fortsette uten pause.
Gjenoppstart etter operasjon: Biologiske legemidler kan som hovedregel gjeninnsettes omtrent 2 uker postoperativt, forutsatt tilfredsstillende sårtilheling og fravær av infeksjonskomplikasjoner, i tråd med norske anbefalinger.
RA som er vanskelig å behandle
EULAR-definisjon (Nagy G, 2020)
- Behandling i henhold til European League Against Rheumatism (EULAR) sine anbefalinger og svikt ved ≥ 2 biologiske/målrettede syntetiske DMARDs (med forskjellige virkningsmekanismer)* etter svikt i konvensjonell syntetisk DMARD-behandling (med mindre kontraindisert).†
- Tegn som tyder på aktiv/progressiv sykdom, definert som ≥ 1 av følgende:
-
- Minst moderat sykdomsaktivitet (i henhold til validerte sammensatte mål, inkludert leddtelling, for eksempel DAS28-ESR>3,2 eller CDAI>10).
- Tegn (inkludert akuttfase-reaktanter og bildediagnostikk) og/eller symptomer som tyder på aktiv sykdom (leddrelatert eller annet).
- Manglende evne til å trappe ned glukokortikoidbehandlingen (under 7,5 mg/dag prednison eller ekvivalent).
- Rapid radiografisk progresjon (med eller uten tegn på aktiv sykdom).‡
- Godt kontrollert sykdom i henhold til ovennevnte standarder, men fortsatt med RA-symptomer som forårsaker redusert livskvalitet.
3. Håndteringen av tegn og/eller symptomer oppfattes som problematisk av revmatologen og/eller pasienten.
Alle tre kriteriene må være til stede ved vanskeligbehandlet RA.
Forklaringer: CDAI: klinisk sykdomsaktivitetsindeks; DAS28-ESR: sykdomsaktivitetsskår som vurderer 28 ledd ved hjelp av SR, DMARD: sykdomsmodulerende antirevmatisk medikament. *Med mindre begrenset av tilgang til behandling på grunn av sosioøkonomiske faktorer. †Hvis konvensjonell syntetisk DMARD-behandling er kontraindisert, er svikt ved ≥ 2 biologiske/målrettede syntetiske DMARDs med forskjellige virkningsmekanismer tilstrekkelig. ‡Rapid radiografisk progresjon: endring i van der Heijde-modifisert Sharp-skår ≥5 poeng på 1 år.
Supplerende litteratur: Hoffman ZLM, 2025
Prognose
Prognosen for pasienter med RA er betydelig bedret de siste tiårene som følge av tidlig diagnostikk, behandlingsstrategier basert på treat-to-target og bredere tilgjengelighet av effektive DMARDs. I dag oppnår 75–80 % av pasientene lav sykdomsaktivitet eller remisjon med moderne behandling (Burmeister GR, 2017). De fleste kan dermed opprettholde både sosial funksjon og arbeidsdeltakelse. Remisjon vedvarer som regel så lenge DMARD-behandling fortsetter, mens omtrent 25 % kan oppnå vedvarende medikamentfri remisjon (Kjørholt KE, 2024; Fautrel B, 2024). Likevel vil en mindre andel utvikle et alvorligere sykdomsforløp, noe som understreker behovet for videre forskning og nye terapeutiske tilnærminger.
Faktorer som påvirker prognosen
Flere kliniske og biologiske faktorer er knyttet til risiko for mer aggressiv sykdom og økt funksjonstap:
- Sykdomsaktivitet: Vedvarende høy sykdomsaktivitet er en av de sterkeste prediktorene for dårlig prognose, mens tidlig remisjon gir best langtidsutsikter.
- Antall affiserte ledd: Mange hovne eller smertefulle ledd ved sykdomsstart er assosiert med mer aggressiv sykdomsutvikling.
- Erosjoner: Tidlig påvisning av erosjoner på bildediagnostikk indikerer økt risiko for rask ledddestruksjon.
- Ekstraartikulære manifestasjoner: Tilstander som revmatoid lungesykdom og vaskulitt signaliserer ofte et mer alvorlig sykdomsforløp.
- Autoantistoffer: Positiv IgA-RF og anti-CCP er knyttet til økt risiko for erosjoner og ekstraartikulære manifestasjoner.
- Alder: Eldre pasienter opplever gjerne raskere funksjonstap, selv om graden av leddødeleggelse ikke alltid er større enn hos yngre.
- Andre faktorer: Mange hovne ledd, utilstrekkelig behandlingsrespons på to eller flere DMARDs, RA-vaskulitt og røyking er alle forbundet med dårligere prognose.
Dødelighet og langtidsrisiko
Historisk har RA vært assosiert med økt dødelighet, med en Standard Mortalitets Ratio, SMR på 1,5–2, hovedsakelig på grunn av høyere forekomst av kardiovaskulære sykdom, , infeksjoner og i enkelte tilfeller lymfom (Naz, SM, 2007). RA-pasienter har tradisjonelt hatt en doblet risiko for hjerteinfarkt, tilsvarende risikoen ved diabetes mellitus (van Halm VP, 2009).
Innføringen av moderne DMARD- og biologisk behandling har imidlertid ført til en markant forbedring. Nyere studier viser at 5-års overlevelse etter år 2000 er lik den i normalbefolkningen (Laicaille C, 2017). Denne utviklingen tilskrives bedre kontroll av inflammasjon, redusert progresjon av leddskade og mer systematisk forebygging av komorbiditet, spesielt kardiovaskulær risiko.
Retningslinjer, anbefalinger og prosedyrer
EULAR anbefalinger (alle)
Her et et lite utvalg for RA:
- Behandling med DMARDS, EULAR: (Smolen JS, Ann Rheum Dis 2023)
- ACR/EULAR kriterier for remisjon (revidert), 2022 (Studenic P, 2022)
- EULAR definisjon av “difficult-to-treat RA” (Nagy G, 2020)
- Tidlig artritt EULAR: Combe B, 2016
- Kardiovaskulær risiko EULAR; Agcar, 2016
- Sykepleier-anbefalinger EULAR; Bech B, 2019
- Fysisk aktivitet EULAR: Rauch Osthoff, 2018
- EULAR points to consider for the use of antirheumatic drugs in reproduction, pregnancy and lactation; update 2024 (Förger F, 2024)
- ACR/EULAR klassifikasjonskriterier/ Aleta D, 2010)
Norsk Revmatologisk Forening / Legeforeningen
Franske behandlingsretningslinjer:
Litteratur
Hoffman ZLM, 2025 (difficult to treat RA)
Smolen JS, 2023 (EULAR anbefalinger om behandling og oppfølging)
Kerschbaumer A, 2020 (behandling)
Teksten er basert på aktuell faglitteratur. Den er skrevet og gjennomgått av forfatterne. I bearbeidelsen er det brukt kunstig intelligens i noen avsnitt.
