ANDRE SYKDOMMER (REV 063-REV 077)
213 Sarkoidose (REV 074, REV 080)
Ragnar Gunnarsson
Kjennetegn på Sarkoidose
Systemisk betennelsessykdom som karakteriseres med inflammatoriske granulomer uten sentral nekrose («non-caseating»). Granulomer er betennelsknuter laget av epiteloide celler og kjempeceller.
Hoved manifestasjon er fra lunger og luftveier (> 90%).
Ekstrapulmonale manifestasjoner kan forekomme i over 30% tilfelle med da affeksjon av en eller flere organsystemer som; hud, øyne, lever, milt, muskler, ledd, skjelett, nyrer, hjerte og nervesystemet.
Sykdommen er heterogen, der aller fleste har en god prognose og blir spontant bedre etter ca. 2-5 år. Hos et mindre antall, særlig hos de som har alvorlig lunge-, hjerte-, hjerneaffeksjon går sykdommen i kronisk fase med økt sykelighet og dødelighet.
Sarkoidose er hyppigere i Norden en andre deler av verden.
ICD-10: D86.8
ATC koder (for legemiddelstatistikk): Prednisolon: H02A B06 Immunsuppressive legemidler: L04A A
Definisjon
Sarkoidose er en systemisk multiorgan betennelsessykdom av ukjent årsak, som karakteriseres av betennelsesknuter, granulomer uten sentral nekrose («non-caseating»).
Hovedmanifestasjon er fra lunger og luftveier (> 90%). Ekstrapulmonale manifestasjoner kan forekomme i over 30% tilfelle med da affeksjon av; hud, øyne, lever, milt, muskler, ledd, nyrer, hjerte eller nervesystemet.
Sykdommen er heterogen der aller fleste har en god prognose og blir spontant bedre etter ca. 2-5 år. Et mindre antall, særlig de som har alvorlig lunge, hjerte, hjerne og øyesykdom, går sykdommen i kronisk fase med økt sykelighet og dødelighet.
Historisk tilbakeblikk
1877 Jonathan Hutchinson beskrev angivelig første kasus fra King’s College Hospital in London.
1899 kom Caesar Boeck (1845-1917), som var professor i dermatologi ved Rikshospitalet i Oslo, frem med begrepet «Boeck sarcoid». Begrepet «sarcoidosis» er sammensatt av «sarco» som tyder «kjøtt», «eidos» som tyder «likt» og «sis» som merker «tilstand». Samlet sett «kjøttliknende tilstand».
1909 beskrev danske øyelegen Christian Frederick Heerfordt tilstanden uveoparotid feber men 28 år senere (1937) assosierte den svenske lege Jan G. Waldenström tilstanden til sarkoidose. Tilstanden kalles Heerfordt–(Waldenström) syndrom (se Figur 4).
1941 oppdaget den norske patologen Morten Ansgar Kveim, at med å sette ekstrakt fra miltbiopsi fra en kjent sarkoidose-pasient subkutant, ville man etter ca. 6 uker få sarkoidose forandringer hos de med underliggende sarkoidose. Positiv Kveims (-Siltzbach) test kunne på denne måten skille sarkoidose fra bl.a. berylliose (se under). På grunn av infeksjonsrisiko brukes Kveims test ikke per dags dato. Det har vært oppgitt at i 20-40% tilfelle var Kveims test falsk negativ og særlig når pasienten hadde startet opp med kortikosteroid behandling.
1953 beskrev den svenske legen Sven Löfgren (1910-1978) først som kalles Löfgrens syndrom med akutt sarkoidose (se herunder).
Epidemiologi
Det er stor geografisk variasjon i insidens, prevalens og også variasjon av manifestasjon og prognose mellom etnisitet ved sarkoidose. Sykdommen rammer sjelden barn under 10 års alder. Sykdommen rammer kvinner noe oftere og flere studier har identifisert to alderstopper fra 20-29 år og fra 60-65 år De skandinaviske landene har bl.a. de høyest prevalens (160 per 100.000) og insidens (11-24 pasienter per 100.000 per år) som er publisert er fra Sverige, mens Island følger restene av Europa med under halvdel av den insidensen ned på 5,0 per 100.000 per år mens enda lavere insidens er i Sør-Europa (1, 2). Epidemiologiske data fra Amerikas forente stater viser at sykdommen rammer de av afrikansk herkomst mer en 3-ganger oftere enn de som er av europeisk herkomst (18-71 per 100.000 per år). Sarkoidose er derimot sjelden hos de som er av asiatisk herkomst. Det foreligger foreløpig svært lite epidemiologisk forskning om sarkoidose fra Afrika (1, 3, 4).
Genetikk
Epidemiologiske studier har påvist opphopning i familier. En dansk-finsk tvillingstudie med 210 tvillingpar siste at der den ene hadde sarkoidose var det ca. 80 fold økt risiko for at monozygot tvillingen og 7 fold risiko for at den andre dizygote tvillingen også fikk sykdommen (5).
HLA klasse II molekules og T-celle resepter og HLA polymorfismer er både assosiert til utvikling av sarkoidose og prognose. HLA-DRB1*03 som er assosiert til Löfgrens syndrom som oftest har også god prognose. Det finnes også andre en HLA assosierte genetiske faktorer på kromosom fem, på annexin 1 og butyrophilin-like 2 (BTNL2) immunregulerende gen.
Patogenese
Årsak for sarkoidose er ukjent. Det er igjennom årene vært flere teorier om bakteriell patogenese der sarkoidose ligner på fremmedlegemereaksjon. Det foreligger per dags dato ingen gode dyremodell på sarkoidose.
Påvirkning av Cutibacterium acnes og mykobakterier har vært mest grundig undersøkt. Der har man sett statistisk økt genetisk materiell av disse i lymfeknuter av sarkoidose relatert til friske, men det er langt i fra at dette forklarer årsaken til sykdommen.
Det er en sannsynlig mulighet at sarkoidose er en autoantistoff drevet sykdom og mistanken har vært rettet mot vimentin som er gruppe av trådaktige proteiner og er en av byggeblokkene i cytoskeletonen (6, 7).
Det er assosiasjon til økt risiko for sarkoidose hos de som driver med landbruksarbeid i tillegg til brannmenn og de som arbeider i smelteverk. Det er godt dokumentert at det var økt hyppighet av sarkoidose hos de som ble utsatt og arbeidet i ruinene av World Trade Center i New York etter brann og kollaps av sentret etter at to passasjerfly fløy inn i de to turnene i 2001. Der var store mengder av brent material og støv rammet særlig de om arbeidet med opprensing. Det samme ser man hos de som arbeider med malmer inkludert beryllium og titan, kopitoner, samt og biologisk støv.
Røyking ser ut til å redusere risikoen for sarkoidose med 50% men nikotin preparater ser derimot ikke til å redusere risikoen (8).
Overvekt er assosiert til økt risiko for sarkoidose hos kvinner mellom 40-70% (9).
Noen pasienter kan få det som kalles legemiddelutløst sarkoidose (DISR – «Drug-induced sarcoidosis-like reactions») som bekreftes ved å tilstanden går i remisjon når medikament er seponert (10). DISR kan utløses av antiretroviral behandling mot HIV infeksjoner, der patogenesen er antatt økning av CD4+ T-lymfocytter. I tillegg ses DISR ved «immune checkpoint inhibitorer» (ICIs), som er monoklonale antistoffer som rettes mot viktige regulatorer av immunsystemet (PD-1, PD-L1 og CTLA4). Hemming av disse anvendes som immunterapi ved spesielle kreftformer. De bidrar til en intensivert immunrespons mot kreftceller og som bivirkningen kan de utløse en rekke autoimmune fenomener inklusiv DISR. ICIs utløst DISR er heldigvis som oftest ikke alvorlig og ofte trenger pasienten ikke engang at gjøre opphold på behandlingen (11). Andre medikamenter kan utløse DISR med effekt på immunsystemet deriblant; Interferon α og β. TNFα hemmende behandling kan utløse DISR og der ser etanercept til å være den som mest assosiert, men også adalimumab og infliksimab som også anvendes til behandling av sarkoidose. Det er i tillegg enkelte rapporter om DISR utløst av behandling med certolizumab og golimumab. DISR utløst av TNFα hemmede behandling opptrer som regel ikke umiddelbart, men kommer lenge etter å medikamentet er igangsatt og fleste pasientene har da stått på behandlingen gjennomsnittlig 2 år.
Det er i tillegg rapporter om DISR ved rituksimab (anti-CD20), tocilizumab (anti-IL6) og ustekinumab (anti-IL12/23).
Diagnostikk
Det foreligger ingen klassifikasjons eller diagnostiske kriteria for sarkoidose. Diagnosen sarkoidose er ikke standardisert og kan være utfordrende og er aldri helt sikker. Diagnosen er basert på mønstergjenkjenning «pattern recognition» der man kombinerer det kliniske sykdombilde, med kliniske og radiologiske undersøkelser og som oftest med histologi med påvisning av ikke-nekrotiserende granulomer og ekskludering av andre årsaker til granulomatøs sykdom.
Oppdatert konsensus for diagnose av sarkoidose kom fra både fra de amerikanske og britiske lungelegeforeningene i 2020 (12, 13). «Diagnosis and Detection of Sarcoidosis. An Official American Thoracic Society Clinical Practice Guideline» (12) og «British Thoracic Society (BTS) Clinical Statement on pulmonary sarcoidosis» (13).
Figure 1. Skjematisk oversikt over anbefalt diagnostisk algoritme for sarkoidose som er basert på ekspertuttalelse og 2020 oppdatert anbefaling fra American Thoracic Society. Utarbeidet fra The New England journal of Medicine. 2021 Sep 9;385(11):1018-32
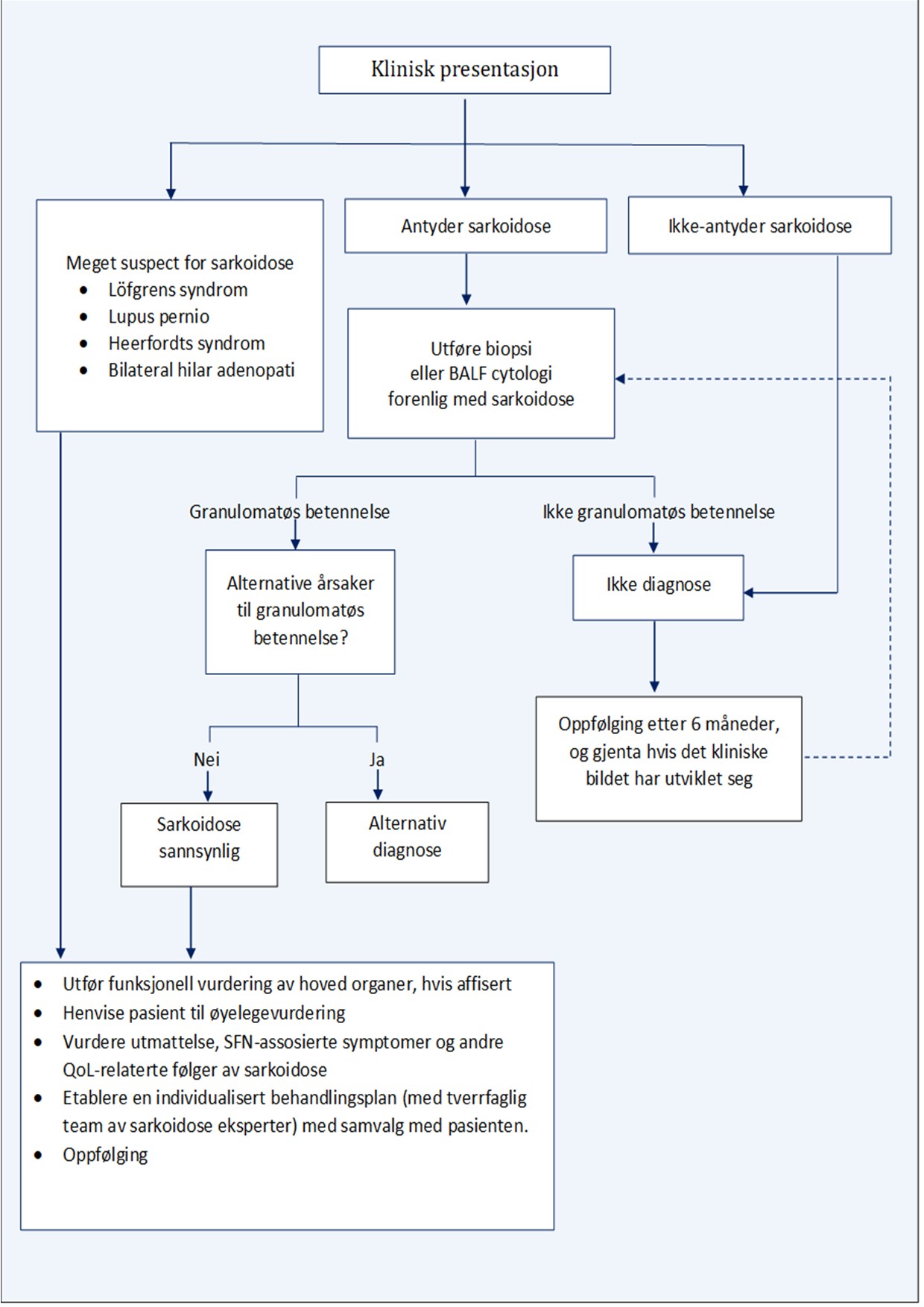
BALF : “bronchoalveolar lavage fluid”. med økt antall lymfocytter i BAL væske > 2 ganger øvre grense for normal, BAL ratio av CD4 + / CD8 + T-lymfocytter > 3,5. SNF : “small-fiber neuropathy”. QoL : “quality of life (QoL).”
En nylig publisert Europeisk multisenter studie, med 2163 pasienter inkluderte, så på fenotyper av sarkoidose. Kliniske manifestasjoner var analyserte med flerdimensjonal korrespondanseanalyse og klyngeanalyser. Konklusjonen var at man kunne stratifisere sarkoidose pasienter i fem distinkte, men ikke tidligere beskrevne, fenotyp grupper i henhold til organ affeksjon. De fem kliniske fenotypene kan være av nytte i henhold til kliniske studier og prognose er sarkoidose. De er følgende: (i) abdominal, (ii) okulær-hjerte-hud-sentralnervesystem, (iii) muskuloskeletal-kutan, (iii) lunge og intrathorakal lymfeknute og (v) ekstrapulmonal affeksjon (6).
Laboratorieprøver. Det finnes dessverre ingen spesifikk test for diagnosen sarkoidose.
Serologiske parametere:
-Angiotensin-converting enzym (ACE titer) er laget i epitheloide celler i sarkoidose granulomer. Serum ACE (SACE) titer er ofte i forhold mengde og grad av granulomene. Det er økt sensitivitet og spesifisitet ved stigende SACE verdier og dobbelt referanseverdier SACE ses sjelden ved andre sykdommer en sarkoidose. Det går an å måle ACE titer fra spinalpunksjon, men det er dessverre ikke særlig sensitiv metode for diagnose av sarkoidose i sentralnervesystemet
-Oppløselig interleukin-2 reseptor (sIL-2R) er bl.a. markør på T-celle aktivitet og er ofte forhøyet hos pasienter med sarkoidose (15, 16).
-Alkalisk fosfatase (ALP) mer enn tre ganger høyere enn referanseområde kan være assosiert til sarkoidose.
Andre markører som brukes foreløpig lite eller ikke i klinikken
-Chitotriosidase er et enzym produsert av aktiverte makrofager som har en rolle i forsvar mot sopp-, insekt- og rundorm-infeksjoner. Konsentrasjon av chitotriosidase kan henge sammen med aktivitet av sarkoidose med rimelig høy senstivitet og spesifisitet (17, 18). Chitotriosidase er litt brukt for sarkoidose men er også forhøyet ved forskjellige lipid storage lysosomal sykdommer, inkludert Gauchers sykdom, Niemann-Pick sykdom og galaktosialidose (19).
-KL-6 (Krebs von den Lungen-6) er et mucinlignende glykoprotein hovedsakelig uttrykt på type II alveoler epitelcelleoverflate. Det er påvist forhøyet konsentrasjon ved flere interstitiale lungesykdommer både de assosierte til systemisk bindevevssykdom samt og idiopatisk lungefibrose, i tillegg påvist ved lungeinfeksjon av SARS CoV2 og sarkoidose med lungeaffeksjon (18).
Bronkoalveolar (BAL) væske undersøkelse. Økt lymfocytt andel (>15%) i BAL væske og økt forhold CD4+/CD8+ T-lymfocytter i BAL væsken (>3,5 ratio) er assosiert til sarkoidose. Det er flere feilkilder der bla. infeksjoner, lymfom og hypersensitivitet pneumonitt.
Biopsitaking. Påvisning av granulomer uten sentral nekrose («non-caseating») er nærmest gullstandard i diagnose av sarkoidose, men ikke engang det er helt diagnostisk (se differential diagnoser av sarkoidose). Sarkoidose kan være flekkvis og en «negativ» biopsi kan ikke helt utelukket sarkoidose i det aktuelle organ der sykdommen opptrer som oftest rammer flekkvis. Når man skal ta biopsi bør prøve å få hvor det er enklest å komme til og komplikasjonene er minimale. Oftest enklest med hudbiopsi, spyttkjertel, tårekjertel-, konjunktiva eller perifer lymfeknute biopsi. Når sykdommen er i lungevev, lungehilus lever, milt, nyrer, hjerte samt hjerne er det åpenbart mer komplisert med biopsitaking.
Bildediagnostikk
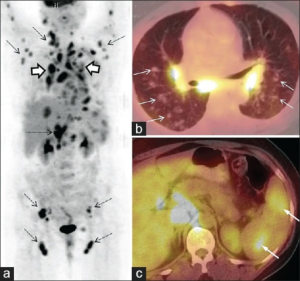
18F-fluorodeoxyglukose positron emisjons tomografi (18FDG PET skann) er den mest sensitive metoden for å påvise sarkoidose og kan vurderes både med henhold til diagnostikk, hjelpe til med biopsitaking og som behandlingsrespons. 18F-FDG PET skann har erstattet gallium-67 scintigraf som tidligere ble brukt. Vennligst se illustrasjon av PET/CT øverst i kapittelet.
Differensial diagnoser ved sarkoidose:
Det er flere viktige differensial diagnoser ved sarkoidose (12, 20).
Legemiddelutløst sarkoidose («Drug-induced sarcoidosis-like reactions» – DISR) må vurderes (se her oven).
Fremmedlegemereaksjon som for eksempel ved aspirasjon kan gi lokalisert granulom-reaksjon.
Infeksjoner er svært viktig å utelukke fra tuberkulose der immunsuppressiv behandling kan klart forverre tilstanden. De viktigste er infeksjoner fra mykobakterier inkludert Mycobacterium tuberculosis infeksjon. Soppinfeksjoner kan også gi en granulomatøse reaksjoner. Dette inkluderer; aspergillosis, blastomycosis, histoplasmosis og cryptococcus infeksjoner. Andre infeksjoner kan også i visse tilfeller forveksles med sarkoidose. Dette inkluderer infeksjoner forårsaket av Pneumocystis jiroveci infeksjon, toksoplasmose som er forårsaket av den parasitten Toxoplasma gondii samt og leishmaniasis som forårsakes av infeksjoner med leishmania-protozoer. I tillegg kan schistosomiasis som forårsakes av orm-infeksjon. I tillegg kan nevnes visse tilfeller av mykoplasma infeksjoner forveksles med sarkoidose. Dette kan også gjelde i visse tilfeller av brucellose, treponema og bartonella infeksjoner. I tillegg kan nevne også virusinfeksjoner med cytomegalovirus (CMV), Epstein Barr virus (EBV) eller Coxiellea burneti infeksjoner forveksles med sarkoidose (12, 20).
Lymfom og kreftformer kan medføre granulomatøse reaksjoner og kan forveksles med sarkoidose.
Revmatologiske sykdommer kan veksles med sarkoidose og det er sykdommer som; reumatoid artritt der det kan forekomme revmaknuter og interstitial lungesykdom. I tillegg granulomatose med polyangiit (GPA) der granulomatøs betennelse forekommer.
Andre sykdommer som histologisk kan gi granulom reaksjon er; primær biliær kolangitt (PBC) og Crohns sykdom.
Berylliose (kronisk beryllium sykdom) kan være svært vanskelig å diagnostisere fra sarkoidose. Pasientene har da kommet i kontakt med beryllium som er et grunnstoff (Be) med atomnummer 4. Beryllium som grunnstoff brukes for legering med kobber og ble tidligere brukt i lysrør. Pga. egenskapene brukes det i konstruksjonen på supersoniske kampfly, romfartsonder og satellitter samt i kjernekraft industrien.
Blau syndrome: er en granulomatøs sykdom, der granulomene er histologisk identiske med sarkoidose. Sykdommen rammer nesten utelukkende hud, ledd og øynene med uveitt og manifestasjonene kommer vanligvis før 4 års alder. Sykdommen har et autosomalt dominerende arvsmønster og forårsakes av mutasjon i NOD2 -genet.
Granulomatous lesions of unknown significance (GLUS) syndrome: er et svært sjelden tilbakevende benign tilstand av ukjent årsak. Symptomene er langvarig feber med histologiske granuloma i leveren, beinmarg, milt og lymfeknuter men vanligvis ikke i lungevev. GLUS skyller seg fra sarkoidose og er ikke assosiert til forhøyet serum angiotensin converting enzyme (SACE). Hyperkalsemi eller hyperkalsuri er ikke tilstede og Kveim testing er beskrevet som unison negativ. I tillegg viser immunotyping av lymfocytter i granuloma hovedsakelig B-lymfocytter som er en klar forskjell fra sarkoidose granulomer som inneholder hovedsakelig T-lymfocytter (20).
Nekrotiserende sarkoidgranulomatose (NSG): er en granulomatøs sykdom som består av granulomer som ofte er konfluente og nekrotiske og er assosiert med en granulomatøs og lymfocytisk vaskulitt. Histologisk skyller NSG fra sarkoidose med at det er signifikant nekrose er tilstede og perivaskulære granulomer som komprimere både arterier og vener uten å forårsake vaskulær nekrose (20).
Andre differensial diagnoser er; IgG4-relatert sykdom, Langerhans histocytose, Erdheim-Chester sykdom og Castleman’s sykdom (12).
Lunge-sarkoidose
Hyppigste organaffeksjonen ved sarkoidose er fra lunger og toraks (>90%). Dette er ofte asymptomatisk hos pasienter med sarkoidose, men kan gi symptomer som hoste eller dyspne. Fleste pasienter har normale lungefunksjonsundersøkelser i hvert fall i startfasen. Ved signifikant lungeaffeksjon øker sjansen for å utvikle restriktiv lungesykdom over tid. Diffusjonskapasitet for karbonmonoksid (DLCO) er mer sensitive får å vurdere interstitial lungesykdom og kan også indirekte avsløre pulmonal hypertensjon.
Engelske lungelegen John Guyett Scadding (1907-1999) kom fram i 1961 frem med klassifikasjon på lungeaffeksjon basert på radiologiske undersøkelser av lunger(7). (Tabell 1) Han klassifiserte forandringene i fire klasser etter om det var hilus lymfadenopati og/eller parenkymal lungeforandringer. Dette har vist seg å være sterkt tilknyttet til prognose av lunge-sarkoidose. Scadding stage I, med hilus adenopati uten lungevevsaffeksjon, er over 80% sannsynlighet at tilstanden går over av seg selv uten behandling i løpet av 2-5 år. Scadding stage IV er definert som lungefibrose og det har dårlig prognose.
Opprinnelige Scadding klassifikasjonen var utformet på konvensjonell røntgenbilder av thoraks men økt utstrakt bruk på computertomografi (CT) av lunger evt. med enda mer sensitive undersøkelser som av 18F-FDG PET CT skann forandrer klart definisjonene i Scadding klassifikasjonen.
Tabell 1. Oversikt over Scadding klassifikasjon av sarkoidose
| Klasse | Radiografi av lunger |
| O | Ingen abnormalitet |
| I | Hilus lymfadenopati |
| II | Hilus lymfadenopati og parenkymal abnormitet |
| III | Parenkymal abnormitet uten hilus lymfadenopati |
| IV | Lunge fibrose |
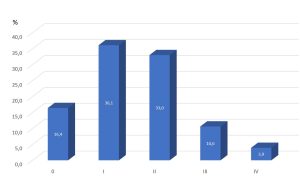
Figur 2 Scadding type i europeisk multisenter studie (n=2163) (6).
Sarkoidose assosiert til pulmonal hypertensjon (SAPH)
Sarkoidose er assosiert til økt sannsynlighet for å utvikle pulmonal hypertensjon (SAPH). I prospektive studier er prevalens av SAPH vurdert på rundt 3% og har negativ effekt på overlevelse. SAPH har en sammensatt årsak og klassifisert som klasse 5.2 pulmonal hypertensjon etter klinisk klassifisering av pulmonal hypertensjon (6. verdenssymposium om pulmonal hypertensjon) (22).
Det er økt risiko for pulmonal hypertensjon ved fibrotisk lungesykdom og vedvarende hypoksemi. Det er også påvist at granulomer i nærhet til kapillære venuler og lymfekar i lungene kan lede til tilstand som minner helst på veno-okklusiv sykdom. I tillegg kan det være påvirkning på prekapillære kar. Til å komplisere dette videre er økt fare for tromboembolisk sykdom i lunger ved sarkoidose og til slutt kan sarkoidose hjerteaffeksjon gi sekundær økt trykk i lungekretsløpet (23).
SAPH kan komme snikende og derfor er oppfølging viktig med gjentatt lungefunksjonstesting samt karbonmonoksid diffusjonskapasitet (DLCO) og i tillegg gjentatt standardisert 6-minutt gangtest med O2 metning. Hvis isolert fall i DLCO, uten sikker progresjon av lungeforandringer bør utredning i retning av SAPH vurderes med ekkokardiografi, måling av NT-proBNP, som er et peptid som produseres i hjertemuskelen og er et stabilt forstadium til det aktive peptidet BNP («brain natriuretic petide») og utskilles ved påvirkning av hjertet ved mekanisk strekk som hjertesvikt. Og eventuelt høyre hjertekateterisingen for direkte evaluering av hemodynamikken. Viktig også å utelukke lungeembolisering, som er betydelig økt ved sarkoidose, med pulmonal angiografi (CTA) og eventuelt ventilasjons/perfusjons (V/Q) scintigrafi.
Grundig underliggende kartlegging i hvert enkelt tilfelle er viktig for å kunne skreddersy og individualisere behandlingen.
Ekstrapulmonal sarkoidose
Det er vanskelig å angi prevalens på organaffeksjon. Her er det flere variabler, der publiserte kohorter har variasjon av geografi, rase, om dette er sykehuskohort fra et lokal sykehus eller tertiær medisinsk senter. Også om inngangspunktet er lungeavdelinger eller andre medisinske avdelinger. I tillegg et like viktig hvor intensivt de aktuelle pasientene er undersøkte, med PET undersøkelser evt. eller obduksjon.
En nylig publisert multisenter europeisk studie (n= 2163) viste at lungeaffeksjon (n = 1664 (92,6%)) vanligste typen organaffeksjon, etterfulgt av mediastinal og / eller hilar lymphadenopati (n = 1355 (77,0%)). Hud affeksjon var den hyppigste extrapulmonal affeksjonen (n = 342 (16,1%)) etterfulgt av øyeaffeksjon (n = 163 (7,8%)). 15,1% (n=327) hadde i en eller flere extrapulmonal organaffeksjon uten lunge og/eller hilar- eller mediastinal lymfadenpati (14).
De vanligste presentasjonssymptomene var tretthet (n = 1112 (61,8%)), hoste (n = 873 (47,9%)) og dyspné (n = 818 (44,4%)) (14).
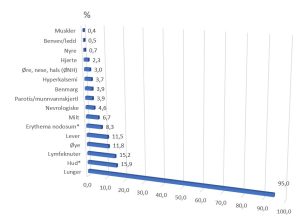
Figur 3.
Organ affeksjon hos 736 pasienter fra studie fra 10 sentra fra Amerikas forente stater som deltok i «A Case Control Etiologic Study of Sarcoidosis» ACCESS study som ble publisert for 20 år tilbake (24).
Sarkoidose syndromer
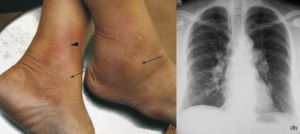
Löfgrens syndrom (LS) karakteriseres av triade av knuterosen (erythema nodosum), symmetriske forstørrede lymfeknuter i lungehilus (hilar lymfadenopati) og leddhevelse. Leddhevelsen er periartritt som oftest er symmetrisk og rammer som regel ankler, men kan også ramme andre ledd som kne og albuer. Tilstanden gir sjelden annen ekstrapulmonal affeksjon og prognosen er god uten behandling med spontan remisjon i opp mot 80% tilfelle. Hvis det er indikasjon for behandling, er det symptomatisk NSAID behandling. Opp mot en tredjedel av de som får sarkoidose i Sverige får LS og det er sterkt assosiert til vevstype HLA DRB1*03 (HLA DR3) som indikerer en god prognose (7).
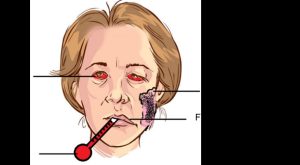
Heerfordt–(Waldenström) syndrom går også under navnet uveoparotis feber (Figur 4). Det er en sjelden manifestasjon av sarkoidose. Presenterer triade av symptomer i form av uveitt, med parotishevelse, feber, og i noen tilfeller Facial (VII) nerve parese.
Hud-sarkoidose
Sarkoidose hudmanifestasjon kan være spesifikke eller uspesifikke. Det er rapportert at opp to 30% kan få hudaffeksjon av sykdommen.
Knuterosen (erythema nodosum) er hyppigst av de uspesifikke hudmanifestasjonene og kommer i opp mot 10% av pasientene. Histologiske undersøkelser av knuterosen påviser ikke sarkoidose forandringer.
Spesifikke sarkoidose hudforandringer ligger vel til rette for biopsi og histologi viser granulomer. Hud-sarkoidose utgjør ikke fare og behandlingen er i hovedsakelig kosmetisk. Vanligst er dette hyperpigmenterte makulopapulære hudlesjoner (rødbrune, gulbrune) forandringer som oftest 2-5 mm store. De forekommer ofte; i ansikt, hals og øvre rygg. Forekomsten er hyppigere der hud er utsatt for skade, f.eks. i gamle og nye arr, i tattoo og i områder rundt piercing. Sarkoidose forandringer kan være svært varierte de kan gi ulcerasjoner og ligne på psoriasis.
Lupus pernio er en spesifikk og karakteristisk hudmanifestasjon og gir rød-blå, fiolette hudforandringer i ansikt, nese, kinn, ører, varer og fingre.
Darrier-Roussy sarkoidose tallrike oftest mellom 0,3-0,5 cm store noduli i dermis og subcutis på trunkus og ekstremiteter.
Vennligst les mer om hudsymptomer ved revmatisk sykdom i eget kapittel
Øye-sarkoidose
Sarkoidose kan affisere orbita, fremre og bakre segmenter av øyet, konjunktiva, tårekjertler og ekstraokulære muskler. I flere undersøkelser er det ca. 5% får øyeaffeksjon i startfasen av sykdommen. I løpet av sykdommen kan til sammen opp til 30-60% ha affeksjon i og rundt øyet. Sarkoidose er en av hovedårsakene til betennelsessykdom i øynene og diagnosen er utfordrende når sarkoidose opptrer isolert som øyeaffeksjon (25, 26).
Øyeaffeksjon kan være asymptomatisk i startfasen hos opp til en tredjedel og viktig at alle pasienter med diagnostisert sarkoidose skal til regelmessige øyeundersøkelse for å forhindre irreversibel skade på synet. Vennligst les mer om øyet og revmatisk sykdom i eget kapittel
Ledd-sarkoidose
Artralgi (leddsmerter) symptomer ser ut til å være hyppige ved sarkoidose.
I den amerikanske ACCESS studien hadde kun 0,5% (n=736) ledd eller skjelett manifestasjonen. Dette var betydelig hyppigere i den europeiske multisenterstudie. Der var rapporter totalt 9,6 % (n=2163) med artritt. I den europeiske studien var pasientene delt etter om det var (a) akutt oppstart av sarkoidose som innebærer Löfgrens syndrom (LS) (n=829) der hadde 15,5% artritt og sammenlignet med de som hadde (b) subakutt oppstart av sarkoidose (n=1286) der hyppigheten var 5,6% hadde artritt (14, 24). Man kan spekulere i årsaken til denne store forskjellen mellom disse to studiene. Mye kan sikkert forklares med at den europeiske studien ble publisert nesten 20 år senere og pasientene sannsynlig vært mer omfattende utredet med bl.a. MRI, ultralyd og PET-skanning i tillegg til dette er utført i to populasjoner.
Flere studier fra Nord-Amerika har vist pasienter av afrikansk herkomst er betydelig mer utsattere for å utvikle kronisk sarkoidose artritt som er generelt svært sjelden tilstand (<5%). Dette er som oftest nondestruktiv oligoartritt der skuldre, håndledd, kne, ankler og småledd i hender og føtter er oftest affiserte.
Löfgrens syndrom med hilær adenopati og erythema nodosum, følger ofte periarteritt med symmetrisk affeksjon av ankler, men sjeldnere kne. Ofte er dette ledsaget med feber. LS ser ut til å forekomme svært sjelden hos pasienter av afrikansk opprinnelse, men er relativ vanlig hos av de med europeisk og særlig nordisk opprinnelse. LS har god prognose og forsvinner etter uker – måneder (gjennomsnittlig etter ca. 12 uker) og behandles som oftest kun symptomatisk med evt. NSAID. Lavdose per oral Prednisiolon behandling kan vurderes hos pasienter med uttalte symptomer. Klinisk erfaring viser også en viss effekt av po. kolkisin hos del av pasientene, men man har ingen randomisert studie som støtter dette.
Muskelaffeksjon av sarkoidose
I den amerikanske ACCESS studien hadde kun 0,4% (n=736) muskulær affeksjon, men var 7,5% av den europeiske multisenterstudien (n=2163), og var nesten dobbelt så hyppig hos de som hadde akutt oppstart (10,6%) sammenlignet med de som hadde subakutt oppstart av sykdommen(14, 24).
Muskulær affeksjon kan inntreffe i form av; akutt, nodulær og kronisk myopati.
Mye forklares mest sannsynlig med at den europeiske studien ble publisert nesten 20 år senere og pasientene sannsynlig vært mer omfattende utredet med bl.a. MRI, ultralyd og PET-skanning i tillegg til dette er utført i to populasjoner
Osteo-sarkoidose
Osteosarkose er asymptomatisk hos omtrent halvdel. Mellom 3-13% av pasienter utvikler sarkoidose og der er tilstanden betydelig hyppigere hos pasienter av afrikansk herkomst og dobbelt hyppigere hos kvinner. Osteosarkoidose affiserer falangene som oftest da både i hender og føtter. Neseben og calcaneus er også ofte rammet. I tillegg til kranium, maxilla og axial skjelettet med vertebra, pelvis, costae, sternum i tillegg til distale deler av langben dvs. humerus og femur.
Osteosarkoidose responderer som oftest dårlig på behandling. Steroid behandling reduserer betennelse. Det foreligger ingen randomiserte studier på behandling av osteosarkoidse, men kasuistiske meddelelser har vist effekt av MTX, anti-TNF behandling og også av HCQ behandling.
Hjerte-sarkoidose
Det er ofte oppgitt at rundt 5% får klinisk hjerte-sarkoidose, men sarkoide granulomer finnes fire til fem ganger hyppigere, i opp mot 25% av pasienter med sarkoidose ved obduksjon. Det er også forskjell om det foreligger «klinisk hjerteaffeksjon» eller om det avdekkes ved avansert utredning som ved 18F-FDG PET skann og MRI eller eventuelt ved obduksjon. Hjerte-sarkoidose er angitt relativ hyppigere i Japan sammenlignet med andre områder (27). Hjerteaffeksjon er assosiert til tumor necrosis factor alpha 2 (TNFA2) og HLA-DQBI*0601 alleler.
Hjerte-sarkoidose er en betydelig diagnostisk utfordring når hjerteaffeksjon er første og noen ganger eneste tegn på sarkoidose. Hjerte-sarkoidose bør overveies særlig hos unge pasienter med ventrikkel-takykardi eller total AV-blokk uten åpenbar annen årsak der dette kan være debuterende symptomer. Sarkoidose affeksjon i hjerte er ofte helt uten symptomer. Hyppigste symptomene er arytmi som oftest totalt atrioventrikulært (AV) blokk og/eller ventrikkeltachykardi. Hjertesvikt som kan opptre primært pga. svekkelse pga. granulom-utvikling i hjertemuskulatur og/eller klaffepatologi. I visse tilfeller kan myokardsirkulasjonen bli rammet. Det er betydelig økt fare for utvikling av pulmonal hypertensjon ved sarkoidose og det er kan være flere og sammensatte årsaker til det.
Det er rapportert at hjerte-sarkoidose er ofte assosiert til affeksjon sentralnervesystemet, øye og hudaffeksjon. Dette er nylig bekreftet i tidligere angitt europeisk multisenter studie (n=2163) som systematisk analyserte sarkoidose i fem separate kliniske fenotyper der hjerte- og sentralnervøs affeksjon er også assosiert til sarkoidose affeksjon av hud og øyner (14).
Omtrent halvdel av dødsfall ved sarkoidose tilskrives hjerteaffeksjon og av disse er ¾ forårsaket av hjertesvikt og plutselig død pga. med affeksjon av hjertemuskulatur, klaffapparatet og/eller ledningsapparatet med påfølgende ledningsforstyrrelse og/eller ventrikulær arytmi.
Det foreligger per dags dato ingen internasjonale retningslinjer om hvor grundig pasienter med sarkoidose bør utredes for å utelukke affeksjon av hjerte.
Det anbefales i fleste tilfeller å utføre EKG, 24 timer-EKG registrering, ekkokardiografi og serum troponin, BNP eller proBNP måling hos alle pasienter med sarkoidose innledningsvis. Det er vert å ha det for seg at både sensitivitet og spesifisitet av en enkel EKG registrering er lav med antatt sensitivitet ned mot 3% ved påvist hjerte-sarkoidose.
I tilfelle konkret mistanke om myokard sarkoidose, bør man utføre mer avansert undersøkelser med hjertespesifikk MRI (CMR) med gadolinium kontrast der sen kontrastutvasking («late gadolinium enhancement» LGE) kan tyde på sarkoidose affeksjon i myokard. Til tross CMR påviser omfanget av hjerteaffeksjon bra, ser det ut til å skille dårligere mellom inaktiv og aktiv betennelse ved sarkoidose enn myokard rettet 18F-FDG PET skanning (28). Ved primær diagnostikk er CMR å foretrekke foran 18F-FDG PET, der negativ CMR har høyre negative prediktive verdi en negativ 18F-PET skann. Myokard 18F-FDG PET skanning er derimot å foretrekke ovenfor CMR ved oppfølging av aktiv terapi for hjerte sarkoidose (27). I tillegg vil fremmedelementer som pacemakerledninger ha stor innvirkning på CMR, men i betydelig mindre grad på 18F-FDG PET. I enkelte tilfeller der diagnosen er usikker er endomyokardial biopsi indisert. Ved hjerte-sarkoidose er granulomatøse forandringene flekkvise og sensitivitet av endomyokardial biopsi er dessverre være lav og en negativ biopsi utelukker ikke hjerte-sarkoidose.
Pasienter med sarkoidose med normalt EKG-funn og ingen symptomer fra hjerte bør screenes med EKG-undersøkelse og anamnese årlig (29).
Prognose pasienter med kardial sarkoidose avhenger i hovedsak av venstre ventrikkelfunksjonen. De som har normal ejeksjonsfraksjon har nærmest normal overlevelse etter 10 år, mens pasienter med uttalt redusert ejeksjonsfraksjon (<30%) hadde 1 års, 5 års og 10 års overlevelse på hhv. 91%, 57% og 19%, (27, 30)
Det foreligger relativ lite data på behandling og oppfølging av manifest hjerte-sarkoidose. En nylig systematisk oversikt og metaanalyse publisert i Journal of the American Heart Association på behandling av hjerte-sarkoidose viser at det foreligger ingen randomiserte studier på behandling og av de kun 34 studiene som var inkluderte var det kun 2 (6%) studier som ble evaluert av god kvalitet (31).
Behandlingen er immunsuppressjon da høydose steroid behandling som oftest 40 mg/d Prednisolon med noe lavere dosering når det er kombinert med sykdomsmodifiserende behandling som oftest metotreksat, alternativt; azathioprin, mykofenolat eller leflunomid. Tertiær behandling med ant-TNF behandling (infliksimab og adalimumab) er ikke særlig dokumentert og per dags dato foreligger ingen randomiserte behandlingsstudier på hjerte-sarkoidose.
Det er foreslått retningslinjer om behandling og oppfølging fra 2014 utarbeidet av flere foreninger av Association for Sarcoidosis and Other Granulomatous Disorders (WASOG); American College of Cardiology (ACC); American College of Chest Physicians (ACCP); American Heart Association (AHA); Asia Pacific Heart Rhythm Society (APHRS); og av European Heart Rhythm Association (EHRA) (se Figur 5) (32).
Det foreligger to absolutt indikasjoner for implantert kardioverter-defibrillator (ICD). (A) De om har tidligere hatt spontan oppstart ventrikulære arytmier og/eller hjertestopp eller (B) de som har sterkt redusert venstre ejeksjonsfraksjon ≤35%. Det er relativ indikasjon for de som har synkoper/nærsynkoper og de som har redusert ejeksjonsfraksjon på 36-45%.
Figur 5. Foreslått behandlings algoritme ved manifest hjerte-sarkoidose. (Birnie D.H. et. Al. JACC 2016)(9)
ECG = Elektrokardiogram; echo = ekkokardiografi; LVEF = venstreventrikulær ejeksjonsfraksjon
PET = positron emisjonstomografi; FDG = 18-fluorodeoxyglukose
- Vennligst les mer om hjertet og revmatisk sykdom i eget kapittel
Nevrosarkoidose
Nevrologiske manifestasjoner kan være både sentral og perifert. Manifestasjoner av nevrosarkoidose forekommer i ca. 5-10% tilfelle og kommer ofte tidlig i sykdomsprosessen, mens perifer nerve-affekson som; mononeuropati, mononeuritt multiplex forekommer relativ sent i sykdomsprosessen. Som anført her tidligere kommer dette relativ ofte med samtidig med øye og sentralnerve manifestasjon og hjertemanifestasjon i en av de fem sarkoidose fenotypene, okulær-hjerte-hud-sentralnervesystem fenotypen (14). Nevrologiske manifestasjoner forårsakes granulomatøs inflammasjon i sentral eller perifer nervesystemet. Symptomer fra nevrosarkoidose kan være svært varierte og sammensatte avhengig av lokalisasjon, utbredelse og progresjon. Symptomer kan variere mellom fokal eller generalisert epilepsi, encefalopati, kognitive, nevropsykiatriske og/eller nevrologiske utfall. I tilfelle affeksjon av hjernehinner kan pasienten presentere med symptomer i form av aseptisk meningitt eller mer kroniske meningitt forandringer. I tillegg kan det utvikles hydrocephalus. Kranial nevropati er det mest vanlige og opp mot 25-50% utvikler perifer Facial (VII) nerve parese, men andre kraniale nevropatier kan forekomme inkl. synsnerve (II) affeksjon. Diagnose kan være utfordrende særlig når nevrologiske manifestasjoner er første manifestasjon for sarkoidose. Spinalvæske undersøkelse kan vise lymfocytose og økt proteininnhold. Det er rapportert økt ACE i spinalvæske, men sensitivitet er anført under 50%. Vennligst les mer om nervesystemet ved revmatisk sykdom i eget kapittel
Annen organmanifestasjon
Sarkoidose kan involvere flere organer inklusivt nasal og paranasale sinuser, munnvanns og parotis kjertler, lever, perifer lymfeknuter, benmarg og milt, der man ser opp mot 40% affeksjon av sarkoidose.
Hyperkalsemi / hyperkalsuri
Hyperkalsemi/hyperkalsuri er relativ vanlig ved sarkoidose og andre granulomatøse sykdommer. Grunnen er at aktiverte makrofager i granulomen kan produsere kalsitriol fra kalsidiol uavhengig av pasientens egen parathyroid hormon (PTH) produksjon. Det er økt CYP27B aktivity primært i makrofager i granulomer (33). Mellom 30-50% av pasienter med sarkoidose utvikler hyperkalsuri, ca. 1/3 del (10-20%) utvikler manifest hyperkalsemi.
Viktigt er primært å forebygge hyperkalsemi med å unngå økt kalsium inntak og D-vitamin og kalsium substitusjon. Økt soling kan også øke D-vitaminnivå.
Behandlingen er å øke væske inntak og behandle underliggende sarkoidose med f.eks. økt steroid behandling. I tilfelle manglende effekt kan man anvende bisfosfonat behandling.
Parasarkoidose syndrom
Ikke granulomatøs parasarkoidose syndrom er samlebegrep for en rekke relativ vanlige symptomer relatert til sarkoidose uten at patogenesen er vel kartlagt. Dette er varierte generelle symptomer som; utmattelse, søvn- og kognitive forstyrrelser, samt og nevropatiske smerter. De symptomene responderer vanligvis dessverre oftest dårlig på granulom-rettet sarkoidose behandling og kan ha en kronisk utvikling (7).
Behandling
Fleste pasienter trenger ingen behandling og tilstanden kan ha mild affeksjon. Før oppstart av behandling bør man ha klart for seg hva er det konkrete behandlingsmålet. Det er bivirkninger til all behandling og det er ingen behandling som er helbredene. Affeksjon av lunger, hjerte og av sentralnervesystem er de mest farlige organmanifestasjonene i tillegg til øyemanifestasjon som ubehandlet kan lede til synstap og blindhet. Hud, og ledd affeksjon, og symptomer som utmattelse og leddsmerter har stor effekt på livskvalitet, men er i grunn ikke livsfarlige.
Første linje behandling
Steroid behandling med initialt med Prednisolon 15-40 mg/d er oftest brukt men det er ingen enighet om dosering og behandlingslengde. Dette er åpenbart individualisert, med henhold til respons/bivirkninger. Behandlingslengde er mellom 3-18 måneder og en snart 15 år gammel Cochrane analyse har ikke vist særlig effekt over 2 års steroid behandling på lungemanifestasjoner (34).
Nærmest all behandling ved sarkoidose er på toppen av steroid behandling og det foreligger ikke god dokumentasjon av monoterapi av sykdomsmodifiserende behandling som også kalles her steroid sparende behandling.
Andre linje steroid sparende behandling
- Methotreksat (MTX) er det best dokumenterte sykdomsmodifiserende behandlingen på sarkoidose særlig på vedvarende og remitterende sykdom. Vanlig dosering er fra 10-20 mg/uke fleste studier på lungesarkoidose har vært brukt relativ lave doseringer 5-15 mg/uken.
- Azathioprin/Imurel® (AZA) er alternativ det har ikke kontraindisert under svangerskap som MTX. Vanlig dosering er 2,0-2,5 mg/kg. Testing av TPMT genotypen i forkanten og videre kan man underveis i behandling estimere effekt med blodprøve for 6TGN som også gir indikasjon for pasientens complianse i tillegg om behandlingen ligger i, under eller over terapeutisk nivå.
- Leflunomid/Arava® 10-20mg/d. Det er flere kasuistiske meddelelser en retrospektiv på 76 pasienter med både pulmonal og ekstrapulmonal og 33 pasienter som etter gjennomsnittlig 16 måneders behandling hadde bedring av FVC og estimert steroidsparende effekt (35-37).
- Mykofenolat mofetil/CellCept® (MMF) 1.000-3.000 mg/d fordelt på 2 doseringer. Kan brukes ved intoleranse mot andre angivelig mer effektive medikamenter som; MTX, AZA og Leflunomid men MMF er vanligvis ikke effektiv hvis disse har feilet.
- Hydroksyklorokin (HCQ) Plaquenil® har demonstrert effekt ved hudaffeksjon og sarkoidose affeksjon på nasalsinuser. Antimalaria behandling er godt dokumentert ved systemiske bindevevssykdommer og på revmatoid artritt. Man anbefaler ikke mer en 5 mg/kg per døgn.
Tredje linje behandling
Tumor nekrosefaktor alfa (TNF-α) inhibitor behandling (TNFi).
TNF-α har en sentral rolle i vedlikehold av granulomer ved sarkoidose. Ved kliniske undersøkelser på sarkoidose er det vist stor forskjell mellom forskjellige TNF-α hemmende medikamenter. TNF-α inhibitorer er ikke registrere for bruk på sarkoidose, men er i utstrakt «off-label» bruk basert på randomiserte studier.
- Best dokumentert er infliksimab som anføres intravenøs 3-5 mg/kg initialt gitt uke 0, 2 og 6 og deretter vedlikehold hver 4-8 uke. Fleste som behandler sarkoidose velger 4-6 ukers intervall i vedlikeholdsbehandlingen (38).
- Adalimumab er dokumentert og det er stor variasjon i hvordan dette brukes og generelt brukes subkutant 40 mg i uken ved alvorlig sarkoidose, men doseringen er 40 mg annen hver uke ved revmatoid artritt (38).
- Humanisert anti-TNF-α antistoffet golimumab har ikke vist forskjell fra placebo i en nylig publisert studie (39).
- Etanercept er human tumornekrosefaktorreseptor p75 Fc fusjonsprotein som gir kompetitiv (TNF)-binding. Entanercept virker dessverre ikke eller lite på sarkoidose og bør ikke brukes (38).
- Det foreligger per dags dato ingen studier eller kasuistikker på bruk av certolizumab/Cimzia® som er et Fab’-fragment av rekombinant, humanisert antistoff mot TNF-α konjugert til polyetylenglykol (PEG).
Som anført tidligere er alle TNFi assosierte til DISR («Drug-induced sarcoidose-like reactions»), men sterkest er dette assosiert til etanercept. Liknende har man sett ved andre tilstander som psoriasis. Der på den ene siden brukes TNFi som behandling og på andre side kan TNFi i enkelttilfeller indusere økt aktivitet i grunnsykdommen.
Andre legemidler dvs. fjerde linje behandling
Subcutan repository corticotropin injeksjon (RCI)/H.P. Acthar® Gel har er adrenocorticotropic hormon (ACTH) analog har vist steroidsparende effekt ved både sarkoidose og revmatoid artritt (40, 41). Medikamentet er ikke registrert i Norge [https://www.acthar.com/healthcare-professional].
Pentoksyfyllin/Trental® er et medikament som brukes som blodfortynnende og har claudicatio intermittent som indikasjon. Det har en effekt på phosphodiesterase-4 (PDE-4) med bl.a. hemmende effekt på TNF. Pentoksyfillin det er vist effekt i dosering 1200-2000 mg/dag (42).
Interleukin-1 hemming: Det pågår fase II studie med planlagt 28 pasienter ved bruk av anakinra ved hjerte-sarkoidose. Anakinra en rekombinert human IL-1 reseptor agoniste som nøytraliserer biologisk aktivitet av interleukin-1α (IL-1α) og interleukin-1β (IL-1β) ved kompetitiv hemming av binding til interleukin-1 type I-reseptor (IL-1RI). I tillegg foregår en fase II studie på canakinumab ved lungesarkoidose som inkluderer 40 pasienter. Canakinumab er et humant monoklonalt IgG1 antistoff mot human interleukin-1 beta (IL-1b), som binder spesifikt IL-1b og nøytraliserer biologisk aktivitet av IL-1b ved å blokkere binding til IL-1-reseptorer.
Janus kinase (JAK) hemmere. Undersøkelser på patogenese sarkoidose samt andre granulomatøs sykdommer har påvist økt aktivitet i Janus kinase (JAK) – signal transducer and activator of transcription (STAT) banene. Innvirkning på JAK-STAT banen er mulig via behandling med JAK inhibitorer med bl.a. hemming av makrofagenes og T-lymfocyttenes produksjon av rekke cytokiner inkludert; Interferon-γ (IFN-γ) og Interleukin-6. Det foreligger en rekke kasuistikker på tilsynelatende effekt på enkelte JAK hemmere der tofacitinib er foreløpig best dokumentert både på hudsarkoidose og multiorgan sarkoidose (43-46). Det foregår en små fase I «open-label» studie med planlagte 15 pasienter på tofacitinib og sarkoidose.
Interleukin-6 hemming: Det foregår fase II studie med 15 pasienter på IL-6 hemming på sarilumab basert på begrenset erfaring på 4 pasienter som hadde steroidsparende effekt av tocilizumab.
Effekten av rituksimab (RTX) på sarkoidose er uavklart. RTX som er et monoklonalt antistoff som består av et glykosylert immunglobulin med human IgG1 konstant region og murine variable regioner. Det bindes spesifikt til det transmembrane antigenet, CD20, et ikke-glykosylert fosfoprotein, som er lokalisert på pre-B- og modne B-lymfocytter. En liten observasjonsstudia på 10 pasienter med refraktær lungesarkoidose viste at halvparten (5/10) hadde effekt på litt innen ½ år mens kun to pasienter hadde vedvarende effekt etter 1 år (2/10) (47). Foreløpig konklusjon er at RTX kan vurderes i refraktære tilfeller, men foreløpig er det begrenset informasjon og ifølge databasen ClinicalTrials.gov databasen er det ingen pågående eller planlagte undersøkelser på B-cellerettet behandling på sarkoidose.
Abatacept er et fusjonsprotein bestående av det ekstracellulære domenet til humant cytotoksisk T-lymfocyttassosiert antigen 4 (CTLA-4) bundet til humant immunglobulin G1. Abatacept modulerer selektivt et kostimulerende nøkkelsignal som er nødvendig for full aktivering av T-lymfocytter som uttrykker CD28. Det er foreløpig svært lite publisert om effekt av abatacept ved sarkoidose. Det foregår en fase II studie med 30 pasienter med behandlingsrefraktær sarkoidose «ABAtacept in patients with treatment-resistant SARCoidosis» ABASARC (48).
Kalsineurin hemmere: Behandling med ciclosporin og takrolimus har ikke vist seg å være særlig effektiv på sarkoidose og bivirkninger av behandlingen overskygger den muligvis begrensete effekten.
Ustekinumab anti-IL-12/23 feilet i en randomiserte studie på sarkoidose (39).
Det foregår randomisert placebokontrollert fase II studie (ClinicalTrials.gov NCT04064242) som med planlagt inklusjon av 66 pasienter på medikamentet CMK389 i regi av legemiddelselskapet Novartis der resultater forventes medio 2023. CMK389 er et anti-Interleukin 18 antistoff.
Antifibrotisk behandling med nintedanib eller prifenidone:
Signifikant lungefibrose utvikles hos omtrent 1/5 del av pasienter med sarkoidose og kan utvikles til sluttfase lungesykdom med bl.a. økt risiko for infeksjoner og utvikling av pulmonal hypertensjon. Antifibrotisk behandling har påvist effekt ved lungefibrose og fibrotiske lungesykdommer assosiert til systemiske bindevevssykdommer der dokumentasjonen er best ved systemisk sklerose. Per dags dato foreligger ingen randomiserte studier på effekt av antibiotisk behandling med nintedanib eller pirfenidone hos pasienter med sarkoidose og lungefibrose. Det foreligger en godt dokumentert kasuistikk på pasient som fikk sarkoid lungeaffeksjon kort tid etter oppstart av behandling hos pasient med idiopatisk lungefibrose på pirfenidone (49). Dette er ikke anført som vanlig bivirkning på medikamentet.
Det foregår randomisert studie på pirfenidone og sarkoidose med lungefibrose. Per dags dato er ikke antifibrotisk behandling anbefalt som konvensjonell behandling hos pasienter med sarkoidose med signifikant lungefibrose, men dette kan evt. vurderes på individuell basis som «off-label» behandling hvis rask utvikling av fibrose og manglende effekt av annen behandling.
Behandling av parasarkoidose symptomer, der utmattelse, trøtthet og/eller smerter med småfibernevropati dominerer er utfordrende. Det finnes ingen randomiserte studier og erfaringen er dessverre at anti-granulom-behandling virker dårlig. Fleste velger å forsøke tidsbegrenset behandling med immunsuppresjons behandling og evt. tidsbegrenset behandling TNFi behandling. Andre ikke medikamentelle behandlingsformer som trening, pusteøvelser og mestringskurs i tillegg til andre behandlingsformer som retter seg mot smerter og dårlig søvnkvalitet.
Figure 6 En generell tilnærming til terapi for sarkoidose fra James WE og Baughman R. Treatment of sarcoidosis: grading the evidence. Expert Rev Clin Pharmacol. 2018;11(7):677-87.
Prognose
De aller fleste pasienter med sarkoidose har god prognose og blir bra av seg selv. Omtrent halvdel til en tredjedel har vedvarende sykdom som krever behandling. Det er økt dødelighet hos pasienter med sarkoidose relatert til generell befolkning og 5 års overlevelse er estimert til å ligge mellom 93-95% i forskjellige undersøkelser. Sammenlignet med generell befolkning er dødeligheten økt mellom 1,6 – 2,4 ganger gjennomsnittsbefolking og er sterkt assosiert til sykdommens alvorlighetsgrad og skyldes som oftest hjerte-, lunge- eller nevrologiske manifestasjoner samt og infeksjoner (7).
Mindre enn 5% dør av Sarkoidose. Dødsårsaker er lungesvikt, hjertesykdom eller at nervesystemet er angrepet (Lannuzzi MC, 2007)
Litteratur
Drent M, Crouser ED & Grunewald J NEJM 2021 “Challenges of Sarcoidosis and Its Management”
Vikse J, 2018 (hjerte-sarkoidose)
Referanser
- Arkema EV, Grunewald J, Kullberg S, Eklund A, Askling J. Sarcoidosis incidence and prevalence: a nationwide register-based assessment in Sweden. The European respiratory journal. 2016 Dec;48(6):1690-9. PubMed PMID: 27471207.
- Haraldsdottir SO, Jorundsdottir KB, Yngvason F, Bjornsson J, Gislason T. [Sarcoidosis in Iceland 1981-2003]. Laeknabladid. 2007 Feb;93(2):105-9. PubMed PMID: 17277405.
- Judson MA, Morgenthau AS, Baughman RP. 66 – Sarcoidosis. In: Broaddus VC, Mason RJ, Ernst JD, King TE, Lazarus SC, Murray JF, et al., editors. Murray and Nadel’s Textbook of Respiratory Medicine (Sixth Edition). Philadelphia: W.B. Saunders; 2016. p. 1188-206.
- Bechman K, Galloway J, Pouchot J. Sarcoidosis. In: Bijlsma JW, Hachulla E, editors. Eular Textbook on Rheumatic Diseases. 3 ed. London: BMJ Publishing Group Ltd; 2018. p. 522-39.
- Sverrild A, Backer V, Kyvik KO, Kaprio J, Milman N, Svendsen CB, et al. Heredity in sarcoidosis: a registry-based twin study. Thorax. 2008 Oct;63(10):894-6. PubMed PMID: 18535119.
- Drent M, Crouser ED, Grunewald J. Challenges of Sarcoidosis and Its Management. The New England journal of medicine. 2021 Sep 9;385(11):1018-32. PubMed PMID: 34496176.
- Grunewald J, Grutters JC, Arkema EV, Saketkoo LA, Moller DR, Müller-Quernheim J. Sarcoidosis. Nature reviews Disease primers. 2019 Jul 4;5(1):45. PubMed PMID: 31273209.
- Carlens C, Hergens MP, Grunewald J, Ekbom A, Eklund A, Höglund CO, et al. Smoking, use of moist snuff, and risk of chronic inflammatory diseases. Am J Respir Crit Care Med. 2010 Jun 1;181(11):1217-22. PubMed PMID: 20203245.
- Cozier YC, Govender P, Berman JS. Obesity and sarcoidosis: consequence or contributor? Curr Opin Pulm Med. 2018 Sep;24(5):487-94. PubMed PMID: 29979212.
- Miedema J, Nunes H. Drug-induced sarcoidosis-like reactions. Curr Opin Pulm Med. 2021 Sep 1;27(5):439-47. PubMed PMID: 34183524.
- Chanson N, Ramos-Casals M, Pundole X, Suijkerbuik K, José de Barros ESM, Lidar M, et al. Immune checkpoint inhibitor-associated sarcoidosis: A usually benign disease that does not require immunotherapy discontinuation. Eur J Cancer. 2021 Aug 25. PubMed PMID: 34452793.
- Crouser ED, Maier LA, Wilson KC, Bonham CA, Morgenthau AS, Patterson KC, et al. Diagnosis and Detection of Sarcoidosis. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med. 2020 Apr 15;201(8):e26-e51. PubMed PMID: 32293205. PMCID: PMC7159433.
- Thillai M, Atkins CP, Crawshaw A, Hart SP, Ho LP, Kouranos V, et al. BTS Clinical Statement on pulmonary sarcoidosis. Thorax. 2021 Jan;76(1):4-20. PubMed PMID: 33268456.
- Schupp JC, Freitag-Wolf S, Bargagli E, Mihailovic-Vucinic V, Rottoli P, Grubanovic A, et al. Phenotypes of organ involvement in sarcoidosis. The European respiratory journal. 2018 Jan;51(1). PubMed PMID: 29371378.
- Eurelings LEM, Miedema JR, Dalm V, van Daele PLA, van Hagen PM, van Laar JAM, et al. Sensitivity and specificity of serum soluble interleukin-2 receptor for diagnosing sarcoidosis in a population of patients suspected of sarcoidosis. PloS one. 2019;14(10):e0223897. PubMed PMID: 31622413. PMCID: PMC6797090.
- Kraaijvanger R, Janssen Bonás M, Vorselaars ADM, Veltkamp M. Biomarkers in the Diagnosis and Prognosis of Sarcoidosis: Current Use and Future Prospects. Front Immunol. 2020;11:1443. PubMed PMID: 32760396. PMCID: PMC7372102.
- Schimmelpennink MC, Vorselaars ADM, Grutters JC. Chapter 19 – Biomarkers in Sarcoidosis. In: Baughman RP, Valeyre D, editors. Sarcoidosis. Philadelphia: Elsevier; 2019. p. 219-38.
- Bergantini L, Bianchi F, Cameli P, Mazzei MA, Fui A, Sestini P, et al. Prognostic Biomarkers of Sarcoidosis: A Comparative Study of Serum Chitotriosidase, ACE, Lysozyme, and KL-6. Dis Markers. 2019;2019:8565423. PubMed PMID: 30944672. PMCID: PMC6421736.
- Yu C. Chapter 10 – Lysosomal storage disorders: Sphingolipidoses. In: Garg U, Smith LD, editors. Biomarkers in Inborn Errors of Metabolism. San Diego: Elsevier; 2017. p. 211-33.
- Judson MA. Granulomatous Sarcoidosis Mimics. Front Med (Lausanne). 2021;8:680989. PubMed PMID: 34307411. PMCID: PMC8295651.
- Scadding JG. Prognosis of intrathoracic sarcoidosis in England. A review of 136 cases after five years’ observation. Br Med J. 1961 Nov 4;2(5261):1165-72. PubMed PMID: 14497750. PMCID: PMC1970202.
- Simonneau G, Montani D, Celermajer DS, Denton CP, Gatzoulis MA, Krowka M, et al. Haemodynamic definitions and updated clinical classification of pulmonary hypertension. The European respiratory journal. 2019 Jan;53(1). PubMed PMID: 30545968. PMCID: PMC6351336
- Bandyopadhyay D, Humbert M. An update on sarcoidosis-associated pulmonary hypertension. Curr Opin Pulm Med. 2020 Jul 27. PubMed PMID: 32740377.
- Baughman RP, Teirstein AS, Judson MA, Rossman MD, Yeager H, Jr., Bresnitz EA, et al. Clinical characteristics of patients in a case control study of sarcoidosis. Am J Respir Crit Care Med. 2001 Nov 15;164(10 Pt 1):1885-9. PubMed PMID: 11734441.
- Sève P, Jamilloux Y, Tilikete C, Gerfaud-Valentin M, Kodjikian L, El Jammal T. Ocular Sarcoidosis. Semin Respir Crit Care Med. 2020 Oct;41(5):673-88. PubMed PMID: 32777852.
- Mochizuki M, Smith JR, Takase H, Kaburaki T, Acharya NR, Rao NA. Revised criteria of International Workshop on Ocular Sarcoidosis (IWOS) for the diagnosis of ocular sarcoidosis. The British journal of ophthalmology. 2019 Oct;103(10):1418-22. PubMed PMID: 30798264.
- Birnie DH, Nery PB, Ha AC, Beanlands RSB. Cardiac Sarcoidosis. J Am Coll Cardiol. 2016 Jul 26;68(4):411-21. PubMed PMID: 27443438.
- Elwazir MY, Bird JG, AbouEzzeddine OF, Chareonthaitawee P, Blauwet LA, Collins JD, et al. Performance of cardiac PET/CT with and without phase analysis for detection of scar in cardiac sarcoidosis: Comparison to cardiac magnetic resonance imaging. J Nucl Cardiol. 2021 Jan 20. PubMed PMID: 33474694.
- Vikse J, Orn S, Jeroen de Romijn B, Greve OJ, Norheim KB. Kardial sarkoidose. Tidsskr Nor Laegeforen. 2018 Feb 20;138(4). PubMed PMID: 29460602.
- Chiu CZ, Nakatani S, Zhang G, Tachibana T, Ohmori F, Yamagishi M, et al. Prevention of left ventricular remodeling by long-term corticosteroid therapy in patients with cardiac sarcoidosis. The American journal of cardiology. 2005 Jan 1;95(1):143-6. PubMed PMID: 15619415.
- Fazelpour S, Sadek MM, Nery PB, Beanlands RS, Tzemos N, Toma M, et al. Corticosteroid and Immunosuppressant Therapy for Cardiac Sarcoidosis: A Systematic Review. J Am Heart Assoc. 2021 Sep 7;10(17):e021183. PubMed PMID: 34472360.
- Birnie DH, Sauer WH, Bogun F, Cooper JM, Culver DA, Duvernoy CS, et al. HRS Expert Consensus Statement on the Diagnosis and Management of Arrhythmias Associated With Cardiac Sarcoidosis. Heart Rhythm. 2014 7//;11(7):1304-23.
- Bollerslev J, Pretorius M, Heck A. Parathyroid hormone independent hypercalcemia in adults. Best practice & research Clinical endocrinology & metabolism. 2018 Oct;32(5):621-38. PubMed PMID: 30449545.
- Paramothayan NS, Lasserson TJ, Jones PW. Corticosteroids for pulmonary sarcoidosis. Cochrane Database Syst Rev. 2005 Apr 18(2):Cd001114. PubMed PMID: 15846612.
- Sahoo DH, Bandyopadhyay D, Xu M, Pearson K, Parambil JG, Lazar CA, et al. Effectiveness and safety of leflunomide for pulmonary and extrapulmonary sarcoidosis. The European respiratory journal. 2011 Nov;38(5):1145-50. PubMed PMID: 21565914.
- Majithia V, Sanders S, Harisdangkul V, Wilson JG. Successful treatment of sarcoidosis with leflunomide. Rheumatology (Oxford). 2003 May;42(5):700-2. PubMed PMID: 12709556.
- Bohelay G, Bouaziz JD, Nunes H, Rybojad M, Bagot M, Petit A, et al. Striking leflunomide efficacy against refractory cutaneous sarcoidosis. J Am Acad Dermatol. 2014 May;70(5):e111-3. PubMed PMID: 24742855.
- James WE, Baughman R. Treatment of sarcoidosis: grading the evidence. Expert Rev Clin Pharmacol. 2018 Jul;11(7):677-87. PubMed PMID: 29883224.
- Judson MA, Baughman RP, Costabel U, Drent M, Gibson KF, Raghu G, et al. Safety and efficacy of ustekinumab or golimumab in patients with chronic sarcoidosis. The European respiratory journal. 2014 Nov;44(5):1296-307. PubMed PMID: 25034562.
- Gillis T, Crane M, Hinkle C, Wei N. Repository corticotropin injection as adjunctive therapy in patients with rheumatoid arthritis who have failed previous therapies with at least three different modes of action. Open access rheumatology : research and reviews. 2017;9:131-8. PubMed PMID: 28790870.
- Baughman RP, Sweiss N, Keijsers R, Birring SS, Shipley R, Saketkoo LA, et al. Repository corticotropin for Chronic Pulmonary Sarcoidosis. Lung. 2017 Jun;195(3):313-22. PubMed PMID: 28353116. PMCID: PMC5437201.
- Park MK, Fontana, Jr., Babaali H, Gilbert-McClain LI, Stylianou M, Joo J, et al. Steroid-sparing effects of pentoxifylline in pulmonary sarcoidosis. Sarcoidosis, vasculitis, and diffuse lung diseases : official journal of WASOG. 2009 Jul;26(2):121-31. PubMed PMID: 20560292. PMCID: PMC2946799.
- Talty R, Damsky W, King B. Treatment of cutaneous sarcoidosis with tofacitinib: A case report and review of evidence for Janus kinase inhibition in sarcoidosis. JAAD Case Rep. 2021 Oct;16:62-4. PubMed PMID: 34522749. PMCID: PMC8427262.
- Damsky W, Young BD, Sloan B, Miller EJ, Obando JA, King B. Treatment of Multiorgan Sarcoidosis With Tofacitinib. ACR Open Rheumatol. 2020 Feb;2(2):106-9. PubMed PMID: 31916703. PMCID: PMC7011417.
- Damsky W, Thakral D, Emeagwali N, Galan A, King B. Tofacitinib Treatment and Molecular Analysis of Cutaneous Sarcoidosis. The New England journal of medicine. 2018 Dec 27;379(26):2540-6. PubMed PMID: 30586518.
- Friedman MA, Le B, Stevens J, Desmarais J, Seifer D, Ogle K, et al. Tofacitinib as a Steroid-Sparing Therapy in Pulmonary Sarcoidosis, an Open-Label Prospective Proof-of-Concept Study. Lung. 2021 Apr;199(2):147-53. PubMed PMID: 33825964. PMCID: PMC8092019.
- Sweiss NJ, Lower EE, Mirsaeidi M, Dudek S, Garcia JG, Perkins D, et al. Rituximab in the treatment of refractory pulmonary sarcoidosis. The European respiratory journal. 2014 May;43(5):1525-8. PubMed PMID: 24488568. PMCID: PMC4167390.
- Frye BC, Rump IC, Uhlmann A, Schubach F, Ihorst G, Grimbacher B, et al. Safety and efficacy of abatacept in patients with treatment-resistant SARCoidosis (ABASARC) – protocol for a multi-center, single-arm phase IIa trial. Contemp Clin Trials Commun. 2020 Sep;19:100575. PubMed PMID: 32551397. PMCID: PMC7292904.
- Kolaitis NA, Kukreja J, Jones KD, Hays SR, Leard LE. Pirfenidone-Induced Sarcoid-Like Reaction: A Novel Complication. Chest. 2018 Oct;154(4):e89-e92. PubMed PMID: 30290953.
