ARTRITT (REV 006-REV 020)
26 Infeksiøs (septisk) artritt, infeksjon i ledd. Tuberkuløs (Tbc) artritt. Tuberkulose. Osteomyelitt (REV 077, REV 171)
Øyvind Palm and Jan Tore Gran
Kjennetegn på infeksiøs/septisk artritt
Immunsupprimerte, sprøytenarkomane, diabetes og gamle er mest utsatt.
Nattesvette, feber eller subfebrilitet.
Akutt og smertefull artritt i ett, sjeldnere i flere ledd.
Tuberkuløs artritt, borrelia-artritt, Kingella kingae blant barn og infeksjon hos sterkt immunsupprimerte debuterer mindre dramatisk.
CRP, SR og neutrofile leukocytter forhøyet.
Diagnose ved leddvæske-PCR, mikroskopi eller dyrkning og blodkulturer.
Diagnosekoder ICD-10: M00.9 (septisk artritt); M86 (osteomyelitt); A18.0 (tuberkulose i skjelett)
Prosedyrekoder: Mikroskopi av leddvæske: NXFT05. Leddvæskeundersøkelse i polarisert lys: NXFT05. Leddpunksjon/artrocentese (klikk for å spesifisere ledd:) TN_10. UL veiledet leddpunksjon: NXA10K. Intravenøs infusjon: WBGM00. EKG FPFE15
Definisjon
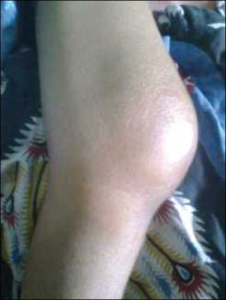
Infeksiøs/septisk/purulent artritt er en infeksjon i ledd, vanligvis forårsaket bakterier (også mykobakterier), sjeldnere sopp, virus eller andre sjeldne mikrober. Infeksjonen kan stamme fra hematogen spredning, fra huden omkring leddet eller et penetrerende traume. Rask og korrekt diagnose innen 1-2 døgn er avgjørende for å hindre alvorlig leddskade og kan i noen tilfeller være livreddende (Ifeany I, 2021). Samarbeid med infeksjonsmedisinere er ofte nødvendig.
Septisk artritt må skilles fra krystallartitt (urinsyregikt og pyrofosfat-artritt/kondrokalsinose), reaktiv artritt og juvenil idiopatisk artritt (barn) som initialt kan ha lignende symptomer.
Synonyme betegnelser for infeksiøs artritt er septisk eller purulent artritt. Infeksiøs artritt omfatter også tuberkuløs artritt med mykobakterier (se nedenfor). I dette kapitlet omtales også osteomyelitt (se nedenfor). Infeksjon i leddproteser og graft er beskrevet i eget kapittel.
Epidemiologi
Insidensen av infeksiøs artritt varierer mellom 2-11/100.000 innbyggere årlig, avhengig av risikofaktorer. Forekomsten er betydelig høyere hos personer med revmatisk sykdom og leddproteser (Mathews CJ, Lancet. 2010; Geirsson AJ, 2007).). Risikoen for bakteriell artritt etter intraartikulær steroidinjeksjon utført av erfarne leger er lav (0,01-0,037%) (Geirsson AJ; Hartmann H, 2000). Ved punksjon uten steroidinjeksjon antas faren å være mindre, da man ikke får lokal immunsuppresjon. Infeksjonsfaren er størst i store ledd og hos immunsupprimerte personer.
Ved ekstrapulmonal tuberkulose kan ledd og skjelett angripes (tuberkuløs artritt) hos 10-11% og ses dobbelt så hyppig hos kvinner sammenliknet med menn. Innvandrere fra land med høy tuberkulose forekomst er spesielt utsatt.
Blant barn er forekomsten høyest ved 2-3 års alder. Voksne med seksuell risikoadferd er særlig utsatt for gonokokk-artritt og HIV-relaterte infeksjoner. Alder over 80 år er en risikofaktor, særlig kombinert med diabetes, revmatoid artritt, nylig ledd-kirurgi/proteser eller hud-infeksjoner.
Patogenese
Synovialhinnen mangler en beskyttende basalmembran, noe som gjør at bakterier lettere kan invadere leddet, vanligvis via hematogen spredning ved bakteriemi. Bakterienes tiltrekning til ledd kan også å skyldes mikrobielle overflatestrukturer som binder seg til intraartikulære strukturer (Ifeany I, 2021). Tuberkelbakterier kan også spre seg fra lungene til ryggvirvlene (tuberkuløs spondylitt) via paravertebrale vener eller lymfeknuter. Direkte infeksjon ved artrocentese (leddpunksjon), artroskopi eller spredning fra lokal infeksjon er også vanlige sykdomsårsaker.
Når mikroorganismer er kommet inn i leddet, forårsaker inflammatoriske mediatorer akutt inflammasjon og destruksjon av brusk og benvev (Goldenberg DL Lancet. 1998). Bakterielle toksiner kan også bidra til skadene (Smith IDM, 2018).
Risikofaktorer.
Personer med underliggende medisinske tilstander, som revmatisk sykdom, diabetes, immunsuppresjon (på grunn av medikamenter som kortikosteroider, biologiske legemidler, DMARDs og cytostatika), eller ernæringssvikt (for eksempel på grunn av alkoholisme), har økt risiko for å utvikle infeksiøs artritt. En nederlandsk studie viste at 84% av voksne med leddinfeksjon hadde bakenforliggende medisinsk sykdom og 59% hadde kjent leddsykdom (Kaandorp CJ, 1997).
Andre risikofaktorer inkluderer intravenøst stoffmisbruk, leddkirurgi, kirurgi i urinveiene og høy alder (Wu C-J, 2017).
Risikofaktorer for infeksiøs artritt (Horowitz DL, 2011)
Smitte: Spredning fra hud og infiserte sår.
Direkte implantering
Hematogen spredning ved disposisjoner
- Alder over 80 år
- Artrose
- Bakteriemi og sepsis av andre årsaker
- Diabetes mellitus
- HIV
- Immunsuppressive medikamenter
- Intravenøs narkomani
- Leversykdom, kronisk
- Protese-ledd
- Revmatoid artritt
- Seksualpartnere (multiple) (gonokokker)
- Venekateter
Mikrobiologiske agens ved infeksiøs artritt
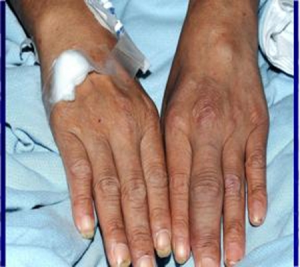
Voksne
Nesten alle mikroorganismer kan forårsake infeksiøs artritt hos voksne. Omtrent 80% av tilfellene er non-gonokokk-bakterier, hvorav staphylococcus aureus, streptokokker gramnegative bakterier er de vanligste. Mykobakterier, inkludert tuberkulosebakterier, kan også forårsake infeksiøs artritt (se nedenfor). Borreliose-artritt er en spesiell form for infeksiøs artritt, forårsaket av Borrelia burgdorferi.
Gonokokker. Neisseria gonorrheae er den vanligste årsaken til infeksiøs artritt hos unge, seksuelt aktive menn. I Norge ses 1-2 tilfeller av gonokokkartritt årlig. Årsaken er vanligvis en spredning av gonore-infeksjnen gjennom blodet (disseminert infeksjon). Personer med komplement-mangel (immunsvikt), enten idiopatisk eller sekundært til for eksempel systemisk lupus erythematosus (SLE), er spesielt utsatt for systemisk gonore-infeksjon (Luttro O, 2016).
Barn
Kingella kingae. Blant barn i 6-36 måneders alder er bakterien Kingella kingae den vanligste årsaken til infeksiøs artritt og osteomyelitt. Bakterien ble beskrevet i 1960, og siden 1990-årene har en i økende grad blitt oppmerksom på dens rolle for muskelskjelett infeksjoner hos barn. Typisk for denne infeksjonen er uspesifikke symptomer over lang tid, fravær av feber og lav eller normal CRP i blodet. Blodkulturer og dyrkning av leddvæske er viktige diagnostiske verktøy. Behandlingen består av antibiotika, og i noen tilfeller kan drenasje eller skylling av større, infiserte ledd være nødvendig (Wong M, 2020; Nordal E, 2004).
Hos nyfødte er gruppe B streptokokker, Stafylococcus aureus, Neisseria gonorrhea og gramnegative bakterier vanlige årsaker til infeksiøs artritt.
Eldre barn kan får infeksjon med Haemophilus Influenza. Hos immunsupprimerte barn påvises ofte gramnegative bakterier.
Symptomer på infeksiøs artritt
Infeksiøs artritt kan gi ulike symptomer, avhengig av årsak, lokalisasjon og pasientens immunstatus. Atypisk forløp med mindre inflammasjon og fravær av feber er vanlig blant immunsupprimerte.
Allmenntilstand. Høy feber, frostrier, nattesvette, men også subfebrilitet og lite påvirket allmenntilstand er vanlig.
Leddmanifestasjoner. I 80 % av tilfellene rammes kun ett ledd (monoartritt), oftest med betydelige smerter. Det affiserte leddet er varmt, hovent og ofte rødt. Kne, hofte og skulder er de vanligste lokalisasjonene. Hos personer som injiserer rusmidler, kan mer uvanlige ledd som sternoclavicularleddet og iliosakralleddene være involvert. Bakteriell artritt i iliosakralleddene er ofte assosiert med samtidig urinveisinfeksjon. Hos barn er hofteleddet mest utsatt.
Andre symptomer. Ved infeksiøs artritt kan det også forekomme symptomer fra andre organer, avhengig av årsaken til infeksjonen. For eksempel kan infeksjon med Staphylococcus aureus gi hudinfeksjoner som abscesser eller cellulitt.
-Gonokokker. Typisk for gonokokk-artritt er purulent artritt (se eget kapittel om leddvæske-undersøkelse) eller et syndrom med tenosynovitt, dermatitt (makler og vesikler på truncus) og polyartralgi (Lutro O, 2016).
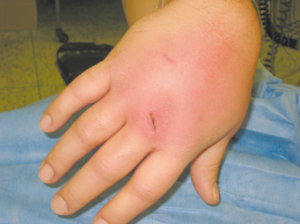
Undersøkelser
Sykehistorien er viktig for å kartlegge disponerende faktorer for infeksiøs artritt, som underliggende sykdommer, immunsuppresjon, nylig kirurgi eller infeksjoner andre steder i kroppen. En spør også om typiske symptomer som feber, frysninger, nattesvette og smerter i ett eller flere ledd.
Klinisk undersøkelse avdekker vanligvis ett (sjeldnere flere) smertefullt, varmt og hovent ledd med nedsatt bevegelighet. Pasienten kan også ha feber og andre tegn på infeksjon. Det er viktig å undersøke for tegn på infeksjoner i andre organer, som kan være kilden til spredning til leddet, samt for tegn på underliggende sykdommer som kan øke risikoen for infeksiøs artritt.
Blodprøver er sentrale i utredningen av infeksiøs artritt. CRP, senkningsreaksjon (SR) og procalsitonin er oftest betydelig forhøyet. Leukocytose med granulocytose ses hos de fleste pasienter.
Serum procalcitonin har lav sensitivitet (ca. 55 %), men høy spesifisitet (94%) for diagnosen akutt bakteriell artritt. Det er viktig å merke seg at procalcitonin også kan være forhøyet ved ikke-infeksiøse inflammatoriske sykdommer som revmatoid artritt (Ng K-I, 2020). Derfor kan grensen for patologiske verdier settes noe høyere hos pasienter med revmatisk sykdom. CRP har høy sensitivitet (nær 100 %) ved infeksjon, men lavere spesifisitet (40 %), da det også kan være forhøyet ved ikke-infeksiøs betennelse.
Blodkulturer er positive hos ca. 50 % av pasientene med infeksiøs artritt. Urinprøve bør også undersøkes for å utelukke urinveisinfeksjon som mulig årsak til spredning av infeksjonen.
Analyse av leddvæske er avgjørende for å stille diagnosen infeksiøs artritt. Leddvæske aspireres før oppstart av antibiotikabehandling og sendes til mikrobiologisk laboratorium for PCR-undersøkelse, dyrkning og eventuelt mikroskopi med Gram-farging. Leddvæsken ved infeksiøs artritt inneholder vanligvis et høyt antall hvite blodceller (> 50 000), hovedsakelig nøytrofile granulocytter, og er ofte blakket og lite viskøs. Hvis lite leddvæske, kan spyling med 0,9% NaCl være til hjelp. Påvisning av agens lykkes i knapt 70% av tilfellene (Garcia-Arias M, 2011). PCR-undersøkelse er særlig nyttig for å påvise Borrelia og mykobakterier. Vennligst se også eget kapittel om leddvæskeanalyser.
Bildediagnostikk. MR-undersøkelser kan vise artritt og bruskskade, samt benmargsødem som ofte er mer uttalt ved infeksiøs artritt enn ved ikke-infeksiøs artritt eller spondylitt. Røntgen eller CT kan vise raskt utviklende destruksjon av benvev. I columna kan man se redusert høyde av mellomvirvelskiven, erosjon i dekkplaten og etter hvert ødeleggelse og kollaps av vertebra med dannelse av paravertebrale abscesser. MR-undersøkelse kan også beskrive spondylodiskitt. Periartikulær muskel ødem er en viktig markør kombinert med tykk kapsulitt (> 5 mm), ekstrakapsulær væskeansamling og betydelig skjeletterosjon (Mease P, 2022).
Bakterie-dyrkning fra infisert leddvæske påviser agens i 90% av tilfellene ved ikke-tuberkuløs infeksjon.
Ved borrelia-artritt er dyrkningen negativ, men påvisning ved PCR gjøres hos 85%.
Methicillin-resistente s. aureus (MRSA) er et økende problem ved infeksiøs artritt, men utgjør ennå en liten andel.
Diagnosen
Diagnosen infeksiøs/septisk artritt stilles ved påvisning av bakterier i leddvæske. Leddvæsken aspireres før oppstart av antibiotikabehandling og sendes til PCR-undersøkelse og/eller dyrkning. I tillegg kan man gjøre mikroskopi med utstryk og Gram-farging av leddvæsken. Blodkultur tas alltid, men positiv oppvekst av bakterier varierer avhengig av infeksjonstypen.
Neumanns klassifikasjon brukes for å klassifisere infeksiøs artritt:
- Gruppe I: Positiv dyrkning av mikrober i leddvæske
- Gruppe II: Negativ dyrkning av mikrober i leddvæske, men positiv kultur fra annet organ og kliniske funn.
- Gruppe III: Klinisk mistanke, negative kulturer, blakket leddvæske, positiv histologi eller typiske røntgenforandringer.
Differensialdiagnoser
Disse tilstandene kan alle presentere seg med leddhevelse, smerte og inflammasjon, og dermed etterligne infeksiøs artritt, noe som krever grundig differensialdiagnostikk i revmatologisk praksis:
- Borrelia-artritt: Forårsaket av Borrelia burgdorferi etter flåttbitt, kan gi monoartikulær eller oligoartikulær artritt, ofte i kneet, med mulig assosiert erythema migrans og systemiske symptomer som feber og tretthet.
- Juvenil artritt (oligoartikulær eller entesitt-relatert type): Disse undergruppene av JIA kan gi asymmetrisk oligoartritt, ofte i nedre ekstremiteter, med mulig assosiert entesitt og systemiske symptomer som feber og uveitt.
- Kondrokalsinose (pyrofosfatartritt): Avleiring av kalsiumpyrofosfat krystaller i ledd kan forårsake akutt eller kronisk artritt, ofte i kne eller håndledd, med leddhevelse, smerte og bevegelsesinnskrenkning.
- Reaktiv artritt og andre spondyloartritter: Disse inflammatoriske leddsykdommene kan gi asymmetrisk oligoartritt, ofte i nedre ekstremiteter, med mulig assosiert entesitt, daktylitt og ekstra-artikulære manifestasjoner som uveitt og hudutslett.
- Urinsyregikt: Avleiring av urinsyrekrystaller i ledd forårsaker akutt inflammatorisk artritt, oftest i stortåen (podagra), med intens smerte, hevelse, rødhet og varme.
Behandling
Rask oppstart av antibiotikabehandling: Empirisk antibiotikabehandling initieres umiddelbart ved mistanke om septisk artritt. Men før oppstart av antibiotika skal det tas prøver av leddvæske (artrocentese) og blodkulturer for mikrobiologisk diagnostikk.
- Intravenøs behandling med dikloksacillin eller klindamycin (ved penicillinallergi) er vanlig.
- Tillegg av gentamicin eller cefotaksim som monoterapi vurderes basert på klinisk vurdering og sannsynlig patogen.
- Når resultat av resistensbestemmelse foreligger, justeres antibiotikavalg og dosering.
- Antibiotikabehandlingens varighet avhenger av agens (sykdomsfremkallende mikroorganisme) og utbredelse, men varer vanligvis flere uker. (Legemiddelhåndboken sist oppdatert 15.11.2023).
Leddavlastning og fysioterapi:
- Affisert ledd avlastes de første 2-3 dagene.
- Tidlig oppstart av aktiv fysioterapi er viktig for å opprettholde leddfunksjon og forebygge muskelatrofi.
Ledd-drenasje
- Gjentatte artrocenteser utføres for å drenere større ledd inntil væskeproduksjonen avtar.
- Hofteleddsaffeksjon krever som regel kirurgisk drenasje på grunn av leddets anatomi.
Behandlingsvarighet:
- Varigheten av antibiotikabehandlingen er avhengig av patogen og infeksjonens omfang, men varer vanligvis i flere uker.
Behandling av osteomyelitt
Tidlig diagnose og behandling er avgjørende for å forebygge sekveler som benvevsdestruksjon og kronisk infeksjon. Ubehandlet osteomyelitt kan gi sepsis.
Langvarig antibiotikabehandling: Osteomyelitt krever langvarig antibiotikabehandling, vanligvis over flere måneder. Valg av antibiotika baseres på resultat av mikrobiologisk diagnostikk og resistensbestemmelse.
- Kirurgisk intervensjon: I tilfeller med abscessdannelse eller nekrotisk benvev kan kirurgisk debridement være nødvendig.
Tuberkuløs artritt
Tuberkulostatisk behandling: Behandles med en kombinasjon av tuberkulostatika i henhold til gjeldende retningslinjer. Behandlingen koordineres ofte med spesialister innen lungesykdommer, infeksjonsmedisin eller pediatri (se avsnitt nedenfor på denne siden).
Prognose
Septisk artritt kan medføre alvorlige komplikasjoner, inkludert:
- Bakteriell fasciitt: Infeksjon i fascievevet.
- Osteomyelitt: Benmargsinfeksjon.
- Sepsis: Hematogen spredning av infeksjonen.
Uten adekvat behandling er mortaliteten ved septisk artritt betydelig høy, historisk sett rapportert til å være opp mot 60-70 %. Med moderne antibiotikaterapi har mortaliteten blitt redusert, men den ligger fortsatt mellom 10-20 %, avhengig av pasientens komorbiditet og risikofaktorer.
Risikofaktorer for dårligere prognose:
- Høyere alder (≥ 65 år)
- Pre-eksisterende sykdommer, som nyre- eller hjertesykdom
- Immunsuppresjon
- Polyartikulær infeksjon
Det er observert en økning i mortalitet hos eldre pasienter med septisk artritt, sannsynligvis relatert til økt forekomst av komorbiditet i denne aldersgruppen (Wu CJ, 2017).
Funksjonelt utfall: Etter avsluttet antibiotikabehandling vil omtrent 50 % av pasientene med Staphylococcus aureus-infeksjon oppnå full gjenvinning av leddfunksjon. Ved pneumokokkinfeksjon er prognosen generelt bedre, med opptil 95 % gjenvinning av leddfunksjonen.
Alvorlige tilfeller kan kreve kirurgiske inngrep som:
- Leddprotese
- Artrodese
- Amputasjon
Den totale mortaliteten ved septisk artritt er estimert til rundt 11 %.
Proteseinfeksjoner:
- Infeksjoner i leddproteser og graft har en distinkt etiologi og patogenese, og behandles på en annen måte. Infeksjon i proteser og graft er beskrevet i et eget kapittel
Retningslinjer, anbefalinger og prosedyrer
EULAR 2022 (Fraguolis GR, 2022; screening for opportunistiske infeksjoner)
EULAR 2016 (Combe B, Management early arthritis)
ACR 2017 (Ringhold S, 2017; JIA og tbc)
Internasjonalt 2014 (Inanone F, 2014)
Vennligst les mer om behandlingsretningslinjer i eget kapittel
Mykobakterier / tuberkulose og revmatisk sykdom
Årsak og risikofaktorer. Tuberkuløs artritt/spondylitt skyldes infeksjon med Mycobacterium tuberculosis. Latent infeksjon kan være til stede i makrofager i årevis før den reaktiveres til aktiv sykdom. Immunsuppresjon, som ved bruk av høye doser kortikosteroider, biologiske legemidler eller JAK-hemmere, øker risikoen for reaktivering. Høy alder og underliggende revmatisk sykdom er også risikofaktorer (Winthrop KL, 2018; Winthroipn KL, 2016). For eksempel er risikoen for tuberkuløs artritt firedoblet hos pasienter med revmatoid artritt (Zafari P, 2020).
Forekomst: Tuberkuløs artritt er dobbelt så hyppig hos kvinner som hos menn. Immunsuppresjon øker risikoen, og blant innvandrere er tuberkulose hyppigst hos somaliere. Globalt forårsaker tuberkulose 1,6 millioner dødsfall årlig, men er relativt sjelden i Norge.
Symptomer: Sykdomsutviklingen er ofte gradvis, og mindre enn 50% av pasientene med artritt eller osteomyelitt har tegn til tuberkulose ved diagnosetidspunkt. Vertebra angripes oftest (spondylitt opptil 50%) og betegnes Potts sykdom (Percivall Pott, 1779). Vanligvis påvises kun én lesjon, men multifokal tuberkulose forekommer også. Ved artritt oppleves smerte ved gange. (Se også avsnitt om “Symptomer” nedenfor).
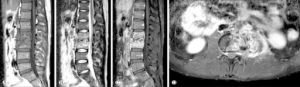
Hos pasienter med aktiv tuberkulose kan det i sjeldne tilfeller oppstå reaktiv artritt (Poncets sykdom), uten påvisbare infeksiøs agens i de affiserte leddene. Disse pasientene har ofte polyartritt og hudsymptomer som erythema nodosum (Nyo MTL, 2018).
Diagnosen: Diagnosen stilles ved PCR eller dyrkning av blod eller infisert vev (biopsi). Biopsi bør tas fra dype strukturer som ben, abscesser og synovialhinne. Mikroskopi med Ziehl-Neelsens metode, auramin-rhodamin eller PCR og dyrkning av aspirat eller biopsimateriale kan også benyttes. IGRA-testen verken bekrefter eller utelukker aktuell tuberkuløs-sykdom.
Screening: Screening for tuberkulose bør gjøres hos alle pasienter som skal starte behandling med biologiske legemidler (bDMARDs) eller JAK-hemmere (tsDMARDs). Screening kan også vurderes før oppstart med konvensjonelle DMARDs (csDMARDs) og ved langvarig bruk av høye doser kortikosteroider (f.eks. prednisolon > 15 mg/dag i mer enn 4 uker) (Fragoulis GE , 2022).
Behandling med tuberkulostatika utføres i samarbeid med spesialister i lungesykdommer, infeksjonsmedisin eller pediatri, og og består av tuberkulostatika.
Smittesporing og smittevern. I helseinstitusjoner er det viktig med tett samarbeid mellom behandlende helsepersonell, smittevernpersonell og tuberkulosekoordinator for raskest mulig å iverksette infeksjonsforebyggende tiltak. Det er viktig at pasienten og pårørende får god informasjon om hvorfor isolering iverksettes. Tvangstiltak er mulig, men vil svært sjelden være aktuelt (Folkehelseinstituttet 17.11.2022), Smittevernhåndboken og lokale metodebøker.
Litteratur: Gardams & Lim. 2005
Osteomyelitt
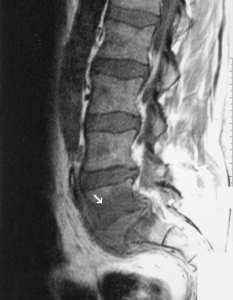
Definisjon. Osteomyelitt er en infeksjon i beinvev, som kan oppstå enten ved hematogen spredning (via blodet) av bakterier eller andre mikroorganismer fra et annet infeksjonsfokus (diabetisk fot, proteser, graft), eller ved direkte spredning fra infisert vev i nærheten (Mylona E, 2009). Både trabekulært og kortikalt bein, samt benmarg og periost kan bli infisert.
Årsak. Den vanligste årsaken til både akutt og kronisk hematogen osteomyelitt hos både barn og voksne er bakterien Staphylococcus aureus. Hos barn er gruppe A-streptokokker, Streptococcus pneumoniae og Kingella kingae de nest vanligste mikrobene, mens gruppe B-streptokokker er vanligst hos nyfødte. Barn er spesielt utsatt for hematogen osteomyelitt på grunn av høy vaskularisering i vekstsoner i metafysene i de lange rørknoklene.
Hos voksne er Stafylococcus aureus også hovedårsaken til proteseinfeksjon. Ved infeksjon som sprer seg direkte fra infisert vev i nærheten, er det vanligere med blandingsflora (Mylona E, 2009). Det er en økende forekomst av MRSA (methicillin-resistente S. aureus). Ved kronisk osteomyelitt ses også Staphylococcus epidermidis, Pseudomonas aeruginosa, Serratia marcescens, og Escherichia coli. Mykobakterier og sopp er sjeldne årsaker.
Hematogen spredning av mikrober er sjeldnere hos voksne enn hos barn og rammer oftest vertebralt. Diabetes er den vanligste disponerende faktoren i befolkningen, mens immunsuppresjon med kortikosteroider, DMARDs og biologiske legemidler er viktige risikofaktorer hos revmatiske pasienter.
Symptomer.
Symptomene på osteomyelitt kan være uspesifikke og vanskelige å gjenkjenne (Hatzenbuehler J, 2011). De inkluderer:
- Kronisk smerte lokalisert til det infiserte området
- Fistler (unormale ganger mellom organer eller vev)
- Sårsekresjon (væske fra sår)
- Redusert sårtilheling
- Tretthet
- Feber (hos noen pasienter)
Ved infeksiøs spondylitt angripes lumbal- thorakal og cervicalcolumna i avtakende hyppighet. Cervical ostomyelitt ses i 4-6% ac alle binfeksiøse spondylitter, men kan ha et alvorlig forløp preget av smerter og nevrogene utfall. Smerter ved gange være et fremtredende symptom. Cervical (nakke) osteomyelitt er sjelden, men kan gi alvorlige symptomer som smerter og nevrologiske utfall. Symptomer og bildediagnostikk kan vanskelig skille fra malignitet, slik at biopsi ofte er nødvendig (Stangeland KW, 2022).
-Barn utvikler vanligvis systemiske symptomer som feber og irritabilitet innen to uker etter infeksjonsstart. Lokalt erythem, hevelse og smerte over det affiserte området er også typisk. Kronisk osteomyelitt er sjelden hos barn (Auh J, 2004).
-Voksne kan lettere utvikle kronisk osteomyelitt, vanligvis sekundært til åpne frakturer, spredning fra infiserte bløtdeler eller hematogent. Etter åpen fraktur kan infeksjon ses hos hele 27% (Pollak AN, 2010).
Blodprøver og benmargsbiopsi. Blodprøver viser ofte økt CRP, SR, procalcitonin og leukocytose (neutrofili). Oppvekst av mikrober i blodkulturer. Dyrkning eller PCR av materiale fra finnålsbiopsi av benmarg kan bekrefte diagnosen.
Bildediagnostikk. Røntgenforandringer kan sees tidligst etter to uker og gir en god oversikt over skjelettet. Ultralyd kan påvise bløtdelshevelse, fortykkelse av beinhinnen (periost) og væskeansamling under beinhinnen. MR er den mest nyttige undersøkelsen for å skille mellom bløtdelsskader/infeksjon og skjelettmanifestasjoner. PET/CT kan vise økt aktivitet i det infiserte området, men er en kostbar undersøkelse med begrenset tilgjengelighet. CT gir vanligvis lite tilleggsinformasjon og brukes sjelden. Ved infeksiøs spondylitt vil spondylodiskitt indikere bakteriell årsak, mens soppinfeksjon typisk involverer bare virvlene (Stangeland KW, 2022).
Behandling. Antibiotikabehandling igangsettes etter mikrobiologisk diagnostikk, ofte i samarbeid med infeksjonsmedisiner. Ved manglende respons på antibiotika kan kirurgisk/ortopedisk behandling med debridement være nødvending.
Norsk Legemiddelhåndbok (utgave 23.06.2023) anbefaler Empirisk antibiotika ved akutt osteomyelitt, inkl. spondylodiskitt: Kloksacillin 2 g x 4. Hos septiske pasienter og hos personer med særlig risiko for gramnegativ etiologi gis i tillegg gentamicin 6–7 mg/kg x 1, ev. cefotaksim 2 g x 3 i monoterapi.
Infeksjon i proteser og graft er beskrevet i et eget kapittel.
Litteratur
- Ifeany I, 2023
- Gran et al. Tidsskriftet 1993; 113: 518-4
- Horowitz DL, 2011
- Methws CJ, 2010
- Geirsson AJ, 2007
- Malaviya AN, 2003 (Tuberkuløs artritt)
- Hogan JI, 2017 (Tuberkuløs muskel-skjelett-affeksjon)
- Folkehelseinstituttet.no (Tuberkulose)
- Maffulli N, 2016 (Osteomyelitt)
- Hatzenbuehler J, 2011 (Osteomyelitt)
