BINDEVEVSSYKDOMMER (REV 021-033)
62 Sjøgrens syndrom, Sjøgrens sykdom (REV 021)
Sjøgrens syndrom
Øyvind Palm and Jan Tore Gran
Diagnosekoder ICD-10: M35.0 (Sjøgrens); R68.2 Tørr munn
Prosedyrekoder: Schirmers test: CCFX05, Sialometri: ELFC00, EKG: FPFE15
Nøkkelord for journalskriving
Diagnosen basert på
- Daglig tørr i øyne og/eller øyne
- Schirmer ≤ 5mm/5 min. på minst ett øye
- Sialometri ≤ 1,5ml/15 min.
- Ev. øyelege-funn ved fargeskår
- Ev. leppebiopsi med fokusskår ≥ 1
- Vaginal sicca
- Artritt, parotitt, lymfadenopati, purpura, nevropati, utmattelse/fatigue, pulmonale symptomer eller funn
- Non-Hodgkins lymfom
- SSA antistoff (titer)
- IgG økt, lymfopeni, C3 og/eller C4 lave
Medikamenter
Hensikten med konsultasjonen
Innhold
- Definisjon
- Historikk
- Epidemiologi
- Genetikk
- Etiologi og patogenese
- Symptomer og kliniske uttrykksformer
- Undersøkelser
- Diagnose
- Klassifikasjonskriterier
- Differensialdiagnoser
- Svangerskap ved Sjøgrens syndrom
- Behandling
- Prognose
- Kontroller og oppfølging
- Retningslinjer
- Litteratur
1. Definisjon
Sjøgrens syndrom (Sjøgrens sykdom) er en systemisk, kronisk autoimmun bindevevssykdom som rammer kvinner i mer enn 90 % av tilfellene. De fleste diagnostiseres i 40–60-årsalderen, men sykdomsdebut forekommer gjerne flere år tidligere (Negrini S, 2022). Tilstanden kjennetegnes av autoimmun inflammasjon med lymfocyttinfiltrasjon og påfølgende destruksjon av eksokrint kjertelvev, en autoimmun eksokrinopati. Skaden på eksokrine kjertler gir nedsatt sekretorisk funksjon og dermed tørre slimhinner (sicca-symptomer, sicca-syndrom) i øyne (xerophthalmia), munn (xerostomi) og genitalia (Baldini G, 2024). Typiske tilleggssymptomer omfatter utmattelse/fatigue, leddsmerter og forekomst av karakteristiske autoantistoffer (Gran JT, 1990).
Omtrent 40-50% utvikler ekstraglandulære manifestasjoner fra bl. a. gastrointestinaltrakten, nervesystemet og lungene. Sykdommen er også assosiert med en «life-time»-risiko på 5–10 % for non-Hodgkins lymfom (Alunno A, 2018; Solans-Laque R, 2011).
Sekundært Sjøgrens syndrom foreligger når sykdommen opptrer i tilknytning til en annen autoimmun revmatisk sykdom, hyppigst revmatoid artritt, systemisk lupus (SLE) eller systemisk sklerose (Negrini S, 2022).
Barn kan sjelden utvikle Sjøgrens syndrom. Sykdommen kalles da juvenilt Sjøgrens syndrom, der klinisk bilde skiller seg noe fra den voksne formen (Ramos-Casals M, 2021).
2. Historikk
Sjøgrens syndrom har fått navn etter den svenske oftalmologen Henrik Samuel Conrad Sjögren (1899-1986). I 1933 beskrev han tilstanden under betegnelsen «Keratokonjunktivitis sicca». Beskrivelsen var basert på en kohorte av 19 kvinner med tørre øyne, tørr munn og artritt hos to tredjedeler av pasientene (Sjogren H, 1971). Arbeidet hans var avgjørende for å etablere syndromet som en selvstendig klinisk entitet.
Lignende tilfeller hadde imidlertid vært omtalt tidligere, blant annet av WB Hadden på slutten av 1800-tallet (Hadden WB, On dry mouth or suppression of the salivary and buccal secretions, Trans. Clin. Soc. Lond. 21, 1888, 176–179).
I tiårene etter andre verdenskrig ble Sjøgrens syndrom lenge betraktet som en undergruppe av andre autoimmune sykdommer og ble eksempelvis omtalt som en «benign form» av systemisk lupus (SLE) (J.M. Heaton, 1959). Dette reflekterte en tidlig forståelse av overlapp mellom autoimmune tilstander, men underkjente at Sjøgrens syndrom også har sine karakteristiske særtrekk som en egen diagnose. Selv om prognosen generelt er bedre enn ved SLE viser senere studier at også pasientene med Sjøgrens syndrom kan ha manifestasjoner i flere organer og betydelig påvirket livskvalitet (Rusten S, 2017).
Sekundært Sjøgrens syndrom
Sekundært Sjøgrens syndrom foreligger når en annen inflammatorisk autoimmun sykdom er til stede samtidig (Theander E, 2008). Hos omtrent 90 % utvikles den andre autoimmune grunnsykdommen; oftest revmatoid artritt, systemisk lupus (SLE) eller systemisk sklerose først. Sekundært Sjøgrens syndrom er vanligst ved revmatoid artritt og SLE, der forekomsten er ca. 20%.
Overlappsyndrom. I noen tilfeller kan det være vanskelig å avgjøre hvilken sykdom som er primær. I klinisk praksis defineres den tilstanden som dominerer med mest karakteristiske manifestasjoner og antistoffprofil som primærdiagnose. Dersom to eller flere autoimmune sykdommer foreligger med sammenlignbar styrke og et bredt autoantistoffmønster, betegnes tilstanden som overlappsyndrom eller udifferensiert systemisk bindevevssykdom.
3. Epidemiologi
Sjøgrens syndrom er en av de hyppigst forekommende av de systemiske bindevevssykdommene. Kvinner rammes mer enn ti ganger oftere enn menn, og sykdommen forekommer globalt i alle befolkningsgrupper.
Prevalensen i befolkningen er 0,05-1 % (Göransson LG, 2011). Dette plasserer sykdommen nær grensen for definisjon som “sjelden” (1/2000 personer, 0,05%) (Cornec D, 2015). Variasjonen i rapportert forekomst reflekterer ulikheter i klassifikasjonskriterier, studiedesign og underdiagnostisering.
Årlig insidens er beregnet til under 0,01 % (Qin B, 2015).
Blant pasienter med sicca-symptomer diagnostiseres Sjøgrens syndrom hos 5-15 %. Sykdommen er vanligst i 40–60 års alder, men symptomer forekommer ofte flere år tidligere (Negrini S, 2022). Autoantistoffene SSA (Ro 52/60) og SSB (La) kan påvises opptil 20 år før klinisk debut (Theander E, 2015). Sykdomsdebut er før 31 års alder hos 15%.Omtrent 15 % debuterer før 31-årsalderen, og sykdommen kan også forekomme hos barn, vanligst i 3–9-årsalderen (juvenilt Sjøgrens syndrom) (Ramos-Calsals M, 2021).
4. Genetikk
Primært Sjøgrens syndrom er assosiert med HLA-DR3, DQ1 og DQ2. Ved sekundært Sjøgrens syndrom relatert til revmatoid artritt er HLA-DR4 dominerende, mens SLE-assosiert Sjøgren typisk er knyttet til HLA-DR2 og DR3. Selv om genetiske faktorer bidrar, er sykdommen ikke sterkt arvelig; familiær forekomst er rundt 5 % (Harris WM, 2019).
Kjønnskromosomale faktorer og hormoner antas å være av betydning i den markante kjønnsforskjellen (Miquel C-H, 2023). Økt forekomst hos personer med Klinefelters syndrom (XXY) (Harris Vm, 2017) og trippel X (XXX) (Liu K, 2017) støtter hypotesen om X-kromosomrelaterte mekanismer.
Epigenetiske mekanismer, inkludert regulering av interferonsignalering, mikro-RNA og gener involvert i antigenpresentasjon, er også foreslått å bidra til sykdomsutviklingen (Cole MB, 2016; Pericone C, 2024).
5. Etiologi og patogenese
Virus. Den eksakte etiologien er ukjent, men sykdommen antas å være multifaktoriell (Jonsson R, 2022). Utenom genetisk disposisjon er virusinfeksjoner mistenkt å kunne initiere eller modulere sykdomsutviklingen. Sjøgren-liknende sykdom oppstår hos mus infisert med retrovirus. Det forskes særlig på en mulig rolle for Epstein–Barr virus, etter funn av EBV-relaterte mikro-RNA (miR-146a og BART155) i kjertelbiopsier. Ekstracellulære miRNA kan stimulere det det innate immunsystemet via interferonaktivering tidlig i sykdomsutviklingen (Shimiu T, 2021: Luo X, 2013)
B-celler og T-celler. Selv om CD4+ T-hjelperceller dominerer i spyttkjertlene, anses Sjøgrens syndrom som en B-celle-drevet autoimmun sykdom hvor det adaptive immunsystemet er sentralt (Chivasso C, 2021; Baldini G, 2024). Typiske tegn på B-celleaktivering inkluderer hypergammaglobulinemi. Det er derfor stor interesse for behandling som hemmer B-cellefunksjon (Du W, 2021).
Autoantistoffer. B-celler i vevet produserer autoaantistoffer, spesielt anti-SSA/Ro og anti-SSB/La. Flere andre antistoffer er beskrevet, men er ikke rutinemessig tilgjengelige i klinikken (Witte T, 2022).
Lymfocyttinfiltrasjon. Lymfocytter, hovedsakelig B- og T-celler, infiltrerer eksokrine kjertler og danner ektopiske kimseter («germinal center-like structures») (Salomonsen S, 2003). Dette fører til progressiv destruksjon av kjertelepitelet og utvikling av lymfoepiteliale lesjoner.
Pro-inflammatoriske cytokiner og BAFF. Aktiverte B-celler fungerer som antigenpresenterende celler for T-celler og produserer inflammatoriske cytokiner som IL-6 og TNF-α. Interferonsystemet er oppregulert, og BAFF (B-cell activating factor/BLyS) er betydelig forhøyet i serum, spytt og affiserte kjertler. Økt BAFF-nivå kan hemme apoptose av autoreaktive B-celler og fremme dannelse av ektopiske kimseter (Mavragani CP, 2013). Aquaporin-5 (AQP5) i spyttkjertlenes epitelceller kan være et autoimmunt mål (Matsozaki T, 2012), og B-celleinfiltrasjon kan indusere epitelial apoptose (Varin M-M, 2012). Disse mekanismene fører samlet til kronisk inflammasjon og vevsskade.
BAFF (B-celle stimulerende faktor, også kalt BLyS: B lymfocytt stimulator) er et cytokin som er viktig for B-cellenes differensiering, overlevelse og for dannelse av ektoptiske kimcentre. Nivået av løselig BAFF er patologisk økt i serum, spytt og affiserte spyttkjertler (Thompson S, 2016).
Det karakteristiske histologiske bildet er fokal infiltrasjon av mononukleære lymfoide celler som gradvis fortrenger og skader kjertelepitelet og danner lymfoepiteliale lesjoner.
6. Symptomer og kliniske uttrykksformer
Hovedmanifestasjonene er daglig tørre øyene og munntørrhet, noe som rapporteres av 98% av pasientene. Både tørre øye og tørr munn rammer 89% (Baldini C, 2014). Økt tretthet/søvnbehov (fatigue) og artralgier er også vanlig. Indre organer angripes hos ca. 25%, men oftest uten store konsekvenser. Non-Hodgkins lymfom er imidlertid en potensielt alvorlig komplikasjon (Carsons SE, 2023).
Artralgier er en svært vanlig manifestasjon ved Sjøgrens syndrom med en rapportert prevalens på over 70% (Baldini C, 2014). Disse leddsmertene er typisk migrerende og intermitterende, affiserer ofte små og store ledd bilateralt og er sjelden assosiert med destruktive erosive forandringer i motsetning til revmatoid artritt. Patogenesen involverer sannsynligvis en kompleks interaksjon mellom systemisk inflammasjon og perifere nociseptive mekanismer, uten nødvendigvis tydelig synovitisk hevelse.
Artritt forekommer hos ca. 10% (Ramos-Casals M, 2013) oftest i små ledd. Det er uvanlig med usurerende radiografiske forandringer dersom det ikke foreligger en overlappstilstand med revmatoid artritt.
Cystitt: Interstitiell cystitt (med dysuri) forekommer hos ca. 7% og medfører hyppig vannlating/cystitt-symptomer, men uten funn av bakterier (Susgai S, 2004).
Fatigue/ tretthet rammer ca. 70% av pasientene. Ofte er utmattelsen uttalt, dominerende og pasientene opplever økt søvnbehov. De sover mye, men blir ikke uthvilte. Symptomet er meget behandlingsresistent, og ingen medikamenter til nå har vist sikker effekt. Tilpasset fysisk aktivitet og trenging anbefales. Hyppige oppvåkninger på grunn av smerter ved fibromyalgi-lignende symptomer eller urinering flere ganger om natten på grunn av høyt væskeinntak kan også bidra til tretthet.
Patofysiologien bak fatigue er antakelig multifaktoriell og involverer immunologiske mekanismer, neuroendokrin dysregulering og psykososiale faktorer. Fatigue ved Sjøgrens syndrom korrelerer ofte med økt sykdomsaktivitet, noe som kan indikere en assosiasjon med cytokiner ved kronisk inflammasjon. Den betydelige innvirkningen på livskvaliteten og funksjonsnivået gjør fatigue til et sentralt fokusområde i pasientbehandlingen (Mæland E, 2021).
Fibromyalgi: Omkring en av fem (20%) med Sjøgrens syndrom har samtidig fibromyalgi (Ostuni P, 2002). Denne forekomsten er klart høyere enn forventet og indikerer en potensiell felles patogenese eller overlappende mekanismer for sentral sensitivisering.
Fibromyalgi ved Sjøgrens syndrom manifesterer seg som kronisk, generalisert muskelskjelettsmerte ofte ledsaget av fatigue, søvnforstyrrelser og kognitiv dysfunksjon. Dette kan komplisere differensialdiagnostikk og behandling av den underliggende autoimmune sykdomsaktiviteten. Erkjenning av denne koeksistensen er avgjørende for en helhetlig pasientbehandling.
Lymfeknuter. Forstørrede lymfeknuter, særlig på halsen, er et veldig vanlig og oftest ufarlig symptom ved Sjøgrens syndrom. Yngre pasienter med høyt B-celleaktivitet/sykdomsaktivitet er mest utsatt (Stergiou IE, 2022). Den histologiske årsaken til lymfadenopati er ofte en benign reaktiv hyperplasi som reflekterer en vedvarende immunaktivering. Slike reaktive lymfeknuter er typisk multiple, bilaterale og mobile med en myk til gummiaktig konsistens. Klinisk monitorering er imidlertid essensielt for å utelukke malign transformasjon til lymfom (se nedenfor), spesielt ved asymmetri, rask vekst eller konsistensendring.
Munntørrhet (Xerostomi) er tilstede hos 98 % av pasientene. Dette fører til en betydelig økt risiko for karies, spesielt omkring tannhalsen. Tørrheten kan også forårsake at tannproteser kan løsne.
-Dysbiose. Den reduserte spyttsekresjonen og den endrede sammensetningen av spyttet bidrar til dysbiose i munnens mikrobiom, forringer buffersystemene og reduserer den antimikrobielle beskyttelsen. Dette skaper et miljø som disponerer for oral patologi og betydelig forringer pasientens orale helserelaterte livskvalitet (Rusthen S, 2017). Oral candidiasis er en hyppig komplikasjon som rammer opptil 75 % av pasientene.
Brennende følelse i munnen er ikke helt uvanlig ved Sjøgrens syndrom, men skilles fra “Burning mouth syndrome” (Aljanhobi H, 2017)
Lukte- og smakssans. Munntørrhet påvirker også lukte- og smakssansen (Singh PB, 2019).
Munntørrhet kan til en viss grad objektiveres ved sialometri (se undersøkelser nedenfor).
Gastrointestinale manifestasjoner: Forskjellige gastrointestinale manifestasjoner observeres hos opp til 80% av pasientene. Årsakene er flere. Redusert mengde gastrointestinale væske og dermed relativt få enzymer fra spytt, pankreas og andre gastrointestinale glandler er ugunstig for fordøyelsen. Svelgevansker skyldes ofte tørrhet i svelget, men også øsofagusdysfunksjon forekommer hos enkelte (Obs! overlapp med systemisk sklerose og myositt) og kan skyldes autonom nevropati (Negrini S, 2022). Gastritt, kronisk atrofisk, hepatitt (kronisk, autoimmun), pankreatitt (subklinisk), pernisiøs anemi med rhagader, primær biliær kolangitt (PBC), watermelon stomach (Gastrisk Antral Vaskulær Ektasi: GAVE og overlapp med systemisk sklerose) er sjeldne komplikasjoner. Ved gastrointestinale symptomer bør en også ha i mente at opp til 15% av pasientene kan ha cøliaki (Popov Y, 2018).
Genitalier: Genitalt er vaginal sicca er en direkte konsekvens av redusert eksokrin kjertelfunksjon i mukøse membraner. Resultater er økt risiko for mikrotraumer og sekundære bakterielle infeksjoner som candidainfeksjoner (moniliasis) med tørrhet, kløe, irritasjon og vulvovaginal atrofi. Disse genitale manifestasjonene kan påvirker seksualfunksjonen, inkludert dyspareuni og tilsier ofte lokal symptomlindrende behandling.
Hematologisk: Hematologiske manifestasjoner er relativt vanlige, selv om de sjelden er det første symptomet. De kan påvirke ulike cellelinjer (anemi, leukopeni, trombocytopeni) og reflektere både sykdomsaktivitet (se tabellen nedenfor) og eventuelle bivirkninger av medikamenter. Disse cytopeniene er ofte milde, men kan vedvare.
-Mild til moderat anemi ved Sjøgrens syndrom er en normokrom, normocytær anemi karakterisert av forstyrret jernmetabolisme grunnet proinflammatoriske cytokiner, snarere enn jernmangel. Sjeldnere kan autoimmun hemolytisk anemi eller pernisiøs anemi også forekomme.
-Leukopeni er oftest nøytropeni og/eller lymfopeni. Alvorlig nøytropeni er sjelden, men kan øke infeksjonsrisikoen.
-Trombocytopeni er vanligvis mild til moderat.
-Høy polyklonal IgG er vanlig, men enkelte pasienter kan også utvikle MGUS, som potensielt kan progrediere til myelomatose eller andre lymfoproliferative lidelser over tid.
-Kryoglobuliner er ofte polyklonale eller blandede kryoglobuliner kan være assosiert med vaskulitt-manifestasjoner og er en uavhengig risikofaktor for utvikling av lymfom.
| Variabler i blodet (Ramos-Casals M, 2013) | Forekomst ved inaktiv sykdom | Forekomst ved aktiv sykdom | p-verdi |
| Anemi | 11% | 18% | 0.022 |
| Leukopeni | 9% | 22% | <0.001 |
| Neutropeni | 0,6% | 14% | <0,001 |
| Lymfopeni | 5% | 13% | <0,001 |
| Lavt C3 nivå | 5% | 10% | 0,03 |
| Kryoglobulinemi | 6% | 13% | 0.032 |
-Xerodermi. Pasienter med Sjøgrens syndrom opplever hyppig xerodermi (tørr hud) som er et resultat av redusert eksokrin funksjon i hudens kjertler. Denne uttørringen kan gi betydelig irritasjon og kløe.
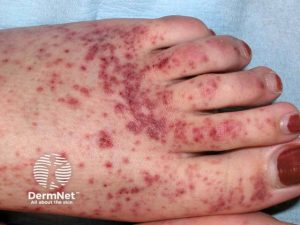
-Purpura. Kutan vaskulitt manifesterer seg som palpabel purpura hos om lag 10 % av pasientene, primært lokalisert til underekstremitetene og kan ofte utløses eller forverres av fysisk aktivitet. Purpura-lesjonene kan etterlate postinflammatorisk hyperpigmentering sekundært til hemosiderinavleiring.
-Erythema annulare er karakterisert av annulære erythematøse lesjoner og er en annen distinkt hudmanifestasjon som er sterkt korrelert med SSA/Ro- og/eller SSB/La-autoantistoffer. Denne manifestasjonen viser betydelig klinisk og histopatologisk overlapp med subakutt kutan lupus (Negrini S, 2022).
Lever
Lett forhøyede leverenzymer ses hos opp til 50% med Sjøgrens syndrom. Imidlertid er det bare en minoritet som har primær biliær kolangitt (PBC), autoimmun hepatitt, non-alkoholisk fettlever eller annen spesifikk leversykdom (Negrini S, 2022).
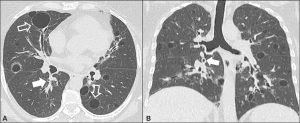
Diffus interstitiell lungesykdom (ILD) med tørrhoste og dyspné eller redusert lungefunksjon ses klinisk hos opptil 25 % (Palm O, 2013). Ved systemiske undersøkelser (lavage, HRCT, lungefunksjonstester) kan imidlertid patologiske luftveisfunn gjøres hos opp til 75% (Luppi F, 2020).
–Sicca. I øvre luftveier kan pasientene plages av tørrhet med skorper i nesen, neseblødning og sinusitt. Kronisk heshet er vanlig (opp til 50%) og kan skyldes tracheal sicca med tørrhoste. I lungene kan tørrhet også disponere for atelektaser, bronkiektasier og dermed residiverende luftveisinfeksjoner (Stojan G, 2013).
–Bronkiolitt, hovedsakelig follikulær type), er regnet for å være den vanligste manifestasjon i distale luftveier (Flament T, 2016).
–Infeksjoner. Residiverende bronkitter og pneumonier kan føre til pulmonal fibrose som følgetilstand.
-NSIP og LIP. Andre lungemanifestasjoner er interstitiell lungesykdom i form av non-specific interstitial pneumonia (NSIP), organisert pneumoni, kryptogen organiserende pneumoni og den karakteristiske lymfocytær interstitiell pneumoni (LIP).
- -Lymfoid interstitiell pneumoni (LIP) er en ikke sjelden interstitiell lungesykdom ved Sjøgrens syndrom. Den er er karakterisert ved til dels store, tynnveggede cyster med som histologisk består av diffust hyperplasisk bronkialt assosiert vev. LIP er oftest asymptomatisk, men kan også forårsake progressiv hoste og dyspné. Fem års mortalitet er beskrevet å være hele 35-50 %, men dette gjelder trolig selekterte tilfeller. Omtrent 5 % transformeres til lymfom (Swigris JJ, 2002). Vennligst les om lunger og revmatisk sykdom i eget kapittel
Muskler
Myositt påvises hos ca. 2 % og er vanligvis asymptomatisk med bare lett økte CK-verdier (Colafrancesco S, 2015). Også hypokaliemi ved renal Sjøgrens-affeksjon kan medføre muskelsymptomer. Vanligste årsak til muskelsmerter er likevel komorbiditet i form av smertetilstander som fibromyalgi (Choi BY, 2016).
Malignitet ved Sjøgrens syndrom
Sjøgrens syndrom er forbundet med en klar økt risiko for Non-Hodgkins lymfom (RR 13.76; 95% CI 8.53 – 18.99 og litt økt risiko for thyeoideacancer (RR 2.58; 95% CI 1.14 – 4.03) (Liang Y, 2014).
-Non-Hodgkins lymfom kan forekomme både intra- og ekstraglandulært ved Sjøgrens syndrom. Omkring 50 % av lymfomene oppstår i spyttkjertlene som vanligste lokalisasjon, mens gastrointestinalkanalen, lunger, hud, tymus og thyreoidea affiseres sjeldnere. De vanligste lymfomtypene er lavgradig MALT lymfom (Mucosa Assosiert Lymfoid vev (Tissue), nodal marginal sone lymfom og diffus store B-celle lymfomer. De fleste er lav-gradige lymfomer (Alunno A, 2018).. Bare ca. 10% utvikler seg til mer aggressive former (Nocturne G, 2015).
Epidemiologi: Lymfomutvikling forekommer 4,3-16 ganger hyppigere ved Sjøgrens syndrom enn i normalbefolkningen. Risikoen er estimert til 5-10 % i løpet av livet, forutsatt at pasienten oppfyller US/EU-kriteriene for SS-diagnosen (Alunno A, 2018; Solans-Laque R, 2011; Goules AV 2024).
Symptomer på lymfom:
- Vedvarende lokalisert hevelse, oftest i spyttkjertel eller på hals, men også andre lokalisasjoner må vurderes:
- Nattesvette, feber, vekttap og påvirket allmenntilstand.
- Laboratoriefunn: Fall i gammaglobulin (IgG), utvikling av monoklonalt protein. Nyoppstått leukopeni (lymfopeni). Bortfall av tidligere autoantistoff.
Andre faktorer: Gjennomgått parotitt, palpabel purpura, lymfopeni ved diagnosetidspunkt, mulig økt risiko for lymfom hos de pasientene som i leppebiopsi far påvist ektopiske germinale sentre.
Aktuelle symptomer og risikofaktorer (se nedenfor) bør tas hensyn til i oppfølgingen av pasientene, selv om det ikke foreligger klare retningslinjer for dette (Negrini S, 2022).
Risikofaktorer for lymfom:
- Høy sykdomsaktivitet (ESSDAI ≥5) og RF+ (Goules AV 2024)
- Spyttkjertelhevelse som vedvarer eller øker
- Hudvaskulitt/purpura
- Komplementforbruk (fall i C3 eller C4)
- Lavt antall lymfocytter
- Kryoglobulinemi
- Fallende IgG konsentrasjon
- B-symptomer (nattesvette, feber-tendens, vekttap).
- Histopatologiske funn: Mange ansamlinger av lymfocytter (germinale sentre) i vevsprøve fra spyttkjertel (Nocturne G, 2014).
Nevrologiske manifestasjoner (“nevro-Sjøgrens”) forekommer hos opp til 20 % av pasientene. Nevrologiske symptomer kan i noen tilfeller debutere før sicca-symptomene og er oftest langsomt progredierende. De omfatter både det perifere nervesystemet (vanligst) med sensorisk nevropati og CNS-symptomer (sjeldnere) som kan omfatte ataktisk nevronopati eller multiple sklerose (MS) -lignende manifestasjoner (Topon GJ, 2012; Berkowitz A, 2014).
-Perifer nevropati kan deles videre inn i sensorisk nevropati med- eller uten tynnfibernevropati. Både mononevritt og polynevropati forekommer (Pavlakis PP, 2012). Ved tynnfibernevropati foreligger ofte dysestesi, parestesi, overømfintlighet (allodyni) og hyperalgesi. Vanlige elektrofysiologiske undersøkelser fanger vanligvis ikke opp tynnfibernevropat, slik at tynnfiber-nevrografi eller biopsi (redusert tetthet av epidermale nervefibre) kan være nødvendig for å sikre diagnosen (Gwathmey KG, 2021).
-CNS nevropati omfatter sensorisk ataktisk nevronopati som er relatert til de dorsale nerverøttene fra medulla. Konsekvensen er svekket sensibilitet for bevegelse med ataksi, ustø halting, hyporefleksi og autonom nevropati (f. eks. gastrointestinal dysfunksjon). Utenom medulla kan også hjernestamme, nervus opticus, cerebellum og cerebrale hemisfærer påvirkes (Topon GJ, 2012; Berkowitz A, 2014). Forekomst av nevromyelitis optica (NMO) og transvers myelitt ved Sjøgrens er også rapportert (Shabeer P, 2021). I tillegg ses tilfeller med kognitiv svikt i form av redusert konsentrasjon, oppmerksomhet og hukommelse er et vesentlig problem som kan korrelere med sykdomsaktiviteten (Seeliger T, 2020). CNS symptomer kan isolert sett lett feiltolkes som multiple sklerose (MS). Begge tilstandene medfører patologiske funn i hvit hjernesubstans ved MR-undersøkelse (Jung SM, 2000; Cojocaru IM, 2011). Ved supplerende radiologiske undersøkelser kan tilstandene oftest likevel skilles (Modis LV, 2022).
Nyremanifestasjoner
Prevalensen av nyresykdom relatert til Sjøgrens er rapportert til ca. 5%, men dette tallet er trolig underestimert (Ramos-Casals M, 2015).
-Renal tubulær acidose (RTA). Kronisk tubulointerstitiell nefritt er den vanligste manifestasjonen og da i form av distal (type1) renal tubulær acidose (Francois H, 2016). Denne er ofte asymptomatisk og karakteriseres av en defekt i tubulenes evne til å surgjøre urinen, noe som resulterer i vedvarende alkalisk urin-pH. Patogenesen er en underliggende autoimmun mekanisme som fører til tubulær skade ved at en infiltrasjon av lymfocytter i nyrevevet påvirker den tubulære funksjonen. Diagnosen av distal renal tubulær acidose kan stilles når det foreligger en kombinasjon av hypokalemi, positivt urin anion gap, høy urin-pH og hyperkloremisk metabolsk acidose. Ofte presenterer dette seg som en inkomplett renal tubulær acidose uten systemiske syre-baseforstyrrelser, men tilfeller med alvorlig hypokalemi og parese er rapportert (Gøransson LG, 2000).
Tabell: Furosemidtest ved utredning av renal tubulær acidose (RTA)
| Element | Beskrivelse |
|---|---|
| Formål | Vurdere evnen til distal tubulus til å forsure urin. Brukes primært for å avklare distal RTA (type 1). |
| Når testen er unødvendig | Rutinemessig urinstiks viser pH < 5,3 → utelukker distal RTA → furosemidtest ikke nødvendig. |
| Normal urin-pH | 4,5–8,0 |
| Forberedelser | Bestemmelse av morgenurin-pH, blod-pH, S-kreatinin og S-kalium. |
| Gjennomføring | – Gi 40 mg furosemid per os. – Samle all urin i 6 timer. – Analyser hver prøve for pH, kalium og kreatinin. |
| Fysiologisk respons hos friske | Furosemid stimulerer distal protonsekresjon → urin-pH faller < 5,3. Samtidig øker kaliumutskillelsen. |
Tolkning ved ulike typer RTA.
- Hos friske individer vil urin-pH falle til under 5,3 etter administrasjon av furosemid. Dette gjenspeiler en normal distal tubulær protonsekresjon. Samtidig forventes en tydelig økning i kaliumutskillelsen, som følge av furosemids stimulerende effekt på distale nefronavsnitt.
- Ved distal renal tubulær acidose (type 1) er evnen til å forsure urinen nedsatt på grunn av en defekt i distal hydrogenionsekresjon. Urin-pH vil derfor forbli over 5,3 til tross for furosemidadministrasjon og selv ved tilstedeværende systemisk acidose. Kaliumutskillelsen er ofte økt, men dette endrer ikke manglende evne til forsuring.
- Ved proksimal RTA (type 2) er den proksimale reabsorpsjonen av bikarbonat svekket, men distal forsuringsevne er bevart. Hos disse pasientene kan urin-pH derfor falle under 5,3 etter furosemid, forutsatt at det foreligger systemisk acidose. Imidlertid vil kaliumutskillelsen vanligvis ikke øke i samme grad som hos friske, ettersom distal tubulus ofte er delvis funksjonsnedsatt ved proksimal tubulopati.
Begrensninger ved testen og diagnostiske alternativer. Furosemidtesten er tidkrevende og ressurskrevende, ettersom den krever gjentatte urinmålinger over en seks timers periode. Den er derfor i økende grad blitt erstattet av enklere diagnostiske metoder. En mye brukt alternativ undersøkelse er bestemmelse av urinens citrat/kreatinin-ratio, som kan gi nyttig informasjon om syre-base-status og tubulær funksjon. Lav citratutskillelse er ofte assosiert med distal RTA og kan bidra til diagnostikken uten behov for en full furosemidtest.
–Glomerulonefritt er uvanlig ved Sjøgrens syndrom og bør vekke mistanke om differensialdiagnoser som systemisk lupus (SLE). Interstitiell cystitt er beskrevet separat ovenfor.
-Residiverende nefrolitiasis og nefrocalcinose er sjeldne komplikasjoner.
Pankreas er et eksokrint organ som også kan affiseres ved Sjøgrens syndrom, selv om klinisk pankreatitt er en uvanlig komplikasjon (Hedstrøm A, 2022). Patogenesen omfatter en autoimmun inflammasjon med lymfocyttær infiltrasjon i pankreasvevet som potensielt kan påvirke eksokrin- og sjeldnere endokrin funksjon.
Parotishevelse er en vanlig manifestasjon ved Sjøgrens syndrom som observeres intermitterende hos omtrent 50 % av pasientene. Hevelsen kan affisere begge sider, men trenger ikke opptre synkront. Vedvarende parotishevelse krever grundig utredning for å utelukke utvikling av lymfom, en kjent komplikasjon ved Sjøgrens syndrom (se ovenfor) (Rischmueller M, 2016).
Raynauds fenomen: Raynauds fenomen forekommer hos 10-20 % av pasientene med Sjøgrens syndrom. Dette vaskulære fenomenet indikerer en potensiell overlapning med systemisk sklerose og krever derfor spesifikk oppmerksomhet for å differensiere eller identifisere koeksistens (Ramos-Casals M, 2008).
Thyreoidea: Autoimmun thyreoiditt som ofte manifesterer seg som hypothyreose er en hyppig komorbiditet ved Sjøgrens syndrom. En italiensk multisenterstudie med over 2500 pasienter viste en prevalens på omkring 20 % (Colafracscesco S, 2023). Dette gjør autoimmun thyreoiditt til den vanligste autoimmune komorbiditeten, selv om også en økt forekomst av revmatoid artritt og systemisk lupus (SLE) også er observert som ledd i polyautoimmunitet. En felles autoimmun disposisjon og patogenese kan forklare tendensen til utvikling av flere autoimmune sykdommer hos samme pasient (Anaya J-M, 2016).
Øye-manifestasjoner ved Sjøgrens syndrom er primært preget av xeroftalmi (tørre øyne) som pasienter beskriver som en følelse av rusk, irritasjon, tilbakevendende betennelser og gjenklistring om morgenen. Initialt kan paradoksalt en økt tåreflom observeres. Det er da en refleksrespons på begynnende tørrhet og irritasjon. Keratitt med karakteristiske “dry spots” (punktformede defekter på hornhinnen) som skyldes utilstrekkelig dekning av tårefilmen. Mens tårekjertlene produserer den vandige tårevæsken, er Meibomske kjertler (lokalisert langs øyelokkskantene) avgjørende for tårefilmens stabilitet og smørende egenskaper gjennom sekresjon av lipider og proteiner (Bjordal O, 2020). Ved Sjøgrens syndrom kan autoimmun inflammasjon ofte føre til dysfunksjon også i disse kjertlene, noe som forsterker tørrhetsproblematikken.
Juvenilt Sjøgrens syndrom: Barn har få eller ingen symptomer, men hovne parotis-kjertler, utslag i SSA/B antistoff og høy IgG er vanlig. Man kan påvise typiske funn ved ultralyd, MR eller histologiske undersøkelser av spyttkjertler (Ramos-Casals M, 2021). Juvenilt Sjøgrens syndrom er omtalt in et eget kapittel.
7. Undersøkelser
Anamnesen ved Sjøgrens syndrom kartlegger symptomer på daglig tørrhet eller irritasjon i øyne som følelse av rusk eller sand, bruk av kunstig tårevæske flere ganger (x3?) daglig, tørr munn hele dagen og må drikke for å svelge tørre matvarer, parotitt, lymfeknuter, artritt, purpura, nevropati, utmattelse. Andre årsaker som medikamenter (antihistaminer, antidepressiva, betablokkere, diuretika, parkinsonmedikasjon, kjent sarkoidose, hepatitt C, bestråling). B-symptomer med nattesvette, feber, vekttap. Symptomer fra lunger, mage-tarm, perifere nerver, hjertet. Raynauds fenomen.
Klinisk kan en utenom en generell undersøke, inspisere øyne (røde, irriterte), munn (tørre slimhinner), hals (lymfeglandler), parotiskjertler (50% har forstørrede kjertler, OBS! tumorer), submandibularis-glandler, hud (purpura, eksem), nevropati distalt. Ved auskultasjon av lunger kan ILD og fibrosetegn avdekkes ved krepitasjoner. Hjerterytme, blodtrykk, bilyder over hjerte og lunger utelukkes. Huden inspiseres for purpura, særlig på begge legger og annet eksantem.
–Sialometri: Spyttfunksjonen testes ofte med ustimulert sialometri. Spyttmengden som naturlig kommer i munnen samles over 15 minutter. Totalt 1,5ml eller mer er normalt. Testen krever godt samarbeid med pasienten. Svelging av spytt medfører for lave verdier. Pasienten skal ikke ha ikke spist eller drukket på minst 60 minutter før sialometri (Kalk WW, 2001).
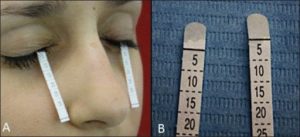
–Schirmers test: Tåreproduksjonen testes med Schirmers test. Sannsynlig patologisk: < 10 mm/5 min: Sikker patologisk: < 5mm i minst ett øye. Pasientene skal ikke ha brukt kunstig tårevæske samme dag som testen gjøres (Beckman KE, 2016).
-Tear Break up Time: Her måler øyelegen tiden det tar for tårefilmen oppløses (patologisk < 10 sek.) (Beckman KE, 2016).
-Rose Bengal farging og van Bijsterveld score: Øyelegen måler skade på cornea («Dry spots»).
Laboratorieprøver
Tabell: Laboratorie- og immunologiske prøver ved Sjøgrens syndrom
A. Rutineprøver og biokjemi
| Prøve | Typiske funn | Klinisk betydning |
|---|---|---|
| CRP | Vanligvis normal | Skiller Sjøgren fra andre inflammatoriske tilstander; lav CRP tross høy SR. |
| SR | Ofte forhøyet | Reflekterer hypergammaglobulinemi (IgG). |
| Hb | Ofte normal/lett redusert | Kan indikere kronisk sykdom. |
| Leukocytter m/diff | Leukopeni, særlig lymfopeni | Assosiert med sykdomsaktivitet. |
| Trombocytter | Vanligvis normale | – |
| Leverprøver | Ofte lett forhøyede | Kan indikere samtidig autoimmun hepatobiliær sykdom (PBC). |
| Nyreparametre (kreatinin, eGFR) | Normale eller redusert ved interstitiell nefritt | Fanger opp nyreaffeksjon/RTA. |
| Elektrolytter | Ofte normale | Viktige ved vurdering av RTA (hypokalemi). |
| Thyreoideaprøver | Vanligvis normale | Autoimmun tyreoiditt forekommer hyppigere. |
| LD | Kan være forhøyet | Systemisk aktivitet. |
| Amylase/lipase | Hyperamylasemi hos opptil 1/3 | Kan reflektere kjertelaffeksjon. |
| CK | Normalt/lett forhøyet | Myositt ved overlappsyndrom. |
| Glukose | Rutine | – |
| IgG, proteinelektroforese | Markert polyklonal hypergammaglobulinemi | Sykdomsmarkør; korrelerer med SR. |
| C3 og C4 | Lave nivåer kan forekomme | Indikerer sykdomsaktivitet og økt risiko for ekstraglandulær sykdom og lymfom. |
| Urinstiks (inkl. pH) | Proteinuri/hematuri forekommer; pH ved mistanke om RTA | Screening for nefritt/RTA. |
| Kryoglobuliner | Kan være positive | Assosiert med vaskulitt og økt lymfomrisiko. |
| ACE | Kan være forhøyet | Differensialdiagnose mot sarkoidose. |
| Hepatitt C-serologi | Ved behov | Differensialdiagnose mot sicca og kryoglobulinemi. |
B. Immunologiske prøver og antistoffprofil ved Sjøgrens syndrom (modifisert etter Scofield RH, 2018)
| Antistoff | Prevalens (%) | Betydning | Kliniske assosiasjoner |
|---|---|---|---|
| Anti-Ro/SSA (52/60 kDa) | 50–70 % | Viktig sykdomsmarkør; assosiert med økt risiko for lymfom | Unge pasienter, ekstraglandulære manifestasjoner, systemisk sykdom |
| Anti-La/SSB | 25–40 % | Sykdomsmarkør; korrelerer med mer klassisk Sjøgren-fenotype | Ekstraglandulære manifestasjoner, lymfomdisposisjon |
| Revmatoid faktor (RF) | 36–74 % | Uspesifikk; ofte sammen med SSA/SSB | Ekstraglandulær sykdom, økt lymfomrisiko |
| Anti-CCP | 3–10 % | Markør for RA; tyder på overlapp eller sekundær Sjøgren | Artritt, RA-dominert sykdomsbilde |
| Anti-mitokondrie (AMA) | 3–10 % | Markør for primær biliær kolangitt (PBC) | Forhøyet ALP/γ-GT, PBC-assosiasjon |
| Anti-centromer | 3–27 % | Assosiert med begrenset systemisk sklerose (CREST) | Raynauds fenomen, sklerodaktyli |
| Kryoglobuliner | 3–12 % | Markør for vaskulitt og alvorlig systemisk sykdom; økt lymfomrisiko | Vaskulitt, perifer nevropati, lymfom, ekstraglandulære manifestasjoner |
| ANA | ~60 % | Uspesifikk, men vanlig | Del av basisutredning |
| SSB alene | Relativt sjelden | Uten SSA har begrenset diagnostisk verdi | – |
| Anti-parietal-celle antistoff | ~15 % | Risiko for pernisiøs anemi | B12-mangel, gastritt |
Bildediagnostikk
-CT og HRCT brukes for å vurdere ev. pulmonale forandringer. Vanligvis begrenses undersøkelser til pasienter med symptomer, selv om en del asymptomatiske tilfeller vil kunne påvises ved “screening” i tillegg. Ved påvist lungemanifestasjon anbefales kontroll av forandringene innen 3-6 måneder for å avgjøre om de er progredierende, noe som kan ha terapeutiske konsekvenser (Lee AS, 2021).
-MR av hals med parotis eller submandibularis ved mistanke om malignitet, fortrinnsvis etter ultralydundersøkelse.
–PET/CT brukes diagnostisk ved mistanke om lymfom eller annen malignitet.
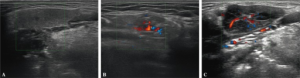
-Ultralyd av spyttkjertler (ultralyd av parotis) påviser ofte patologiske forandringer ved Sjøgrens syndrom (Ramsubeik K, 2020). Undersøkelsen kan øke den diagnostiske sensitiviteten og spesifisiteten (JousserJoulin S, 2020; Martel A, 2018).
Ultralyd-score ved undersøkelse av spyttkjertler (Referanse: Hocever A, 2005):
- Parenkymal ekkogenitet sammenlignet med thyreoidea, score 0-1
- Homogenisitet, score 0-3
- Hypoekkogene områder score 0-3
- Hyperekkogene reflekser
- Parotis score 0-3
- Submandibularis score 0-1
- Distinkt kjertelgrense score 0-3
Biopsi. Diagnostiske forandringer kan påvises ved biopsi av små spyttkjertler fra leppens innside (Lower Lip Biopsy), men diagnosen kan oftest stilles uten biopsi.
-Indikasjoner for biopsi:
- Diagnostisk verifisering (når ikke-invasive metoder ikke er tilstrekkelig)
- Histologiske forandringer er en del av klassifikasjonskriteriene, slik at seronegative tilfeller kan klassifiseres ved biopsi.
- Differensialdiagnostisk: I enkelte tilfeller kan biopsien bidra til å skille Sjøgrens syndrom fra andre tilstander som kan gi lignende symptomer.
- Lymfomrisiko. I noen tilfeller kan histologisk påvisning av spesifikke forandringer, som ektopiske germinale sentre (GC) i små spyttkjertler, være assosiert med en økt lymfomrisiko, og kan derfor være av prognostisk betydning.
-Seleksjon av pasienter til biopsi: Minstekravet er redusert Schirmers test sammen med minst et annet tegn på eksokrin dysfunksjon (sialometri, parotitt, positiv Rose Bengal, nedsatt Tear Break-up time) eller symptomer sammen med anti-SSA/SSB antistoffer.
-For å definere sialoadenitt ved leppebiopsi kreves lymfocyttinfiltrasjon av betydelig grad med foci, evt. atrofi og destruksjon av kjertelelementer:
- Fokal lymfocytær infiltrasjon: Dette betyr ansamlinger av lymfocytter som infiltrerer og ødelegger de normale kjertelcellene.
- Fokusscore: Dette er et kvantitativt mål som sier noe om hvor mange slike ansamlinger av lymfocytter det er per standardisert vevsområde (f.eks. ≥ 1 fokus per 4 mm2). En fokusscore på 1 eller mer er et viktig diagnostisk kriterium som ansamling av minst 50 mononukleære celler (Guelle D, 2013).
-Komplikasjoner etter biopsi. En italiensk studie fant at 10 av 50 pasienter (20%) som gjort pyttkjertelbiopsi fra underleppen hadde lokalt ubehag etter inngrepet. Tre (6%) rapporterte sensorisk defekt på biopsistedet opp til noen få uker. Tre (6%) følte såpass smerte at de brukte analgetika, mens en hadde forbigående brennende følelse i et par dager. Tre pasienter (6%) hadde et hematom i leppen og hos to forelå tegn til mild inflammasjon på biopsistedet (Varoni EM, 2020).
-Hudbiopsi for å påvise vaskulitt, purpura, annen hudsykdom eller tynnfibernevropat kan være nødvendig for å sikre diagnosen i spesielle tilfeller.
Beregning av fokus-score basert på biopsi fra underleppe ved Sjøgrens syndrom. Det må foreligge 2-4 små kjertler slik at overflaten som mikroskoperes er på minst 8 kvadratmillimeter (referanse: Fisher BA, 2017)
- Små spyttkjertler blir undersøkt i biopsi fra leppen
- Antall foci (ansamlinger) med mer enn 50 lymfocytter blir summert
- Arealet som blir vurdert blir beregnet
- Antall foci (n) delt på overflate-arealet (a) blir multiplisert med 4 = foci-score
Formel n : a x 4 =
- Verdi 1,0 eller høyere kan tyde på Sjøgrens syndrom, men er ikke diagnostisk.
- Røkere har lavere score enn ikke-røkere.
- Falske positive forekommer for eksempel etter skade (bitt) på leppen
8. Diagnose
En generell klinisk undersøkelse bør omfatte inspeksjon av øyne, munnhule, hud, auskultasjon av hjerte og lunger, palpasjon av abdomen, parotis og glandel-stasjoner, leddundersøkelse.
Det finnes flere diagnostiske kriterier. Uansett hvilke man velger å bruke, bør endelig diagnose samsvare med sykdomsdefinisjonen. Det er derfor rimelig å kreve at objektive tegn på eksokrin inflammasjon og/eller autoimmunitet skal kunne påvises. Dette innebærer at det skal påvises objektive tegn til nedsatt spytt- og/eller tåreproduksjon, samt autoantistoffer og/eller positiv spyttkjertelbiopsi.
9. Klassifikasjonskriterier 2016, ACR/EULAR
ACR/EULAR 2016: Poengsystem for Sjøgrens syndrom (Shiboski CH, 2016). ACR/EULAR kriterier baseres på personer med tørrhet og/eller andre Sjøgren-suspekte symptomer
Kliniske symptomer (pre-screening): Minst ett positivt svar på følgende fem spørsmål må være til stede for at poengsystemet i tabellen skal anvendes:
- Daglig, vedvarende plagsomme tørre øyne i ≥ 3 måneder
- Gjentakende følelse av sand eller grus i øynene
- Bruk av kunstige tårer ≥ 3 ganger daglig
- Daglig følelse av tørr munn i ≥ 3 måneder
- Behov for å drikke ofte for å svelge tørr mat
| Klinisk/diagnostisk parameter | Kriterier / terskel | Poeng |
|---|---|---|
| Fokus score (spyttkjertelbiopsi) | ≥ 1 foci/4 mm² | 3 |
| Anti-SSA (Ro) antistoff | Positiv | 3 |
| Oftalmologisk fargestyrke (keratitt-skår) | Lissamine green/rose bengal ≥ 5 i minst ett øye, eller van Bijsterveld ≥ 4 | 1 |
| Schirmers test | ≤ 5 mm/5 min i minst ett øye | 1 |
| Ustimulerte spyttmålinger (sialometri) | ≤ 0,1 ml/min (≤ 1,5 ml/15 min) | 1 |
Tolkning: Total poengsum ≥ 4 = klassifikasjon som Sjøgrens syndrom, Klinisk krav: minst anti-SSA positivitet eller positiv spyttkjertelbiopsi må foreligge.
Kliniske symptomer (pre-screening): Minst ett positivt svar på følgende fem spørsmål må være til stede for at poengsystemet skal anvendes:
- Daglig, vedvarende plagsomme tørre øyne i ≥ 3 måneder
- Gjentakende følelse av sand eller grus i øynene
- Bruk av kunstige tårer ≥ 3 ganger daglig
- Daglig følelse av tørr munn i ≥ 3 måneder
- Behov for å drikke ofte for å svelge tørr mat
Eksklusjon: Tidligere stråleterapi mot hode/hals, Aktiv hepatitt C-infeksjon, AIDS-infeksjon, Sarkoidose, Amyloidose, Graft-versus Host Disease, IgG4-relatert sykdom
Bruk av spesielle medikamenter, anti-kolinerge medikamenter, som forårsaker tørrhet skal stanses i god tid før måling av tåre- og spyttkjertel-funksjon.
10. Differensialdiagnoser
Dette ikke er en uttømmende liste. Det er viktig å vurdere den kliniske konteksten til hver pasient. Det er også viktig å utelukke andre autoimmune sykdommer som kan gi lignende symptomer som for eksempel revmatoid artritt, systemisk lupus erythematosus og systemisk sklerose.
- Aldersbetinget kjerteldegenerasjon: Nedsatt funksjon av eksokrine kjertler som følge av aldring, noe som kan føre til tørrhet i øyne og munn.
- Amyloidose: Opphopning av amyloid protein i vev og organer, inkludert spytt- og tårekjertler, kan gi symptomer som munntørrhet og tørre øyne.
- Burning mouth syndrom: Kronisk brennende følelse i munnen uten åpenbar årsak kan forveksles med munntørrhet ved Sjøgrens.
- Diabetes mellitus: Økt risiko for infeksjoner og nevropati kan gi tørrhet i øyne og munn samt tretthet.
- Hepatitt C: Kan gi ekstraglandulære manifestasjoner som leddsmerter og tretthet samt kryoglobulinemi som kan gi Sjøgrens-liknende symptomer.
- HIV-relatert diffus infiltrativ lymfocytose syndrom (DILS): Lymfocyttinfiltrasjon i spyttkjertler kan gi hevelse og redusert spyttproduksjon.
- Hyperlipidemi, Type V: Kan gi pankreatitt og sekundær Sjøgrens syndrom.
- Hypothyreose: Tretthet, muskelsmerter og tørr hud kan overlappe med symptomer på Sjøgrens.
- IgG4-relatert sykdom: Systemisk sykdom med IgG4-positive plasmaceller som kan infiltrere spytt- og tårekjertler og gi lignende symptomer som Sjøgrens.
- ME, kronisk utmattelsessyndrom: Preges av utmattelse, muskelsmerter og kognitiv dysfunksjon som kan overlappe med Sjøgrens.
- Medikamenter som medfører tørrhet (oftest munntørrhet) og økt tretthet: Mange medikamenter kan gi bivirkninger som tørrhet i munn og øyne, samt tretthet, noe som etterligner Sjøgrens symptomer. Dette er den hyppigste årsaken til munntørrhet.
- Sarkoidose; Granulomatøs betennelse kan affisere spytt- og tårekjertler og gi tørrhet.
- Stråle-skader (tidligere kreft-behandling): Strålebehandling mot hode- og halsregionen kan skade spytt- og tårekjertler og gi tørrhet.
- Vitamin-A mangel (øyne): Kan føre til tørre øyne og nedsatt tåreproduksjon som kan forveksles med Sjøgrens.
- “Dry eyes and mouth syndrome”: En betegnelse som benyttes av noen for å beskrive pasienter med Sjøgren syndrom-liknende symptomer og funn, men med negativ biopsi. Noen av disse likner mer på fibromyalgi. Noen har funnet anti-thyreoid peroksidase antistoffer (anti-TPO) hos 60% av slike pasienter. Spyttkjertelbiopsi kan vise mild interstitiell inflammasjon.
Normal tåreproduksjon (normal Schirmers test)
- Miljøfaktorer
- klima-anlegg, røking, arbeid ved PC.
- Dysfunksjon i Meibomske kjertler, rosacea.
- Kontaktlinser.
- Cornea hypoestesi etter laserkirurgi (laser in-situ keratomileusis) eller diabetes.
- Inkomplett lukning av øyne.
Redusert tåreproduksjon (unormal Schirmers test)
- Medikament-indusert
- Antikolinerge, antihistaminer, tricykliske antidepressiva, diuretika.
- Alders-relatert/menopause.
- Strålebehandling mot hode/ansikt i anamnesen.
- Kronisk viral infeksjon (*HCV, HIV).
- Sarkoidose
- Non-Hodgkins lymfom.
- IgG-4 relatert sykdom.
Tørr munn (xerostomi)
- Medikament-indusert
- Antikolinerge, antihistaminer, tricykliske antidepressiva, diuretika, antihypertensive legemidler.
- Angst-tilstander
- Endogen depresjon
- Fibromyalgi
- Bulimi/anoreksi (ofte også store parotis-glandler)
- Strålebehandling mot hode/hals i anamnesen.
- Systemsykdom
- Sarkoidose, amyloidose, HCV*, HIV.
Parotis-hevelse
Unilateral, akutt hevelse; Bakteriell infeksjon, aktinomykose, mekanisk obstruksjon ved spyttkjertelsten i ductus.
Unilateral kronisk hevelse: ‘Kronisk sialoadenitt, kreft (pleiomorft adenom).
Bilateral kronisk hevelse: Viral infeksjon*: Kusma, EBV*, CMV*.
Bilateral kronisk hevelse: Kronisk infeksjon*: HCV*, HIV. Diabetes. Alkoholisme. Anoreksi. Amyloidose. IgG4 relatert sykdom. Hyperlipoproteinemi.
*CMV: cytomegali-virus, *EBV: Epstein-Barr-virus, *HCV: hepatitt-C virus
11. Svangerskap ved Sjøgrens syndrom
Kvinner med Sjøgrens syndrom har generelt en liten økning i svangerskapskomplikasjoner. En fransk studie av 54 svangerskap hos 19 kvinner med Sjøgrens syndrom viste en høyere risiko for spontanabort, en moderat økning i dødfødsler, og en gjennomsnittlig fødsel som fant sted én uke tidligere sammenlignet med friske kontroller (Ballester C, 2017).
Økt risiko for svangerskapskomplikasjoner foreligger spesielt hos kvinner med organspesifikk involvering, som nyresykdom (interstitiell nefritt, renal tubulær acidose), lungesykdom eller hjertesykdom. De hyppigste komplikasjonene knyttet til Sjøgrens syndrom relaterer seg imidlertid til SSA- og SSB-antistoffer, som forekommer hos de fleste pasienter (se nedenfor) (Gupta S, 2017)..
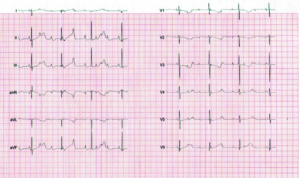
SSA og SSB antistoff og risiko for hjerteblokk hos fosteret
Hos gravide med Sjøgrens syndrom (og enkelte med SLE) kan maternale SSA- og SSB-antistoffer passere placenta og medføre føtal hjerteblokk. Risikoen anslås til ca. 2 % av tilfellene, vanligvis mellom svangerskapsuke 16 og 26 (Andreoli L, 2017; Samaritano LR, 2020).
For å redusere risiko anbefales regelmessig overvåkning av fosterets hjertefrekvens, vanligvis via jordmor eller fastlege. Amerikanske retningslinjer foreslår kontroller fra uke 16–18 til uke 26, mens europeiske retningslinjer, inkludert norske anbefalinger fra Gynekologisk forening, anbefaler overvåkning fra uke 16 til og med uke 24 (Samaritano LR, 2020; Andreoli L, 2017; Veileder Gynekologisk forening).
Ved påvist lav hjertefrekvens (<110/min) bør fosteret vurderes av spesialavdeling. Dette inkluderer vurdering av støttende medikasjon under svangerskapet, samt planlegging for pacemaker ved fødsel dersom nødvendig. Bruken av deksametason (f. eks. 4 mg oralt/dag) ved hjerteblokk grad 1–2 for å forhindre progresjon til grad III er omdiskutert. Omtrent 20 % av fostre med hjerteblokk grad III dør intrauterint eller i første leveår, og omtrent 50 % av de som fødes levende vil ha behov for pacemaker (Samaritano LR, 2020).
Alle nyfødte av mødre med SSA/SSB-antistoff bør undersøkes med EKG før utskrivelse fra barselavdelingen for å oppdage inkomplett hjerteblokk (Veileder i fødselshjelp pr juni 2021). Dette for å oppdage inkomplett hjerteblokk. Hydroksyklorokin (Plaquenil) kan ha forebyggende effekt mot kongenital hjerteblokk, særlig hos kvinner som tidligere har hatt svangerskap med denne komplikasjonen (Izmirly P, 2020).
Neonatal lupus og hematologiske forandringer. Ca. 10 % av barn født av mødre med SSA/SSB-antistoff utvikler et lupus-lignende utslett (neonatal lupus). Dette skyldes maternale antistoffer som overføres til barnet. Transiente hematologiske forandringer forekommer hos ca. 20 % (cytopenier), og lett forhøyede transaminaser hos ca. 30 % (Wahren-Herlenius M Dubois’ lupus erythematosus and related syndromes. 8th ed. Philadelphia: Saunders; 2012. p. 464–72). Når barnet i løpet av noen måneder kvitter seg med antistoffene, forsvinner utslettet og de øvrige forandringene.
Hematologisk kontroll, inkludert celletellinger, kan være aktuelt ved 3 måneders alder. Ved 9 måneders alder er symptomene vanligvis helt tilbake (Zuppa AA, 2017). Barn som får lysbehandling for ikterus er spesielt utsatt for eksantem. Ytterligere informasjon finnes hos NKSR vedrørende gravide med SSA/SSB-antistoff.
12. Behandling
Pasienten har rett til informasjon og skal være innforstått med behandlingsmålet. Det er viktig å informere om hensikten med behandlingen, hva den innebærer, og risikoen for bivirkninger. Informasjonen kan suppleres med skriftlig medikament-informasjon fra Norsk revmatologisk forening/Legeforeningen. Ved god informasjon oppnås at medikamentene i større grad tas etter hensikten. Vennligst les om behandlingssvikt i eget kapittel.
Behandlingsmålet ved Sjøgrens syndrom er vanligvis å lindre symptomer og redusere risikoen for komplikasjoner. Indikasjonen for spesifikke medikamenter er hovedsakelig begrenset til spesielle komplikasjoner. Imidlertid pågår en rekke studier med B-cellerettede medikamenter som kan endre behandlingsmulighetene fremover (Du W, 2021).
Tørre øyne:
- Profylaktisk og symptomatisk behandling: Hyppig bruk av kunstige tåredråper anbefales (f.eks. Viscotears, Artelac). Gel (f.eks. Viscotears) er særlig nyttig om kvelden.
- Dysfunksjon i Meibomske kjertler: Midler som inneholder fettstoffer (f.eks. Cationorm, Systane Balance, Oxyal Triple Action, Tearsagain øyespray) kan være nyttig. Disse er per 2025 ikke på blå resept.
- Antiflogistika: Øyedråper som inneholder NSAIDs bør ikke brukes lenger enn 2-4 uker for å unngå skade på cornea (Majtanova N, 2024)
- Tårekanalplugging: Kan forsøkes (øyeavdeling), men er sjelden vellykket på sikt.
- Ciclosporin øyedråper (Ikervis, Restasis): Kan dempe immunreaksjonen på sikt (langsom resons) ved sicca-keratitt og har effekt hos noen pasienter. Ciclosporin øyedråper forskrives initialt av øyelege (Majtanova N, 2024).
- Serum-øyedråper: Effekten er ikke godt dokumentert fordi studier har vist motstridende resultater (Pan Q, 2017). Nytte hos enkelte pasienter er likevel mulig.
- Mesenkymale stamceller har et behandlingspotensiale, enten de injiseres i tårekjertler eller som øyedråper. Behandlingen er ennå på forskningsstadiet (Zhang Q, 2025).
Tørr munn
- God munnhygiene er viktig for a motvirke karies.
- Fluortannpasta: Bruk fluortannpasta som ikke skummer (f.eks. Zendium).
- Spyttstimulering: Sukkerfrie sugetabletter kan stimulere spyttsekresjonen.
- Hyppig rengjøring: Rengjøring av tenner og bruk av fluor etter hvert måltid.
- Kosthold: Unngå søtsaker.
- Hydrering: Drikk rikelig.
- Regelmessig tannlegekontroll: Fast kontroll hos tannlege med interesse for Sjøgrens syndrom anbefales.
Andre manifestasjoner
- Tørr hud kan behandles med fuktighetskremer.
- Tørr skjede kan behandles med østrogenkrem.
- Pankreasinsuffisiens vurderes av gastroenterolog ved behov. Pankreas-enzymer (f. eks. Creon) kan forsøkes.
Systemisk behandling
(Forslagene er oppdatert etter EULAR, Ramos-Casals M, 2019)
Det finnes per i dag ingen medisiner som kan kurere Sjøgrens syndrom. Sykdommen er kronisk, og behandlingen fokuserer derfor på å lindre symptomer og forebygge komplikasjoner og skader på indre organer hvis sykdommen har systemiske manifestasjoner. Immunmodulerende, systemisk behandling brukes når Sjøgrens syndrom påvirker andre organer i kroppen som ledd, hud, nyrer, lunger eller nervesystemet. Hensikten er å dempe den underliggende autoimmune betennelsen. En stor utfordring ved Sjøgrens syndrom er tretthet (fatigue), men det finnes ennå ingen medisiner med sikker effekt mot dette. Imidlertid pågår en betydelig forskningsinnsats for å utvikle effektive, sykdomsmodifiserende medikamenter (Marinho A, 2023).
Tabell. Systemisk medikasjon ved Sjøgrens syndrom: Indikasjoner, forventet effekt, bivirkninger og prioritet. 


| Medikament/klasse | Indikasjon(er) | Effekt på tørrhet/fatigue | Kommentarer/Bivirkninger | Referanser | Prioritet |
|---|---|---|---|---|---|
| Hydroksyklorokin | Artritt/synovitt, diffust annulært erythem, forebygging av neonatal lupus hos SSA/SSB-positive gravide | Ikke vist effekt | Kan brukes profylaktisk mot kongenital hjerteblokk | (Izmirly P, 2020). |  |
| Kortikosteroider
(prednisolon, lav- til høydose) |
Akutte glandulære manifestasjoner, polyartritt/synovitt, diffust annulært erytem, kutan vaskulitt, interstitiell lungesykdom (ILD), nyremanifestasjoner, nevrologiske og hematologiske komplikasjoner | Ikke spesifikt på tørrhet/fatigue | Lavdose foretrekkes; høyere kortvarige doser ved behov | Souza FB, 2016). |  |
| csDMARDs (f. eks. metotreksat, cyklofosfamid) | Artritt/synovitt, kutan vaskulitt, ILD, nyre- og nevrologiske manifestasjoner | Nei | Cyklofosfamid øker risiko for lymfom; brukes ved alvorlige manifestasjoner | Souza FB, 2016). |  |
| Biologiske legemidler (rituksimab, belimumab, abatacept, inanalumab) | Alvorlig glandelmanifestasjon, polyartritt, alvorlig kutan vaskulitt, ILD, nyreaffeksjon, perifer nevropati, CNS-affeksjon, hemolytisk anemi | Nei | Rituksimab anti-CD20 har variabel effekt; TNF-hemmere har ingen etablert indikasjon | Souza FB, 2016).; Alvarez-Rivera N, 2021 |  |
| tsDMARDs/JAK hemmere | Hudvaskulitt når annen behandling mislykkes | Nei | Utprøvende behandling | Hernandez-Molina G, 2025) |  |
| Pilokarpin (Salagen), Cevimelin (Evoax) | Stimulering av spyttsekresjon | Kan gi moderat effekt på tørrhet | Effekt tar opptil 2 mnd; bivirkninger: svette, hyppig vannlating, frysninger, hjertebank; kontraindisert ved hjertesykdom | Freige C, 2020 |  |
| Nye behandlingsprinsipper (genmodifisering, stamceller) | Restaurering av vevsfunksjon i spytt- og tårekjertler | Potensielt | Foreløpig under utprøving; sikkerhet og effekt uavklart | Zeng W, 2022; Zhao T, 2024 |  |
- Vennligst les generelt om behandling utenfor godkjent indikasjon i eget kapittel.
13. Prognose
Sjøgrens sykdom progredierer vanligvis langsomt med økende tørrhetsplager over flere år. Sjøgren-symptomene er over tid assosiert med redusert livskvalitet (Enger TB, 2011). Resultater fra noen få studier kan tyde på klinisk bedring av kjertelfunksjonen over tid til tross for tiltakende fibrosering histologisk bedømt. Studier har ikke vist sikker økt dødelighet.
Behandlingsrespons vurderes vanligvis ut i fra anamnese, klinisk-, laboratorium- og bildediagnostikk. I studier brukes også STAR respons indeks (Seror R, 2022).
Lymfom-utvikling kommer når som helst i sykdomsforløpet. «Life time risk» er estimert til 5-10%, forutsatt at de fyller US/EU kriterier for Sjøgren-diagnosen (Alunno A, 2018; Solans-Laque R, 2011).
| Komplikasjoner i forløpet av Sjøgrens syndrom (Vivino FB, 2017) | |
| Oralt | Okulært |
| Økede karies | Keratomalaci (hornhinne-smelting) |
| Tap av tenner | Hornhinne-ulcera |
| Vekttap | Bakteriell konjunktivitt |
| Oral candida | Bakteriell interstitiell keratitt |
| Sialolithiasis | Visus reduksjon |
| Bakteriell sialoadenitt | |
| Søvn-problemer | |
| Fibromyalgi | |
14. Kontroller og oppfølging ved Sjøgrens syndrom
Pasienter med økt risiko alvorlige ekstraglandulære manifestasjoner og for lymfom (se ovenfor) bør følges opp regelmessig, f. eks. hver 6-12 måned, enten hos fastlege eller revmatolog. Vedvarende eller residiverende parotishevelse kan være et alarmsignal som da kan utløse raskere vurdering.
Aktuelle undersøkelser kan omfatte en grundig anamnese med fokus på B-symptomer (nattesvette, feber, nedsatt appetitt, uforklarlig vekttap), samt undersøkelse med palpasjon av glandula parotis- og submandibularis, lymfeknuter på hals og i aksiller, lever og milt. Auskultasjon av lunger kan være viktig for å vurdere eventuell pulmonal affeksjon, og en vurdering av ledd gjøres for å avdekke artritt.
Laboratorieprøver kan inkludere:
- SR og CRP for å vurdere inflammatorisk aktivitet.
- Hb, trombocytter, leukocytter med differensialtellinger for å avdekke hematologiske avvik.
- ASAT, ALAT, kreatinin og CK for lever- nyre- og muskelstatus.
- IgG, C3, C4 for å vurdere immunglobuliner og komplementaktivitet.
- Urin stiks for å screene for nyreaffeksjon.
Pasienter uten komplikasjoner eller aktuelle risikofaktorer og med stabile prøver trenger vanligvis ikke et slikt kontroll-opplegg.
For gravide pasienter med Sjøgrens syndrom er et tett samarbeid mellom revmatolog og fødeklinikk avgjørende for å sikre optimal oppfølging av både mor og foster, spesielt med tanke på anti-Ro/SSA-antistoffer som representerer en viss risiko for kongenitt hjerteblokk hos barnet.
Andre kontroller:
-Fastlege: For de aller fleste pasienter med ukomplisert primært Sjøgrens syndrom (hovedsakelig tørre plager uten betydelige systemiske manifestasjoner eller tegn til alvorlig immunologisk aktivitet) kan oppfølgingen primært skje hos fastlegen. Pasienten bør da ta kontakt med fastlegen ved behov eller ved endring i symptomer.
-Øyelege: Anbefales for pasienter med vedvarende tørre øyne, spesielt hvis de ikke oppnår tilstrekkelig lindring med kunstig tårevæske alene eller ved tegn til korneal skade.
-Tannlege: Alle pasienter med Sjøgrens syndrom bør ha jevnlig kontroll hos tannlege for å forebygge tannråte, soppinfeksjoner og andre munnhuleproblemer som følge av redusert spyttproduksjon. Pasienter har ofte rett til refusjon av utgifter til tannhelsetjenester ved Sjøgrens syndrom.
-Andre spesialister: Ved organpåvirkning (f. eks. lunge, nyre, nervesystem) kan det være nødvendig at pasienten også følges opp av relevant spesialist.
Pasientinformasjon og egenmestring: Også i oppfølgingen kan det være nyttig å tilby pasienten god informasjon om sykdommen, behandlingen og hva de skal se etter av symptomer som krever legekontakt. Dette kan også omfatte informasjon om god munnhygiene, regelmessige tannlegebesøk, god øyehygiene, tilstrekkelig væskeinntak og unngå røyking. Også støtte og råd for å håndtere kronisk fatigue og smerter, inkludert anbefalinger om tilpasset fysisk aktivitet kan vurderes.
Utfallsmål ved Sjøgrens syndrom
I kliniske studier og i klinisk praksis for Sjøgrens syndrom brukes en rekke utfallsmål for å vurdere sykdomsaktivitet, symptomer, kjertelfunksjon og livskvalitet i sykdomsforløpet. Oftest brukes en kombinasjon av objektive og pasientrapporterte mål (Wilson R, 2024).
-ESSDAI (EULAR Sjögren’s Syndrome Disease Activiy Index) er gullstandard i kliniske studier som primært eller sekundært utfallsmål. ESSDAI kan også være nyttig i klinisk praksis for å objektivt vurdere sykdomsaktivitet og behandlingsrespons, for eksempel under behandling med biologiske midler. ESSDAI er en sammensatt indeks som vurderer aktivitet i 12 organsystemer (konstitusjonell, lymfadenopati, glandular, artikulær, kutan, pulmonal, renal, muskulær, perifer og sentralnervesystem, hematologisk og biologisk). Hvert domene scores som fraværende, mild, moderat eller alvorlig, med vektede poengsummer. ESSDAI-kalkulator (rheumcalc.com).
-ESSPRI (EULAR Sjögren’s Syndrome Patient Reported Index) brukes for pasientrapporterte data i kliniske studier (ofte som sekundært endepunkt) og i daglig klinisk praksis for å vurdere symptombyrde og respons på behandling. ESSPRI måler pasientens opplevelse av de tre mest plagsomme symptomene ved Sjøgrens syndrom: Tørrhet (global tørrhet i øyne, munn, hud, etc.), smerte (generell smerte eller leddsmerte) og fatigue. Hvert symptom scores på en visuell analog skala (VAS) fra 0 (ingen symptomer) til 10 (verst tenkelig). ESSPRI-scoren er gjennomsnittet av disse tre (Seror R, 2011).
| ESSDAI | ClinESSDAI | ESSPRI | PROFAD-SSI-SF | PROMIS-SF |
|---|---|---|---|---|
| Kutan | Kutan | Artritt | Somatisk fatigue | Smerte |
| Respiratorisk | Respiratorisk | Fatigue | Mental fatigue | Fatigue |
| Renal | Renal | Tørrhet | Artralgi | Emosjonelt ubehag |
| Artikulær | Articulær | Vaskulær dysfunksjon | Fysisk funksjon | |
| Muskulær | Muskulær | Oral tørrhet | Sosialt engasjement | |
| Perifert nervesystem | Perifert nervesystem | Tørre øyne | ||
| Sentrale nervesystem (CNS) | Sentrale nervesystem (CNS) | Kutan tørrhet | ||
| Hematologisk | Hematologisk | Vaginal tørrhet | ||
| Glandulær | Glandulær | |||
| Allmenntilstand | Allmenntilstand | |||
| Lymfadenopati | Lymfadenopati | |||
| Biologisk | ||||
| ESSDAI, EULAR Sjögren’s Syndrome Disease Activity Index; ESSPRI, EULAR Sjögren’s Syndrome Patient Reported Index; PROFAD-SSI-SF, Profile of Fatigue and Discomfort-Sicca Symptoms Inventory-Short Form; PROMIS-SF, Patient Reported Outcome Measurement Information System-Short Form. | ||||
15. Retningslinjer, anbefalinger og prosedyrer
Norsk Revmatologisk Forening / Legeforeningen
16. Litteratur
Teksten er basert på aktuell faglitteratur. Den er skrevet og gjennomgått av forfatterne. I redigeringen er kunstig intelligens brukt i noen avsnitt.
