BINDEVEVSSYKDOMMER (REV 021-033)
61 Systemisk Lupus Erytematosus (SLE) (REV 021)
Systemisk lupus erythematosus
Øyvind Palm and Jan Tore Gran
Diagnosekoder ICD-10:M32.8; M32.1 SLE med organ-affeksjon (N08.5* nyre; I32.8* perikarditt, J99.1* lunge)
Prosedyrekoder: 6-minutter gangtest: FYFX05. Intravenøs infusjon: WBGM00. Behandling med belimumab: L04AA26. Intravenøs infusjon med cytostatika: WBOC05. Behandling med cyklofosfamid: L01AA01. EKG: FPFE15
ATC koder (for legemiddelstatistikk): L04A A Immunsuppressive legemidler
Nøkkelord for journalskriving
Diagnosen basert på
- Alopesi
- Orale ulcera
- Sommerfugl-eksantem
- Generalisert, utslett, subakutt kutant lupus-eksem
- Fotosensitivitet
- Raynauds fenomen
- Serositt (pleura, perikard)
- Artritt
- Nefritt (biopsi: nefritt klasse)
- Feber
- CNS-manifestasjoner
- Tromboembolier, spontanaborter og dødfødsler
- Antistoff: ANA, DNA, Sm, SSA, andre og kombinasjoner.
- Antifosfolipid antistoff (lupus antikoagulant, kardiolipin- og beta2-glykoprotein)
Sykdomsdebut (år)
Komorbiditet
Gjennomgått behandling
Hensikten med konsultasjonen
Innhold
- Definisjon
- Historikk
- Epidemiologi
- Patogenese
- Genetikk
- Symptomer og sykdomsmanifestasjoner
- Artralgi, artritt, “Rhupus”, osteonekrose, tenosynovitt, myalgi og myositt
- Fatigue, gastrointestinalt, hematologisk, vaskulært
- Hud og hår, kardiovaskulært, nevrologisk
- Nyre
- Spesielle undergrupper av SLE
- Utredning
- Diagnose
- Klassifikasjon
- Mål for sykdomsaktivitet og skade
- Differensialdiagnoser
- Svangerskap ved SLE
- Behandling
- Oppfølging
- Prognose
- Retningslinjer
- Litteratur
1. Definisjon
Systemisk lupus erythematosus (SLE) er en klassisk autoimmun bindevevssykdom der eget immunsystem blir for aktivt og produserer et bredt spekter av autoantistoffer. Ved en feil kan immunsystemet angripe nesten ethvert av kroppens egne organer.
Sykdommen rammer oftest unge voksne kvinner (9:1), men sees også hos barn (juvenil lupus), sjeldnere hos menn og eldre personer.
SLE skilles fra lupus-typer som hovedsakelig angriper huden. Også disse er nevnt nedenfor i dette kapitlet.
Klinisk presentasjon inkluderer typisk kutane manifestasjoner (eksantem), systemiske symptomer (feber, fatigue) og muskelskjelett symptomer (artritt). Laboratorieprøver avdekker betydelige immunologiske avvik. Spesielt karakteristisk er autoantistoffer (ANA med subgrupper og anti-DNA ). Sykdomsforløpet er uforutsigbart med varierende aktivitet og organaffeksjon (Angel A, 2023; Elia A, 2025).
Prognosen har bedret seg betydelig på grunn av fremskritt i diagnostikk og behandling (Fava A, 2019; Hoi A, 2024), men SLE er fortsatt en potensielt alvorlig tilstand.
Optimal oppfølging av fertile kvinner med SLE før og under graviditet kan være avgjørende for utfallet. Aktiv sykdom, sekundært antifosfolipid syndrom eller uheldig medikasjon (over- eller underbehandlet) øker risikoen for uønskede svangerskapsutfall, mens riktig håndtering reduserer risikoen (Skorpen AC, 2021).
2. Historikk
Begrepet lupus (ulv) stammer fra det 12. århundre og den italienske legen Rogerius Frugard som beskrev ulcererende sår på pasientenes ben (Thomas, Jr, Donald E. 2014 The Lupus Encyclopedia), men det var neppe SLE som var årsaken. Lupus-relasjon ved SLE har imidlertid flere alternative forklaringer. En forbindelse til “lupus vulgaris” er mulig, der en tuberkuløs hudsykdom i ansiktet kan ligne sår etter ulvebitt.
Forbindelsen mellom hudmanifestasjon og SLE ble først beskrevet som hudsykdom av Pierre Louis Alphée Cazenave i 1851. Den ble definert som en systemsykdom i 1872 av Moritz Kaposi som også beskrev sommerfugleksantemet (Smith CD, 1988). Kaposi er også kjent for Kaposis sarkom som ikke er relatert til lupus.
Den moderne forståelsen av SLE startet med oppdagelsen av lupusceller (LE-celler) i 1948 av Hargraves, etterfulgt av påvisning av antinukleære antistoff (ANA) av Miescher i 1954 og identifisering av DNA av Seligman i 1957 (Arnaud L, 2020).
Historisk sett har en rekke behandlingsmetoder blitt forsøkt mot SLE, inkludert varme, ulike kjemiske substanser, radium (1900-1905) og lysbehandling (!) og ultrafiolette stråler (1905). Kinin ble introdusert i 1894, mens mer moderne behandlinger som glukokortikoider (1948-1952), klorokin (1951), cyklofosfamid (1954), hydroksyklorokin (1956), azathioprin (1957) og mykofenolat mofetil (1980-årene) ble utviklet i andre halvdel av det 20. århundre.
En økende forståelse av sykdomsmekanismene kombinert med omfattende legemiddelstudier har de siste tiårene ført til utvikling av nye og mer effektive behandlingsmetoder (Arnaud L, 2020).
3. Epidemiologi
SLE rammer kvinner omtrent ti ganger oftere enn menn. Sorte amerikanere er dobbelt så hyppig rammet sammenlignet med kaukasiere, og asiater har en ca. 30% økt risiko (Somers EC, 2014). De utsatte etniske gruppene har ofte tidligere sykdomsdebut og et mer alvorlig forløp (Lim SS, Arthritis Rheum 2009).
Kvinner i fertil alder mellom 25 og 34 år er mest utsatt. Hos 20-30% av pasientene oppstår SLE før voksen alder (JSLE), oftest i tenårene. Sjeldne genetiske varianter kan føre til enda tidligere debut. SLE debuterer sjeldnere etter 50-års alder (late-onsetlupus, selv om noen data indikerer opp til 20% debut i laderen 50-65 år (Mruthyunjaya P, 2025).
En befolkningsstudie fra Oslo viste en årlig insidens på 3,0 per 100 000 og en prevalens på 51,8 per 100 000 (Lerang K, 2012). En senere dansk befolkningsstudie fant sammenlignbare data med insidens på 2,35 per 100.000 og prevalens 45,2 per 100.000 (Hermansen M, 2016). Nyere norske data kan indikere en synkende insidens av sykdommen (insidens 1,6 per 100 000 per år) (Haukeland H, 2024).
4. Patogenese
Sykdomsårsaken til SLE er kompleks og involverer et samspill mellom genetiske, epigenetiske, hormonelle og immunopatologiske faktorer. Miljøfaktorer (f eks infeksjoner) kan også spille en rolle (Cardelli C, 2024). Som ved andre autoimmune sykdommer medfører immunologisk dysregulering et tap av immunologisk toleranse for eget vev (autoimmunitet) i forløpet (patogenesen).
Dysregulering av Immunsystemet: Både det innate og det adaptive immunsystemet er involvert i SLE. Type-I interferon (IFN) spiller en viktig rolle i patogenesen ved å hyperaktivere gener som koder for pro-inflammatoriske molekyler (Barrat FJ, 2019). Interferon øker også T-celle/B-celle interaksjoner via økt CXCL13 (Law C, 2014). Et stimulert immunsystem produserer antistoffer rettet mot ulike nukleære proteiner/antigener (Pisetsky DS, 2023).
Immunkomplekser og organskade: Antistoffene kan forårsake at immunkomplekser dannes. Immunkompleksene bidrar til organskade via komplementsystemet. Ved aktiv SLE har pasienter ofte lavere verdier av komplement-faktorene C3 og C4.
Apoptose og autoantigener: Økt celledød (apoptose) kan skje spontant eller utløst av miljøfaktorer. For eksempel UV-B stråler gi apoptose av keratinocytter som ved tilstedeværelse av anti-SSA (anti-Ro) antistoff føre til fotosensitivt utslett. Apoptose frigjør intracellulære autoantigener til ekstracellulært miljø. På denne måten kan autoimmunitet induseres.
Redusert evne til å fjerne apoptotisk cellemateriale medfører eksponering for antigen og kan føre til stimulering av autoreaktive celler (Gatto M, 2013). Mot slike antigener foreligger ikke immunologisk toleranse, noe som fører til produksjon autoantistoffer og utløsning av store mengder pro-inflammatoriske cytokiner (Accapezzato O, 2023).
5. Genetikk
Genetiske faktorer bidrar til utviklingen av SLE og ANA-positivitet (Chun S, 2025). Dette understøttes av tvillingstudier som viser rundt 25 % konkordanse for SLE hos monozygote tvillinger som deler hele sitt genom (Deapen D, 1992). Førstegradsslektninger av personer med SLE har en klart økt risiko både for sykdom (2–5 %) og for å utvikle autoantistoffer uten manifest sykdom.
Flere immunogenetiske markører er assosiert med SLE. HLA-klasse II-variantene DR3 og DR15 forekommer hyppigere hos SLE-pasienter og påvirker antigenpresentasjon og T-celleaktivering sentralt i sykdomsutviklingen. Medfødte komplementmangler, særlig i den klassiske aktiveringsveien, gir også økt risiko for SLE ved at mangelfull clearance av apoptotisk materiale kan trigge autoimmunitet.
Enkelte monogene defekter kan gi alvorlige eller tidlig debuterende SLE-former. Dette gjelder blant annet genetisk interferonopati, prolidase- og PKCδ-mangel, samt mutasjoner i DNASE1L3, som gir redusert nedbrytning av DNA og dermed økt immunaktivering (Vinuesa CG, 2023).
Selektiv IgA-mangel som er den hyppigste primære immunsvikten er også assosiert med både HLA-varianter og monogene mutasjoner og kan ledsages av økt forekomst av autoimmunitet og infeksjoner (Abolhassani H, 2016; Killeen RB, 2023).
Samlet tyder disse observasjonene på at genetisk disposisjon utgjør en viktig del av SLE-patogenesen, og at ulike genetiske mekanismer antakelig bidrar til ulike sykdomsfenotyper (Rivas-Larrauri F, 2016).
6. Symptomer og manifestasjoner
SLE har varierende symptomer. Autoimmun skade på hud, slimhinner, ledd, indre organer, blod– og nervesystem medfører veldig forskjellige sykdomstegn. Dessuten kan organskade akkumuleres over tid og kan føre til organsvikt (Dörner T, 2019).
Symptombildet kan i utgangspunktet virke diagnostisk forvirrende. Noen symptomer er mer typiske i tidlig fase av sykdommen, mens andre ofte utvikles senere i forløpet (Piga M, 2023).
Tidlige symptomer: Det vanlig med påvirket allmenntilstand som kan inkludere:
- Utmattelse/fatigue: En overveldende følelse av tretthet som ikke bedres av hvile.
- Redusert appetit og vekttap.
- Influensalignende slapphet.
Samtidig kan mer typiske sykdomstrekk observeres i tidlig fase (Mok CC. 2014):
- Alopeci: Oftest flekkvis håravfall, men kan også være diffust hårtap.
- Artralgi: Nyoppståtte leddsmerter, ofte i fingerledd.
- Artritt: Leddbetennelse som typisk er symmetrisk og affiserer småledd (f.eks. fingre) og kan ligne tidlig revmatoid artritt (RA)
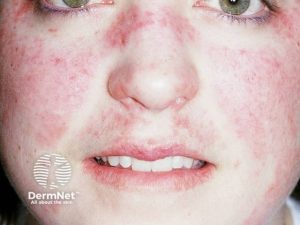
- Eksem (malart) i ansikt: Karakteristisk sommerfuglutslett over kinn og neserygg.
- Fotosensitivitet: Markert hudutslett utløst av lys- og soleksponering.
- Munnsår: Oftest smertefrie sår i munnhulen.
- Pleuritt/pleurasmerter: Smerter i brystkassen som forverres ved dyp inspirasjon.
- Raynauds fenomen: Anfallsvis blekhet, cyanose og rødme i fingre og tær, ofte utløst av kulde eller stress.
Senere symptomer: Etter hvert som sykdommen progredierer og ved mer alvorlig sykdomsaktivitet kan følgende symptomer og komplikasjoner utvikles:
- Avaskulære skjelettnekroser: Celledød i beinvev grunnet nedsatt blodtilførsel, hyppigst i hofter og skuldre. Kortikosteroider, antifosfolipidsyndrom og høy SLE-aktivitet øker risikoen.
- Cytopenier: Reduksjon i antall blodceller som hemolytisk anemi, leukopeni eller trombocytopeni.
- Fatigue/utmattelse vedvarer ofte og kan forverres over tid.
- Lungeblødning (diffus alveolær blødning): En alvorlig og potensielt livstruende komplikasjon der blødning oppstår i lungealveolene. Høy sykdomsaktivitet, trombocytopeni og antifosfolipidsyndrom er risikofaktorer.
- Perikarditt og perikardvæske: Inflammasjon i perikard med væskeansamling rundt hjertet som i sjeldne tilfeller kan føre til perikardtamponade.
- Nevropsykiatriske symptomer involverer sentralnervesystemet som psykose, epileptiske kramper. Høy sykdomsaktivitet, ung alder og anti-ribosomal P-antistoff i blodet disponerer.
- Pleuravæske. Væskeansamling mellom lungehinnene grunnet pleuritt.
- Tromboembolier i arterier eller vener. Antifosfolipidantistoff syndrom (APS) er en autoimmun tilstand som kan foreligge hos mellom 7 % og 15 % av SLE-pasientene (Sayar Z, 2021) og øker risikoen for komplikasjoner som dyp venetrombose, lungeemboli, slag og spontanaborter.
Kliniske sykdomsmanifestasjoner
Artralgier, definert som leddsmerter uten objektiv inflammasjon (som hevelse eller rødhet) er et av de mest universelle symptomene ved SLE og rammer nesten alle pasienter (anslagsvis 95 %). For omtrent 50 % av pasientene er muskelskjelett-symptomer de debuterende manifestasjonene av sykdommen (von Vugt RM, 1998; di Metteo A, 2018).
Artritt er en vanlig manifestasjon ved SLE og inngår i sykdommens klassifikasjonskriterier. Leddaffeksjon er blant de første og hyppigste manifestasjonene ved SLE, og symptomene korrelerer ofte med sykdomsaktiviteten.
-Artritt ved SLE er som oftest non-erosiv, i motsetning til ved revmatoid artritt (RA). Den kan være migrerende, symmetrisk, og affisere både små ledd (særlig fingre og håndledd) og større ledd (som knær og skuldre). Akutt artritt kan klinisk etterligne RA og presentere seg med leddhevelse, smerte og stivhet.
-Kronisk artritt kan føre til deformiteter, og den mest karakteristiske formen er Jaccoud artritt/deformiteter som oppstår hos om lag 10 % av pasientene med SLE. Denne affiserer typisk ledd i hender og føtter og kan klinisk ligne deformitetene ved RA. Jaccouds deformiteter skyldes svekkede sener og ligamenter. Dette kan medføre subluksasjoner og feilstillinger som ulnar deviasjon og svanehalsdeformitet. Et sentralt kjennetegn som skiller Jaccouds artropati fra RA er fravær av erosjoner ved bildediagnostikk til tross for uttalte deformiteter.
-Radiologisk sees dermed vanligvis ikke erosjoner, men unntak forekommer, spesielt hos pasienter der leddmanifestasjonene ved SLE har revmatoid artritt (RA) -lignende trekk.
Rhupus (SLE–RA-overlapp). En liten andel av pasientene utvikler erosiv polyartritt i form av “rhupus-artritt” som representerer en overlappstilstand mellom SLE og RA. Denne formen kan føre til leddsdestruksjon og deformiteter, og pasientene har ofte både anti-CCP-antistoffer (karakteristisk for RA) og lupusantistoffer (f.eks. ANA, anti-dsDNA). Begrepet rhupus brukes når pasienter oppfyller kriterier for begge sykdommer.
Smertenivået ved SLE-artritt er ikke nødvendigvis proporsjonalt med graden av deformitet. Mange pasienter beholder overraskende god håndfunksjon til tross for betydelige leddforandringer.
-Behandlingen av artritt ved SLE ligner i hovedtrekk den ved RA. DMARDs (sykdomsmodifiserende antirevmatiske legemidler) er grunnpilaren, hvor metotreksat er det mest brukte. Leflunomid, abatacept og rituksimab kan vurderes som alternativer ved manglende effekt. TNF-hemmere kan i sjeldne tilfeller indusere lupus eller forverre eksisterende sykdom og brukes derfor kun unntaksvis ved uttalt SLE-artritt, og da utenfor godkjent indikasjon. Behandlingen bør alltid individualiseres ut fra sykdomsaktivitet, organspesifikke manifestasjoner og risiko for bivirkninger (Horimotoa AMC, 2016, Tani C, 2013; Sargin G, 2018).
Andre manifestasjoner fra bevegelsesapparatet
SLE kan utenom leddene også affisere andre deler av bevegelsesapparatet:
Aseptisk bennekrose (osteonekrose) innebærer celledød i beinvevet på grunn av iskemi. Den rammer hyppigst vektbærende ledd som hofter og skuldre og sees hos 4–30 % av pasientene med SLE. Aseptisk bennekrose kan oppstå som en direkte følge av SLE-sykdommen (høy sykdomsaktivitet), men er også en kjent sekundær komplikasjon til langvarig bruk av høye doser kortikosteroider. Også antifosfolipidsyndrom kan disponere. Symptomer inkluderer smerte i og omkring det affiserte leddet, spesielt ved belastning og bevegelsesinnskrenkning.
Tenosynovitt: Inflammasjon i seneskjedene er en vanlig manifestasjon ved SLE. Dette kan gi smerter, hevelse og ømhet langs senene som ved håndledd, ankler og føtter og kan bidra til nedsatt bevegelighet.
Myositt og myalgi: Myalgi er svært vanlig og rammer nær 50 % av SLE-pasientene. En mindre andel, rundt 10 % eller færre, utvikler myositt. Lupus-assosiert myositt er vanligvis subklinisk, noe som betyr at den ikke alltid gir typiske symptomer ved klinisk undersøkelse. En lett forhøyelse av kreatinkinase (CK) i blodet kan imidlertid observeres. I sjeldne tilfeller kan mer uttalt myositt med signifikant muskelsvakhet forekomme, noe som krever grundigere utredning og behandling (Cotton T, 2021; Matteo AD, 2021).
Fatigue er et av de mest fremtredende og plagsomme symptomene ved SLE. Så mange som over 80% av pasientene kan påvirkes (Cornet A 2021). Fatigue er en gjennomgripende følelse av utmattelse og energimangel som ikke bedres av hvile og som har negativ innvirkning på daglig funksjon og livskvalitet.
Graden av fatigue trenger ikke korrelere med objektiv sykdomsaktivitet målt ved kliniske parametere eller laboratorieprøver. Dette gjør fatigue til en kompleks medisinsk utfordring, da den ikke alltid kan forklares eller behandles utelukkende ved å dempe immunologisk sykdomsaktivitet.
Bakgrunnen for fatigue ved SLE er ikke godt forklart, men antas å være multifaktoriell. Smerte, depresjon, søvnforstyrrelser, fysisk inaktivitet og psykososiale forhold kan være av betydning. I noen tilfeller er også bivirkninger av medikamenter og anemi medvirkende (Fangtham M, 2019).
Fatigue defineres ikke som CNS-manifestasjon ved SLE i klassifikasjonssammenheng, selv om den kan påvirke kognitiv funksjon og mental energi.
Tiltak mot fatigue kan omfatte farmakologiske intervensjoner, tverrfaglig tilnærming med kognitiv atferdsterapi, fysisk aktivitet og stressmestring (Kawka L, 2021)
Gastrointestinale manifestasjoner:
Gastrointestinale symptomer. Klinisk erkjente gastrointestinale manifestasjoner beskrives hos 8–10 %. Obduksjonsstudier påviser imidlertid gastrointestinal involvering hos hele 60–70 %, slik at subklinisk eller uerkjent involvering er vanlig.
De fleste gastrointestinale manifestasjonene ved SLE er relativt milde. Dette kan inkludere symptomer som kvalme, oppkast, diaré og magesmerter. Disse symptomene kan ofte håndteres med symptomatisk behandling og justering av SLE-medisineringen.
I munn og svelg kan pasientene også plages med siccafenomerer/xerostomi, orale ulcera og dysfagi ved øsofagusdysmotilitet.
Vaskulitt og trombose i tarmen er sjeldne, men kan forårsake livstruende manifestasjoner. De føre til iskemi (“lupusenteritt”), perforasjon og infarkt i tarmen. Budd-Chiari syndrom der blodstrømmen fra leveren blokkeres, ofte assosiert med antifosfolipid syndrom. Disse alvorlige komplikasjonene krever øyeblikkelig medisinsk intervensjon for å unngå betydelig sykelighet og dødelighet (Frittoli RB, 2021).
Andre manifestasjoner er pseudoobstruksjon (pga. nevropati eller vaskulitt), peritonitt, pankreatitt (pga. sykdomsaktivitet eller medikasjon) og lupoid hepatitt. Vanligste årsaker til forhøyde leverenzymer ved SLE er imidlertid medikamenter som azathioprin og NSAIDs (Frittoli RB, 2021).
Hematologiske/retikuloendoteliale manifestasjoner (Blod og lymfeknuter)
SLE kan angripe blod, benmarg og lymfeknuter på flere måter, noe som kan gi diagnostiske ledetråder, men også kreve spesifikk håndtering (Santacruz JC, 2022).
- Lymfadenopati med forstørrede lymfeknuter forekommer hos ca. 50 % av pasientene med SLE. Dette skyldes reaktiv hyperplasi ved kronisk immunaktivering. Lymfeknutene er ved palpasjon bevegelige, ikke-ømme og kan være generaliserte eller lokalisert til enkelte regioner som halsen, aksillen eller lysken. Ved påfallende ømme, vedvarende lymfeknuter på halsen er det relevant å vurdere differensialdiagnoser, inkludert Kikuchi Fujimoto sykdom (histiocytisk nekrotiserende lymfadenitt), som kan forekomme samtidig med eller maskere SLE. Det er også viktig å utelukke infeksjoner eller lymfom.
- Splenomegali. Splenomegali ses hos 15–20 % av pasientene med SLE. Dette skyldes økt aktivitet i milten for fjerning av antistoff-belagte blodceller og immunkomplekser.
- Cytopeni: Inngår i klassifikasjonskriteriene og er en vanlig manifestasjon ved SLE. De vanligste cytopeniene inkluderer:
- -Anemi: Ofte normokrom normocytær anemi (anemi ved kronisk sykdom), men kan også skyldes autoimmun hemolytisk anemi (AIHA) med positiv Coombs test, jernmangelanemi eller sjeldnere at benmargen produserer for få erytrocytter.
- -Leukopeni: Reduserte nivåer av hvite blodlegemer, spesielt lymfocytter (lymfopeni) kan skyldes perifert forbruk/destruksjon eller redistribusjon av cellene.
- -Trombocytopeni: Reduserte nivåer av trombocytter kan skyldes autoimmun destruksjon (immun trombocytopeni) og kan variere fra mild til alvorlig med økt blødningstendens.
Vaskulære manifestasjoner
Vaskulære manifestasjoner er hyppige ved SLE og reflekterer den systemiske betennelsen i blodårene:
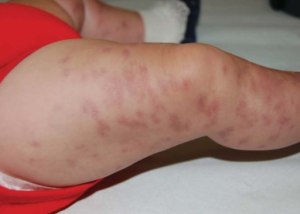
-Kutan vaskulitt. Betennelse i hudens små blodårer er vanlig og kan manifestere seg som palpabel purpura, urtikariell vaskulitt eller nekrose på fingre (pulpa/neglesenger) og albuer. Disse lesjonene kan være smertefulle og potensielt føre til sår.
-Raynauds fenomen. Dette er en vasospastisk tilstand som fører til anfallsvis blekhet, cyanose (blåfarging) og deretter rødme i fingre og tær, ofte utløst av kulde eller stress. Raynauds fenomen forekommer hos 5–26 % av SLE-pasienter og er spesielt assosiert med tilstedeværelse av anti-RNP antistoffer.
-Residiverende tromboflebitt: Gjentatte anfall av betennelse og trombedannelse i overfladiske vener.
-Arterielle/venøse tromboser. Dannelse av blodpropper i enten arterier og vener er en alvorlig komplikasjon ved SLE. Dette skyldes ofte tilstedeværelsen av antifosfolipid antistoffer. Antifosfolipidsyndrom (APS) kan forekomme primært eller sekundært til SLE og øker risikoen for dyp venetrombose, lungeemboli, slag, hjerteinfarkt og svangerskapskomplikasjoner.
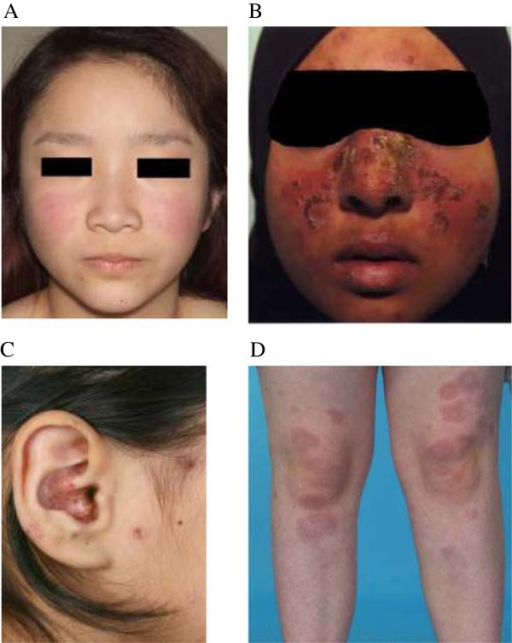
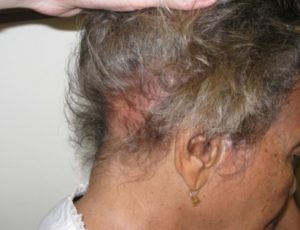
Alopesi (hårtap) er en relativt vanlig og ofte plagsom manifestasjon ved SLE som forekommer hos omtrent 50%. Hårtapet ved SLE kan være forårsaket av ulike faktorer, inkludert sykdomsaktivitet, vaskulære forandringer, medisinering og ernæringsmessige mangler (f. eks. jernmangel) (Perales A, 2023). Alopesi er også et av klassifikasjonskriteriene for SLE (Forouzan P, 2020). Hårtapet ved SLE kan manifestere seg på forskjellige måter:
- Diffust hårtap: Dette er den vanligste formen med generell tynning av håret over hele hodebunnen. Ofte foreligger inflammasjon rundt hårsekkene i perioder med aktiv sykdom. Dette hårtapet er vanligvis ikke-arrdannende, slik at hårsekkene ikke blir permanent ødelagt, og håret kan vokse ut igjen når sykdomsaktiviteten er kontrollert.
- Flekkvis håravfall (alopecia areata-lignende): Klassisk alopecia areata defineres ofte som en egen autoimmun tilstand, men SLE-pasienter kan utvikle et lignende mønster. Alopecia areata har velavgrensede, runde eller ovale områder med hårtap. Disse er også typisk ikke-arrdannende.
- Hårtap assosiert med diskoid lupus erythematosus (DLE) er en mer alvorlig form som er spesifikk for kutan lupus. DLE-lesjoner i hodebunnen forårsaker arrdannende (cicatricial) alopesi. Hårsekkene blir irreversibelt skadet av den kroniske inflammasjonen. Dermed blir hårtapet permanent i de affiserte områdene. Huden i disse områdene kan fremstå rød, skjellende, hyper- eller hypopigmentert med synlige tegn på arrdannelse og tap av hårfollikler.
- Lupus Hair (Lupus hår): Dette refererer til korte, skjøre hårstrå som vokser langs hårfestet, spesielt i pannen. Dette er et karakteristisk tegn som kan ses ved SLE.
Hudmanifestasjoner er et fremtredende trekk ved SLE og er ofte blant de første symptomene som observeres. Eksantem ses initialt hos 20–25 % av pasientene. I løpet av sykdommens forløp utvikler opptil 70 % hudforandringer (Sontheimer RD 1996). Akutt kutan lupus (ACLE), subakutt kutan lupus (SCLE) og diskoid lupus erythematosus (DLE) er alle inkludert i de diagnostiske klassifikasjonskriteriene for SLE.
Typer hudmanifestasjoner ved SLE
Flere typer utslett kan forekomme ved SLE, hver med sine karakteristiske trekk Stull C, 2023; Fijalkowska A, 2024):
- Sommerfugleksantem (“Butterfly rash”): Dette klassiske utslettet dekker kinn og neserygg og ses hos 10–50 % av pasientene. Det er ofte erytematøst og lett elevert.
- Soleksem (Fotosensitivitet): Omtrent 40 % opplever utslett som er utløst eller forverret av soleksponering. Dette er spesielt assosiert med høye titere av SSA/Ro og SSB/La antistoffer.
- Purpura: Ses hos rundt 15 % og skyldes ofte kutan vaskulitt som kan gi små blødninger i huden.
- Diskoid lupus erythematosus (DLE): Ses hos 10–12 % av SLE-pasientene. DLE-lesjoner er typisk velavgrensede, røde plakk med skjell og follikulær plugging som kan føre til arrdannelse og permanent hårtap dersom de sitter i hodebunnen.
- Urticaria: Elveblest-lignende utslett forekommer hos cirka 8 % av pasientene.
- Andre dermatitter som bulløse former, urtikariell vaskulitt, papulo-nodulær form og erythema annulare er mindre vanlige manifestasjoner.
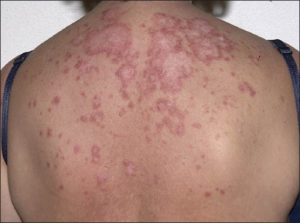
Varianter av kutan lupus (dominerende hudmanifestasjoner)
Det er en pågående diskusjon om hvorvidt de forskjellige variantene av kutan lupus representerer egne sykdommer eller er subgrupper av SLE:
-Chilblain LE (Pernio-lignende lupus): Denne varianten presenterer seg med DLE-lignende plakk eller små noduli som er lokalisert på dorsale og laterale deler av hender, føtter, ører, nese, albuer eller knær. Debut kan være i kuldeperioder. Lokalisasjon til fotsålene kan medføre nekroser. Dersom Chilblain lupus opptrer som den eneste manifestasjonen, er risikoen for å utvikle systemisk SLE beregnet til ca. 18 % (Whitman PA, 2020).
Lupus profundus (LE profundus) er også kjent som lupus pannikulitt involverer fettvevet under huden. Den manifesterer seg ofte som subkutane noduli og kan forekomme samtidig med DLE-lesjoner.
Hypertrofisk LE: Karakteriseres av indurerte og hyperkeratotiske plakk. Denne formen forekommer ofte samtidig med DLE.
Kronisk granulomatøs lupus er ikke en egen sykdom, men en spesiell histopatologisk presentasjon av hudmanifestasjonene ved SLE.
Neonatal SLE rammer nyfødte av mødre med SSA/Ro og/eller SSB/La antistoffer. Svært mange av disse spedbarna har dermatitt. Dette skyldes passiv overføring av antistoffene i høye titere fra mor via placenta. Se mer under avsnittet om svangerskap ved SLE.
Subakutt Kutan Lupus Erythematosus (SCLE): SCLE er en autoimmun sykdom som primært rammer huden og ofte er assosiert med symptomer som tørrhet i slimhinner (sicca-symptomer) og uttalt fotosensitivitet. Kaukasiske kvinner i 50-årsalderen er mest utsatt. SCLE er sterkt assosiert med tilstedeværelse av SSA/Ro og/eller SSB/La antistoffer, slik som også ses ved Sjøgrens syndrom.
- Symptomer: Eksantemet starter ofte med små, røde og lett skjellende flekker som utvikler seg til enten psoriasis-lignende eller runde (annulære/polycykliske) former. Utslettet forekommer vanligvis på lysutsatte områder som hals, nakke, bryst, overarmer og i mindre grad ansikt. Kantene er ofte røde og kan noen ganger ha skorper. Det kan ha sentral hypopigmentering. Disse lesjonene er ikke-arrdannende, men kan etterlate seg postinflammatoriske hypo- eller hyperpigmentering.
- Undersøkelser: Ved SCLE kan vise forhøyet senkningsreaksjon (SR) og leukopeni. I sjeldne tilfeller har pasientene affeksjon av indre organer, selv om SCLE primært er en kutan form for lupus.
- Antistoffer: ANA påvises hos 75–80 %. Anti-SSA/Ro antistoffer er vanligste subgruppe (40–100 % av pasientene). Anti-SSB/La antistoffer finnes hos 12–42 % og revmatoide faktorer (RF) kan påvises hos 33 % (Jore S, 1997).
- Histopatologiske forandringer: Biopsi av hudlesjoner viser histologiske forandringer som ligner diskoid lupus, men uten uttalt hyperkeratose eller follikulær plugging, noe som bidrar til den ikke-arrdannende karakteren.
- Behandling: Behandlingen av SCLE inkluderer primært solbeskyttelse, kortikosteroidkremer eller -salver og hydroksyklorokin (Plaquenil) (Jore S, 1997).
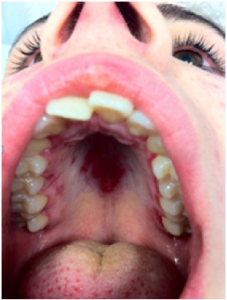
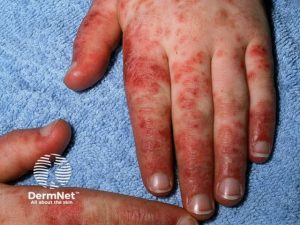
Slimhinner. Ulcera i munn (foto ovenfor) og slimhinner. Orale sår inngår i klassifikasjonskriteriene. De er ofte små, runde sår og kan være smertefulle eller nesten asymptomatiske. Tunge og svelg kan også rammes. Sekundært Sjøgrens syndrom medfører daglig tørrhet i øyne og munn (siccasymtpomer), oftest etter flere års sykdomsforløp.
Kardiovaskulære sykdommer ved SLE
Kardiovaskulære komplikasjoner er mer vanlig ved SLE enn i befolkningen ellers. Fokus på disse er derfor viktig for å redusere mortaliteten ytterligere (Frostegård J, 2023).
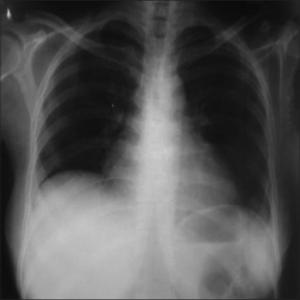
Perikarditt kan ses klinisk hos 29 %, ved EKKO 37 %, ved autopsi 66 %.
Tachykardi, vanligst sinus-tachykardi forekommer hos opp til 50% av pasientene. Noen har også atrieflimmer og ekstraslag, særlig ved høy sykdomsaktivitet og myokard-affeksjon. Maligne ventrikulære arytmier ses imidlertid sjeldent ved SLE. Endokarditt må utelukkes. (Teixeira, R.A. 2014).
Endokarditt (Libman-Sachs 13-65 %, bakteriell 2 %).
Myokardinfarkt kan forekomme i tidlig sykdomsfase og påvises ved EKG, samt stigning av CK-MB og cTnl (Troponin som er spesifikt for myokardskade).
Myokarditt (ved EKKO 2 %).
Koronar arteritt: 8 %, høy mortalitet.
Pulmonal hypertensjon er økt trykk i høyre atrium og lungearterien og ses hos ca. 4% ved SLE, (Parabu A, 2009).
Aterosklerose. Personer med SLE har en 5 til 50 ganger høyere risiko for myokardinfarkt sammenlignet med normalbefolkningen. Årsakene er sammensatte. Risikofaktorer som hypertensjon, røking, overvekt og diabetes mellitus type 2 kan være av betydning (Bolla E, 2024). Ultralyd av carotis- og femoralis-arteriene kan diagnostisere plakk og økt intima-media fortykkelse som er risikofaktorer for ateromatose sykdom (Njeves CEF, 2016).
Nevrologiske manifestasjoner
SLE kan ramme både det perifere og det sentrale nervesystemet (CNS).
-Perifere nervesystem: Akutt inflammatorisk demyeliniserende polyradikulitt (Guillain-Barre syndrom), autonome tilstander, mononeuropati singel-/multipleks, myastenia gravis, nevropati, pleksus sykdom, polynevropati.
-Nevropsykiatrisk lupus (CNS): Nevropsykiatriske symptomer hos pasienter med SLE er ofte uspesifikke og kun omtrent 30 % kan direkte tilskrives lupusaktivitet (Hanly JG, 2020). Manifestasjoner kommer oftest tidlig i sykdomsforløpet, gjerne samtidig med annen systemisk aktivitet og karakteristiske autoantistoffer. Patologiske funn viser ofte en blanding av mekanismer, særlig mikrotromboser (37–55 %), vaskulitt og cerebrale infarkter. Anti-ribosom-P-antistoffer kan forekomme, men er verken sensitiv eller spesifikk for NPSLE (Deijins SJ, 2020). ACR definerer 19 nevropsykiatriske manifestasjoner ved SLE (ACR, 1999.
Tabell: Nevropsykiatriske manifestasjoner ved SLE (Hanly JG, 2020). 🟩 Vanlig, 🟧 Nokså vanlig, 🟥 Sjelden
| Kategori | Manifestasjoner | Forekomst | Kliniske trekk / kommentarer |
|---|---|---|---|
| Hodepine | Migrene, uspesifikk hodepine | 🟩 >50 % | Ikke spesifikk for SLE |
| Vaskulær sykdom | TIA, slag, trombotiske hendelser | 🟧 15 % | Mikrotromboser forekommer hos 37–55 % |
| Mood disorders | Depresjon, affektlidelser | 🟧 17 % | Multikausalt; ikke nødvendigvis lupusdrevet |
| Kognitive utfall | Kognitiv svikt, konsentrasjons- og hukommelsesproblemer | 🟧 11 % | Sannsynligvis underrapportert |
| Kramper | Epileptiske anfall | 🟧 8 % | Assosiert med aktiv sykdom eller vaskulære lesjoner |
| Angst | Angstlidelser | 🟥 4 % | Psykososialt og immunologisk sammensatt |
| Akutt konfusjon | Delir, akutt forvirring | 🟥 4 % | Ses ved aktiv sykdom |
| Psykose | Hallusinasjoner, vrangforestillinger | 🟥 2–8 % | Ofte debutsymptom; god remisjon hos de fleste |
| Autoantistoffer | Anti-ribosom P | – | Assosiert med NPSLE, men svak sensitivitet/spesifisitet |
| Patologiske funn | Mikrotromboser, vaskulitt, infarkter | – | Blandingsmekanismer er vanligst |
| Diagnostiske kriterier | ACR 19 NPSLE-mønstre (ACR, 1999 | – | Omfatter både nevrologiske og psykiatriske manifestasjoner |
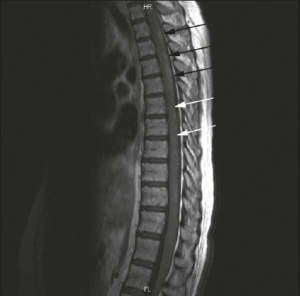
–Aseptisk meningitt, cerebrovaskulær sykdom, demyeliniserende syndrom, hodepine (inkludert migrene og benign intrakranial hypertensjon), bevegelses sykdom (chorea), myelopati, krampe-tilstander, akutt forvirring, angstlidelser, kognitiv dysfunksjon, depresjonstilstander, psykose. Posterior reversible encefalopati syndrom.
-Posterior reversible encefalopati syndrom, PRES: Hodepine, synsforstyrrelser, kramper, forvirring, hypertoni, cerebrale MR-forandringer.
-Ved apopleksi er 90% iskemiske og bare 10% hemoragiske.
-Transvers myelitt (MR-bilde ovenfor) er en svært alvorlig komplikasjon som raskt medfører pareser og paraplegi.
-Devics syndrom består av opticus-nevritt og transvers myelitt.
-Sinusvenetrombose: Hodepine, papilleødem, fokale nevrologiske symptomer, evt. epilepsi. Diagnosen stilles ved cerebral MR kombinert med venøs MR-angiografi. Man bør utelukke andre årsaker til trombose som mangel på protein C, protein S og antitrombin III, aktivert protein C resistens, antifosfolipid syndrom, bruk av orale prevensjonsmidler og hyper-homocysteinemi (Sanna. J 2008).
–Sekundær CNS: uremi, hypertensjon, infeksjon, koagulopati, kortikosteroider og andre medikamenter (Sarwar S, 2021).
Utredning av CNS manifestasjon: EEG er patologisk hos nesten 80 % av pasienter med CNS-SLE. Ellers kan utredningen være med SPECT (dynamisk hjerne-scintigrafi), MR-undersøkelser, eventuelt MR-angiografi, Doppler-undersøkelse av halskar og PET/CT av hjerne og ryggmarg. Analyse av spinalvæske og nevropsykologisk testing. Utredning av differensialdiagnoser som andre former for autoimmun encefalitt og primær CNS-vaskulitt. Ved affeksjon av CNS foreligger oftest aktiv SLE sykdom. Mange pasienter har auto-antistoffer som fosfolipid antistoffer (kardiolipin, beta-2-glykoprotein og Lupus antikoagulant) og anti-ribosomalt P.
Nefritt er relativt hyppig allerede ved SLE-debut. I tillegg utvikler stor andel nefritt innen de tre første sykdomsårene.
Tabell: Nyremanifestasjoner ved systemisk lupus erythematosus (SLE)
| Tema | Innhold | Referanser |
|---|---|---|
| Forekomst | • Nefritt ved debut hos ca. 16 %. • 40–70 % utvikler nefritt i løpet av de første sykdomsårene. |
(Mahajen A, 2020) |
| Kliniske særtrekk ved lupusnefritt | • Ofte mindre utslett, artritt og Raynaud enn andre SLE-pasienter. • Oftere alopesi og orale ulcera. |
– |
| Kriterier for nyreaffeksjon (klassifikasjon) | • Proteinuri > 0,5 g/L eller høy protein/kreatinin-ratio. • Typiske biopsifunn (klasse III/IV og II/V). |
– |
| Diagnostiske hovedfunn | • Nesten alle har proteinuri (45–65 % har nefrotisk syndrom). • Hematuri hos ca. 80 %. • Cellesylindre i urin: røde blodlegemer, hyaline, kornede eller blandede. • Nedsatt GFR og hypertensjon forekommer. |
(Norby GE, 2010). |
| Klinisk bilde | • Proteinuri, ofte nefrotisk syndrom. • Komplikasjoner: aterosklerose, venøs trombose (tap av antitrombin), infeksjonsrisiko (tap av Ig via urin). |
– |
| Akutt nyresvikt – årsaker | • Sjeldent ved glomerulonefritt (som vanligvis utvikler seg gradvis). • Vanligst ved: mikrotromber (TTP/HUS), nyrearterie-/venetrombose ved antiphospholipid syndrom, akutt interstitiell nefritt med immunkompleksnedslag. |
(Joseph RE, 2001) |
| Glomerulære patologiske funn | • Hypercellularitet (vanligst). • Wire-loop: eosinofil fortykkelse av basalmembran. • Halvmåner: ekstrakapillær proliferasjon fra parietalt epitel. • Fibrinoid: inflammatorisk eksudat (fibrin + serumproteiner). • Nekrose: neutrofile infiltrater, fibrin, brudd i basalmembran. • Hematoksylinlegemer: diagnostisk for SLE, sees hos ca. 25 %. |
Bollain-Y-Goytia JJ et al., 2011 |
| Vurdering av biopsi – aktive lesjoner | • Celleproliferasjon, leukocytt-eksudasjon, fibrinoid nekrose, hyalinavleiring, cellulære halvmåner, interstitiell inflammasjon. | – |
| Vurdering av biopsi – kroniske lesjoner | • Glomerulær sklerose, fibrotiske halvmåner, tubulær atrofi, interstitiell fibrose. • Kroniske forandringer gir dårlig prognose. |
– |
| Biopsi – praktiske forhold | • Viktig å vurdere antall glomeruli: – 10 glomeruli → 35 % risiko for å overse fokale lesjoner. – 20 glomeruli → 12 % risiko. • Mange har både proksimal og distal tubulus-dysfunksjon. • Segmentalt: del av glomerulus rammet. • Fokalt: < 50 % av glomeruli rammet. • Diffust: > 50 % rammet. |
– |
| Immunhistokjemi | • Nedslag av flere typer immunglobuliner og C3/C1q er typisk og taler sterkt for lupusnefritt. | – |
| Overvåkning etter biopsi | • Observasjon i 24 t pga. blødningsfare. • Forbigående hematuri hos 60–80 %. • Blødning hos ca. 2 %, <50 % av disse trenger intervensjon. |
(Lees JS, 2017). |
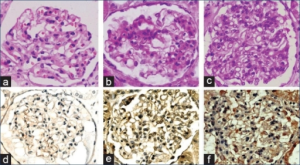
Klassifisering av nefritt (International sosciety of nefrology (2003)
| Histologisk klassifisering | Histologiske funn | Kliniske kjennetegn | |
| Klasse I | Minimal mesangial LN. Det sees normale glomeruli ved lysmikroskopi med mesangiale (mesangial-cellene er karenes støtteceller) depoter ved immunfluorescens | Minimale, ikke indikasjon for biopsi | |
| Klasse II | Mesangial proliferative LN. Mesangial hypercellularitet. | Hematuri, lavgradig proteinuri; nyresvikt, nefrotisk syndrom er uventet | |
| Klasse III | Fokal LN. Rammer <50% av glomeruli. Celleproliferasjon, lymfocyttinfiltrater, halvmåner. | Hematuri, proteinuri, nyresvikt. Nefrotisk syndrom er ikke uvanlig. | |
| Klasse IV | Diffus LN. Rammer >50% av glomeruli. | Hematuri, proteinuri, nyresvikt. Nefrotisk syndrom er ikke uvanlig. | |
| Klasse V | Membranøs LN. Gir ofte nefrotisk syndrom. Hematuri sjelden. Evt. hypertensjon. Behandles ofte med ciclosporin A. Man ser ofte kombinasjon av klasse V og III, samt klasse V og IV. | Proteinuri, ofte nefrotisk syndrom;. Hematuri forekommer. Nyresvikt er uvanlig. hematuri mulig; Vanligvis ikke nyresvikt | |
| Klasse VI | Avansert sklerotisk LN. 90% eller flere av glomeruli er skleroserte. | Nyresvikt. Proteinuri og hematuri er vanligvis tilstede. | |
Weening JJ . J Am Soc Nephrol 2004. Almaani S, Meara A, 2017 |
|||
Pulmonale manifestasjoner
En kan dele lungemanifestasjonene ved systemisk lupus i en rekke tilstander (Shin JIL, 2022).
- Pleuraaffeksjon med eller uten væske (55 %). Pleuritt er en vanlig manifestasjon som gir brystsmerter. Smertene er skarpe og stikkende og forverres ved dyp inspirasjon og hoste. I mange tilfeller kan det også samle seg væske i pleurahulen (pleuravæske).
- Akutt pneumonitt (ikke infeksjon). Pneumonitt ved SLE er en sjelden, men alvorlig komplikasjon. Symptomene omfatter hoste, feber og dyspne. Symptomene kan minne om pneumoni, men er et resultat av en immunologisk inflammasjon i lungevevet. Ubehandlet kan pneumonitt føre til alvorlig respirasjonssvikt.
- Kronisk diffus interstitiell lungesykdom (sjelden). Det er en alvorlig komplikasjon som utvikler seg gradvis. Pasientene kan merke progressiv dyspne og tørrhoste. Ubehandlet kan tilstanden føre til fibrose og permanent lungeskade.
- Pulmonal hypertensjon (sjelden). Komplikasjonen medfører økt blodtrykk i lungearteriene. Dette fører til symptomer som dyspne, tretthet og brystsmerter som ofte forverres ved anstrengelse. Uten behandling kan det økte trykket føre til høyresidig hjertesvikt.
- Pulmonal hemoragi (diffus, alveolær lungeblødning) er sjelden, men en livstruende komplikasjon. Den oppstår vanligvis akutt og gir blodig hoste, dyspne og raskt fall i hemoglobin. Tilstanden krever umiddelbar intensiv behandling.
- «Shrinking lung syndrome» (foto ovenfor: diafragmadysfunksjon med høystand av diafragma). Tilstanden fører til at lungevolumet reduseres. Symptomene omfatter dyspne og brystsmerter. Årsaken er en dysfunksjon i pustemuskulaturen, spesielt diafragma. En pasient med shrinking lung syndrome vil ha redusert lungevolum ved lungefunksjonstester, men typisk fravær av fibrose eller andre forandringer i selve lungevevet.
- Lungeemboli ses spesielt ved sekundært antifosfolipid syndrom som er assosiert til antifosfolipidantistoffer. Symptomene er vanligvis akutte som plutselig dyspne, brystsmerter og økt hjertefrekvens. Tilstanden krever umiddelbar medisinsk behandling.
Øyet ved systemisk lupus
Øyemanifestasjoner forekommer hos ca. en tredjedel av pasientene og kan påvirke ulike øyestrukturer inkludert orbita, øyelokkene, sklera, kornea, retina, choroidea og synsnerven. De to vanligste øyemanifestasjonene ved SLE er tørre øyne (sicca, sekundært Sjøgrens syndrom) og retinopati (Meng L, 2024).
Tørre øyne (keratoconjunctivitis sicca/sekundært Sjøgrens syndrom): Dette er den vanligste øyemanifestasjonen (opptil 30%) Sekundært Sjøgrens syndrom forårsaker tørrhet i slimhinner generelt, slik som i øyne, munn og underliv. Occulære symptomer inkluderer følelse av fremmedlegeme, irritasjon, brenning, kløe, lysskyhet og redusert tåreproduksjon.
Retinopati (Lupus retinopati): Forandringer på retina er blant de mest alvorlige øyemanifestasjonene og kan være et tegn på mer alvorlig systemisk sykdomsaktivitet. Ofte foreligger mikrovaskulære forandringer og “cotton wool spots”, hemoragier, eksudater og ødem og mikroaneurismer.
Optikusnevritt: Inflammasjon i synsnerven kan føre til plutselig synsreduksjon, smerter ved øyebevegelser og synsfeltutfall. Dette er en alvorlig komplikasjon som krever umiddelbar utredning og behandling.
Tolosa-Hunt syndrom er en sjelden, autoimmun sykdom med økt forekomst ved SLE. Symptomer er kraftig, plutselig og ensidig smerte bak eller rundt ett øye. Denne smerten skyldes en inflammasjon i sinus cavernosus og kan føre til lammelser i øyemuskulaturen.
Komplikasjoner sekundært til antifosfolipid syndrom (APS): Mange SLE-pasienter har også antifosfolipid antistoffer som øker risikoen for tromboembolier. Dette kan manifestere seg som okklusjon av retina-arterier eller -vener og i sjeldne tilfeller også sentralarterie- eller -venetrombose som kan føre til alvorlig og plutselig synstap.
Andre okulære manifestasjoner: Vaskulitt i øyet (iskemi), konjunktivitt, episkleritt, skleritt, blefaritt, diskoid eksem på øyelokk (Kedia N, 2023).
7. Spesielle former for SLE
Juvenil SLE (JSLE)
Totalt debuterer 15-20% av SLE-tilfellene i barne- eller ungdomsårene (JSLE). Sammenlignet med systemisk lupus (SLE) hos voksne, har relativt mange høy sykdomsaktivitet og økt risiko for organskade (Charras A, 2021). JSLE er omtalt i et eget kapittel.
Late-onset SLE
Medikament-indusert SLE
Det er rapportert mer enn 100 ulike medikamenter som kan utløse lupus. Sterkes assosiasjon har prokaninamid (IC025 7,48) og hydralasin (IC0,25 6,63), men disse er sjelden i bruk. Aesculus ekstrakt (IC025 4,60) er et ekstrakt fra hestekastanje som i naturmedisin brukes mot ulike revmatiske symptomer, åreknuter og væskeoverskudd (Methlie CB, 2009). Andre potensielt utløsende medikamenter er minocyklin, ethosuximid, kinidin, infliksimab, tocainid, acebutol og cortikotropin (Arnud L, 2018).
Ofte foreligger kutane lesjoner (kutan vaskulitt 10 %), mens alvorlige organmanifestasjoner er sjelden. Artralgi eller artritt ses hos nesten alle. Minocyklin-indusert lupus er et eksempel som sees i forbindelse med tetrasyklinbehandling av akutt acne vulgaris. Ofte påvises forhøyde leverenzymer med ANA hos 80 %. Subspesifisiteten histon-antistoffer regnes som relativt sensitive (ca. 75–95 % med medikament-lupus har positive histon antistoffer), men de er ikke spesifikke., ds anti-DNA ses hos 16 % og pANCA (ikke PR3 eller MPO-ANCA) hos 65 %. Hypergammaglobulinemi 60 %.
Remisjon etter seponering av utløsende medikament er hovedregelen, men tilfriskningen kan to måneder.
8. Utredning
Anamnesen bør dekke alle aktuelle symptomer (se ovenfor). Tidlige symptomer kombinert med karakteristiske antistoff i serum (se nedenfor) er høyst suspekte på sykdommen, selv om klassifikasjonene for diagnosen ikke er oppfylt initialt. Erfaring og studer viser at sykdommen utvikler seg gradvis. I noen tilfeller kan antistoff ha blitt påvist flere år før klinisk utbrudd.
Sentralt i anamnesen står likevel klassifikasjonskriteriene (se nedenfor) som kan være et godt diagnostisk utgangspunkt. En kan kartlegge utmattelse, alopesi, orale ulcera, sommerfugl-eksantem, generalisert utslett, subakutt kutant lupus-eksem, serositt (pleura, perikard), artritt, nefritt (biopsi: nefritt klasse), feber, CNS-manifestasjoner, fotosensitivitet, Raynauds fenomen, antistoff-profil (: ANA, DNA, Sm, SSA, andre og kombinasjoner, antifosfolipid antistoff;lupus antikoagulant, kardiolipin- og beta2-glykoprotein) og tromboembolier, spontanaborter og dødfødsler.
Klinisk gjøres en generell undersøkelse som kan omfatte munnslimhinne, hjerte, lunger, blodtrykk, hår, hud, ledd og nevrologisk vurdering ved aktuelle symptomer.
Laboratorieprøver.
Tabell. Laboratorieprøver som brukes i rutine, spesifikke antistoffer og markører for sykdomsaktivitet ved SLE. 🟢 Rutineprøver, 🔵 SLE-spesifikke antistoffer, 🟡 Sykdomsaktivitetsmarkører
| Prøve/undersøkelse | Funksjon/bruk | Typiske funn ved SLE | Kommentarer | Fargekode |
|---|---|---|---|---|
| Hemoglobin (Hb) | Vurdering av anemi | Anemi vanlig, ofte multifaktoriell | Kan skyldes jernmangel, inflammasjon, hemolyse eller nyreaffeksjon | 🟢 |
| Retikulocytter, LD, bilirubin, haptoglobin | Vurdering av hemolyse | Økt retikulocytter, LD og bilirubin; redusert haptoglobin | Direkte Coombs-test sjekker autoantistoffer på erytrocytter | 🟡 |
| Leukocytter med differensial | Vurdering av leukopeni | Isolert lymfocytopeni og/eller granulocytopeni | Kan være tegn på sykdomsaktivitet | 🟡 |
| Trombocytter | Vurdering av trombocytopeni | <100 × 10⁹/L i noen tilfeller | Kan være SLE-relatert eller sekundær til andre årsaker | 🟡 |
| SR (senkningsreaksjon) | Indikator på inflammasjon | Forhøyet hos ca. 90 % ved aktiv sykdom | Korrelasjon med gammaglobulin, men ikke CRP | 🟡 |
| CRP | Indikator på inflammasjon/infeksjon | Oftest normal ved SLE; kan øke ved artritt eller serositt | Høy CRP bør vurdere samtidig infeksjon | 🟢 |
| Elektrolytter, nyre- og leverfunksjon | Generell organfunksjon | Varierende | Nyreaffeksjon kan gi anemi pga. erythropoietin-mangel | 🟢 |
| Albumin | Vurdering av proteinstatus/nyreaffeksjon | Kan være redusert ved nefritt | Kombineres med urinundersøkelse | 🟢 |
| IgG, IgA, serum-elektroforese | Immunoglobuliner | Polykonal hypergammaglobulinemi | Korrelasjon med SR, ikke CRP | 🟢 |
| Thyreoideafunksjon | Skjoldbruskkjertelfunksjon | Normalt | Ikke spesifikt for SLE | 🟢 |
| CK | Muskelpåvirkning | Kan være normal | Vurderes ved myosittsymptomer | 🟢 |
| Urin stiks | Nefritt/urinpatologi | Proteinuri, hematuri | Kombineres med albumin og kreatinin | 🟢 |
| ANA (antinukleære antistoffer)* | Screening for autoimmun sykdom | Positiv hos >90 % | Høy sensitivitet, lav spesifisitet | 🔵 |
| Anti-dsDNA | SLE-spesifikt antistoff | Positiv hos ca. 45 % | Meget spesifikk; negativ anti-dsDNA sjelden nyreaffeksjon | 🔵 |
| Anti-Sm | SLE-spesifikt antistoff | Sensitivitet 10 %, høy spesifisitet | Retningsgivende for SLE-diagnose | 🔵 |
| Anti-ssDNA | Autoantistoff | Vanlig ved SLE, mindre spesifikt | Mindre diagnostisk verdi enn anti-dsDNA | 🔵 |
| Anti-RNP | MCTD vs SLE | Kan være positiv | Typisk for MCTD | 🔵 |
| Anti-SSA/SSB | Kutan lupus/Sjøgrens syndrom | Positiv ved subakutt kutan lupus | Kan hjelpe ved overlappstilstander | 🔵 |
| Anti-histon / anti-kromatin | CNS-lupus / SLE-spesifikke antistoffer | Kan være positiv | Kan indikere lupus-nevropati | 🔵 |
| Revmatoid faktor (RF) / anti-CCP | Differensialdiagnostikk mot RA | Positiv RF kan indikere “rhupus” | Overlapp mellom SLE og RA | 🔵 |
| Komplement (C3, C4, CH50, splittprodukter, TCC) | Sykdomsaktivitet | Redusert ved aktiv SLE | Økte splittprodukter ved aktiv sykdom | 🟡 |
| T-celler (CD3+, CD4+, CD8+, CD4/CD8-ratio) | Immunfunksjon | Redusert CD4+ ved infeksjonsrisiko | Ikke rutinemessig, vurderes ved hyppige infeksjoner | 🟢 |
| Antifosfolipid-antistoffer (lupus antikoagulant, anti-kardiolipin, anti-beta2-glykoprotein) | Vurdering av APS | Positiv hos 30 %; 25–50 % utvikler tromboembolier eller svangerskapskomplikasjoner | Vurder ved tromboembolisk hendelse eller spontanabort | 🔵 |
‘*Tommelfingerregel: “Jo flere ANA subtyper, desto mer sannsynlig foreligger SLE”.
Bildediagnostikk
Lunger: Røntgen av thoraks kan påvise pleuritt og pneumonitt. Ved mistanke om interstitiell lungesykdom eller lungeemboli er høyoppløselig CT (HRCT) og CT-angiografi med kontrastmidler de viktigste verktøyene.
Hjerte: Ekkokardiografi brukes for å påvise perikarditt og perikardvæske.
Muskel og skjelett: Røntgenbilder og MR kan påvise leddskade og avaskulær bennekrose, som er en fryktet komplikasjon av SLE.
Nervesystemet: MR av hjernen er den viktigste undersøkelsen ved cerebral lupus, for å påvise forandringer som vaskulitt, iskemiske skader, eller hjerneatrofi.
Mage og tarm: CT av abdomen brukes for å diagnostisere sjeldne, men alvorlige komplikasjoner som lupus-enteritt (kjennetegnes av fortykkelse av tarmveggen og væskeansamling i bukhulen).
- Vennligst les generelt om bildediagnostikk ved bindevevssykdommer i eget kapittel
Hudbiopsi: Stansebiopsi til immunfluorescensundersøkelse: Hvis biopsien er tatt fra et lys-eksponert område, er den positiv (påvisning av nedslag av immunglobuliner og komplement i den dermo-epidermale overgangssonen – den såkalte “Lupus Band Test”) hos 90 %. Imidlertid er det mange falske positive resultater i soleksponert hud. Hvis biopsien er tatt fra et ikke-soleksponert område, er testen mindre sensitiv, men mer spesifikk for diagnosen systemisk SLE. Ved Diskoid Lupus Erythematosus (DLE) påvises ikke immunologisk nedslag i uaffisert hud.
9. Diagnose
Å stille diagnosen SLE i et tidlig stadium kan være vanskelig fordi spekteret av mulige symptomer er stort og varierer mye fra person til person. Likevel begynner de autoimmune prosessene før de kliniske manifestasjonene blir synlige. Noen pasienter får først generelle symptomer, mens andre starter med symptomer fra bare ett organ, for eksempel isolert trombocytopeni. En tredje gruppe debuterer med multiorgan-sykdom..
Det finnes ingen diagnostiske kriterier for SLE (bare klassifikasjonskriterier). Diagnosen stilles på grunnlag av pasientens sykehistorie, organmanifestasjoner, påvisning av auto-antistoffer og eventuelle biopsier. Ved SLE vil ofte klassifikasjonskriteriene først være oppfylt en stund etter sykdomsstart. Sensitiviteten ved diagnose er imidlertid bedre for de nyere EULAR/ACR kriteriene av 1999 (92%) enn de eldre ACR kriteriene (1997, 77%) (Haukeland H, 2024).
Det er all grunn til å mistenke SLE hvis en pasient debuterer med manifestasjoner som nefritt i kombinasjon med anti-dsDNA-antistoffer eller med isolert trombocytopeni og markert positiv ANA (antinukleært antistoff).
10. Klassifikasjonskriterier
| 2019 EULAR/ACR klassifikasjons-kriterier (Aringer M, 2019) |
||
|
||
| Manifestasjoner
Nefritt (nyrebetennelse) |
Score | |
| Klasse III/IV (alvorlig nefritt) | 10 | |
| Klasse II/V | 8 | |
| Proteinuri >0,5g/d | 4 | |
| Antistoff: | ||
| Sm eller Ds-DNA | 6 | |
| Serositt | ||
| Perikarditt (Akutt) | 6 | |
| Perikardvæske / Pleuravæske økt | 5 | |
| Hud og slimhinner | ||
| Akutt kutan lupus (ACLE) | 6 | |
| Subakutt kutan eller diskoid lupus | 4 | |
| Orale sår | 2 | |
| Alopesi (uten arr) | 2 | |
| CNS (Sentralnervesystemet) | ||
| Epilepsi-lignende kramper | 5 | |
| Psykose | 3 | |
| Delir (forstyrret bevissthet) | 2 | |
| Ledd | ||
| Artritt | 6 | |
| Blodprøver | ||
| Hemolyse | 4 | |
| Trombocytopeni | 4 | |
| Leukopeni | 3 | |
| Komplement C3 og C4 lave | 4 | |
| Komplement C3 eller C4 lave | 3 | |
| Annet | ||
| Uforklart feber | 2 | |
| Antifosfolipid antistoff (lupus antikoagulant, kardiolipin eller β2-glykoprotein) | 2 | |
11. Mål for sykdomsaktivitet og -skade
Sykdomsaktivitet: SLEDAI 2k (SLEDAI 2000) er mest brukt, men finnes i flere versjoner. Den er praktisk og tar ca. 10 min å fullføre. Svakheter er at den ikke inkluderer forverring innen hvert organsystem eller generell bedring og forverring. Maksimal score er 105, men verdier over 20 er i praksis sjelden. (Gladmann DD, 2002). Andre skåringssystemer for sykdomsaktivitet er SLAM, SELENA, BILAG og CLASI (Mikdashi J, 2015).
Sykdomsskade: SLICC er desidert mest brukt og ble publisert i 1996 (Gladman D, 1996). SLICC måler permanent, irreversibel skade som har vart i minst 6 måneder (med unntak av myokardinfarkt og slag som registreres uten latenstid.
12. Differensialdiagnoser
Her er en liste med fokus på hvordan hver tilstand kan etterligne SLE:
- Artritt:
- Revmatoid Artritt (RA): Rammer primært leddene, men kan også gi systemiske symptomer som tretthet og feber som ved SLE. RA kan skilles fra SLE ved typiske leddforandringer, revmatoid faktor og anti-CCP antistoffer.
- Psoriasis-artritt: Assosiert med psoriasis og leddbetennelse som minner om SLE, men har ofte karakteristiske hudforandringer og affeksjon av distale interfalangealledd (DIP).
- Udifferensiert polyartritt: En klassifisering som brukes når pasienter har inflammatorisk artritt, men ikke oppfyller kriteriene for en spesifikk diagnose. Noen av disse pasientene kan senere utvikle SLE.
- Antifosfolipid syndrom: Karakteriseres av tromboser og/eller svangerskapskomplikasjoner i kombinasjon med antifosfolipid antistoffer. Kan overlappe med SLE, da antifosfolipid antistoffer er vanlige ved SLE.
- Bennekroser:
- Kortikosteroider: Langvarig bruk av kortikosteroider kan føre til bennekrose, et symptom som også kan ses ved SLE (da til dels uavhengig av steroider).
- CNS:
- Tumor, infeksjon, iskemi/tromboemboli: Disse tilstandene kan gi nevrologiske symptomer som hodepine, kognitive endringer og kramper som også kan forekomme ved SLE med CNS-affeksjon.
- Posterior reversible encephalopathy syndrome (PRES): Nevrologisk tilstand med hodepine, synsforstyrrelser, kramper og endret mental status. Kan utløses av hypertensjon og immunsuppressiva som begge er relevante for SLE-pasienter.
- Primær CNS vaskulitt: Betennelse i hjernens blodkar som kan gi nevrologiske symptomer som overlapper med SLE.
- Andre former for autoimmun encefalopati: En rekke autoimmune sykdommer kan ramme hjernen og gi symptomer som ligner på SLE med CNS-affeksjon.
- Cytopeni:
- Medikament-indusert: Mange medisiner, inkludert de som brukes til å behandle SLE, kan forårsake cytopeni.
- Sykdom i benmarg: Sykdommer som leukemi kan påvirke benmargen og føre til cytopeni, men oftest i alle tre celle-rekker, noe som er uvanlig ved SLE.
- Degos syndrom Sjelden sykdom med hudforandringer og tromboembolisk sykdom i små og mellomstore kar. Hudforandringene kan ligne på de som ses ved SLE.
- Evans syndrom; Kombinasjon av autoimmun hemolytisk anemi og trombocytopeni. Autoimmun hemolytisk anemi kan også forekomme ved SLE (Audia S, 2020).
- Fatigue: infeksjon, hypothyreose, hyperparathyreoidisme, depresjon, kronisk tretthetssyndrom (CFS, ME). Disse tilstandene kan gi uttalt tretthet, et vanlig symptom ved SLE.
- Feber av ukjent årsak:
- Opportunistisk- eller tropesykdom: Infeksjoner, spesielt hos immunsupprimerte pasienter (som de med SLE) kan gi feber.
- Sweets syndrom: Akutt febril neutrofil dermatose som kan gi feber og hudutslett som kan forveksles med SLE.
- Autoinflammatoriske sykdommer: En gruppe sykdommer med episodisk feber og betennelse, noen ganger med hud- og leddmanifestasjoner som kan ligne SLE.
- Adult Stills: Systemisk inflammatorisk sykdom med feber, utslett og leddsymptomer som kan ligne på SLE.
- GVHD (avstøtningsreaksjon): Immunreaksjon mot donorvev etter transplantasjon som kan gi eksantem, artralgi og andre symptomer som kan ligne SLE.
- Hemolytisk anemi, autoimmun: Destruksjon av røde blodceller av kroppens eget immunsystem. Kan forekomme som en del av SLE eller som en isolert tilstand.
- Hepatitt, autoimmun: Kronisk betennelse i leveren forårsaket av autoimmunitet. Kan gi tretthet, leddsmerter og andre symptomer som kan ligne SLE.
- Hjertet/perikard: Myokardinfarkt, infeksiøs endokarditt/perikarditt: Disse tilstandene kan gi brystsmerter og andre symptomer som kan forveksles med SLE-perikarditt.
- Hud:
- Roseacea: Kronisk hudsykdom med rødhet og kviser i ansiktet. Kan forveksles med det karakteristiske sommerfuglutslettet ved SLE.
- Dermatomyositt: Inflammatorisk muskelsykdom med karakteristisk hudutslett. Kan gi muskelsvakhet og hudforandringer som ligner SLE.
- Hypersensitivitets-reaksjon: Allergiske reaksjoner kan gi hudutslett som kan ligne SLE.
- Sweets syndrom: Neutrofil dermatose med plutselig feber og inflammasjon i hud (epidermis, dermis eller hypodermis), øyne, muskler, ledd og indre organer.
- Lunge/Pleura:
- Lungeemboli, infeksjon, kardial svikt: Disse tilstandene kan gi pustevansker og brystsmerter som også kan forekomme ved SLE med lunge- eller pleuraaffeksjon.
- Lymfeknuter, splenomegali:
- Infeksjoner, lymfom, leukemi: Disse tilstandene kan forårsake forstørrede lymfeknuter og milt som også kan sees ved SLE.
- Makrofag aktiveringssyndrom/HLH: Alvorlig tilstand med overaktivering av immunsystemet. Kan gi feber, cytopeni og organskade som kan ligne SLE.
- Medikament-bivirkning, DRESS: Alvorlig hudreaksjon på medisiner. Kan gi feber, utslett og organskade og kan derfor forveksles med SLE.
- Munnsår:
- Behcets: Kronisk inflammatorisk sykdom med munnsår, kjønnssår og øyeinflammasjon. Munnsår er også et vanlig symptom ved SLE.
- Metotreksat-bivirkning: Metotreksat brukes til å behandle SLE og RA, men kan forårsake munnsår som bivirkning.
- Mykose: Soppinfeksjoner kan forårsake munnsår som kan ligne de som ses ved SLE.
- Nyrer: Infeksjon, ANCA.-vaskulitt: Disse tilstandene kan forårsake nyreskade som også er en alvorlig komplikasjon av SLE.
- Tromboemboli:
- Primært anti-fosfolipid syndrom, Leiden-mutasjon, mangel på protein S eller protein C: Disse tilstandene øker risikoen for tromboemboli som også er en komplikasjon av SLE, spesielt hos pasienter med antifosfolipid antistoffer.
- Myxom, endokarditt: Disse tilstandene kan medføre tromboemboli.
- Idiopatisk: I noen tilfeller er årsaken til tromboemboli ukjent.
- Sarkoidose: Systemisk inflammatorisk sykdom som kan ramme flere organer, inkludert lunger, hud og ledd. Kan gi symptomer som ligner SLE
- Stills sykdom i voksen alder (adult Stills): Symptomer inkluderer feber, artritt, flyktig eksantem, sår hals, lymfadenopati, splenomegali og serositt kan forveksles med SLE.
- Trombotisk trombocytopenisk trombose (TTP): Sjelden, men alvorlig tilstand med lavt antall blodplater og tromboser i små blodkar. Kan gi symptomer som ligner SLE.
- Udifferensiert systemisk bindevevssykdom: En klassifisering som brukes når pasienter har symptomer på en systemisk bindevevssykdom, men ikke oppfyller kriteriene for en spesifikk diagnose. Noen av disse pasientene kan senere utvikle SLE.
13. Svangerskap ved SLE
Kvinner med SLE har en 2–3 ganger økt risiko for komplikasjoner og uønskede svangerskapsutfall sammenlignet med friske kvinner (Clowse ME, 2008). Risikoen er særlig forhøyet dersom sykdommen har vært aktiv i månedene før konsepsjon eller debuterer under graviditeten. På tross av dette har svangerskapsutfallet blitt betydelig bedre de siste tiårene, hovedsakelig som følge av god svangerskapsplanlegging, moderne behandling og tett tverrfaglig oppfølging. Det er nå sjelden at pasienter frarådes graviditet på grunn av SLE.
Fertilitet og familieplanlegging. Fertiliteten er vanligvis normal. Likevel får kvinner med SLE i gjennomsnitt færre barn enn forventet, noe som kan skyldes både økt risiko for spontanabort og dødfødsel, særlig ved aktiv sykdom og antifosfolipid syndrom, og at noen velger å få færre barn (Skorpen AC, 2021).
Planlegging av graviditet er avgjørende. Sykdommen bør være i remisjon i minst 6 måneder, og etter aktiv lupusnefritt anbefales 2–3 år før konsepsjon for å redusere risikoen for residiv og komplikasjoner. Medikamentbruk må gjennomgås nøye, men stabile, effektive og fostersikre legemidler bør ikke seponeres. Hydroksyklorokin (Plaquenil) er trygt under graviditet og amming og anbefales kontinuerlig.
Før graviditet bør man kartlegge antifosfolipidantistoffer (lupusantikoagulant, kardiolipin- og β2-glykoprotein-I-antistoff), da resultatet kan ha behandlingsmessige konsekvenser. Graviditet frarådes ved alvorlig nedsatt nyrefunksjon (GFR < 30 ml/min).
Sykdomsaktivitet under og etter graviditet. Kvinner med SLE har en 2–3 ganger økt risiko for sykdomsresidiv under svangerskap og i postpartum-perioden, særlig dersom sykdommen ikke er stabil før konsepsjon. Ved godt kontrollert sykdom er risikoen for forverring liten. Samtidig er situasjonen sårbar fordi ikke alle effektive SLE-medikamenter kan brukes. SLE gir generelt økt risiko for:
- Spontanabort
- Intrauterin fosterdød
- Redusert fostervekst
- Prematur fødsel (vanligst)
- Preeklampsi
Særlig utsatte grupper er gravide med nefritt, klinisk eller serologisk sykdomsaktivitet og antifosfolipid antistoffer eller etablert antifosfolipid syndrom (APS).
Medikamenter i svangerskap
Følgende legemidler er kontraindisert pga. teratogen risiko:
• Mykofenolat (CellCept)
• Cyklofosfamid (Sendoxan)
• Metotreksat
• Leflunomid (Arava)
• ACE-hemmere og angiotensin-reseptorblokkere
Kortikosteroider kan brukes, men høye doser øker risikoen for veksthemming og prematur fødsel. Prednisolon ≤ 7,5 mg/dag regnes som lavrisiko. Ved alvorlig sykdom må nødvendige doser gis. Prednisolon >20 mg/dag er assosiert med høy forekomst av prematur fødsel (>60 %) (Palmsten K, 2021).
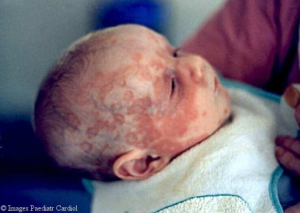
Kongenitalt hjerteblokk og neonatal lupus. Gravide med SSA- eller SSB-antistoffer har en 1–2 % risiko for at fosteret utvikler kongenitalt hjerteblokk grad III, vanligvis mellom uke 16–26 (Andreoli L, 2017; Samaritano LR, 2020). Fosterets hjertefrekvens bør monitoreres ukentlig eller annenhver uke fra uke 16 til minst uke 24. Lav hjertefrekvens (<110/min) krever rask henvisning til fostermedisin.
Hydroksyklorokin reduserer risikoen for kongenitalt hjerteblokk, særlig hos kvinner som tidligere har fått affisert barn (forekomsten redusert fra 18 % til 7,4 %) (Izmirly P, 2020).
Neonatal lupus forekommer hos opptil 10 % av barn født av SSA-positive mødre. Hudforandringene, cytopeni, forhøyede leverenzymer og hepatosplenomegali er forbigående og skyldes maternalt antistoff. Symptomene forsvinner når antistoffene elimineres etter fødsel. Gynekologisk forening anbefaler EKG av alle nyfødte av mødre med SSA/B-antistoffer.
Preeklampsi, Gravide med SLE har økt risiko for preeklampsi, særlig ved aktiv sykdom. Selv lavgradig aktivitet tredobler risikoen for preeklampsi og prematur fødsel (Skorpen CG, 2018). Typiske tegn er hypertensjon og proteinuri etter uke 20. Alvorlig preeklampsi kan kreve prematur forløsning.
Profylakse med lavdose acetylsalisylsyre (ASA 75–150 mg/dag) fra uke 12 anbefales til alle med SLE (NICE guidelines, 2019; Xu T, 2015). ASA >100 mg/dag seponeres ofte tre uker før termin for å redusere blødningsrisiko. Hydroksyklorokin forebygger ikke preeklampsi (Rector A, 2024).
Tromboemboli og antifosfolipidantistoff. Graviditet og postpartum representerer en høyrisikoperiode for tromboembolier hos kvinner med antifosfolipid syndrom (APS) eller trippel positive antistoff (Tektonidou, MG, 2019). Vanlig profylakse:
- Lavmolekylært heparin (LMWH) i profylaktisk dose
- ASA 75 mg/dag inntil uke ~36
Dette gjelder særlig ved tidligere tromboser eller ved APS. Behandling fortsetter ofte 6–12 uker postpartum. Asymptomatiske bærere av antifosfolipid antistoffer får ofte ASA alene.
Trombocytopeni i svangerskap. Trombocytopeni forekommer ved SLE, men verdier ned til 50 ×10⁹/L tolereres normalt uten tiltak. Ved lavere verdier kan følgende vurderes: Prednisolon 20–60 mg/dag, azathioprin 1–2 mg/kg/dag (latens flere uker) og/eller IVIG eller rituksimab (kun i 2.–3. trimester, streng indikasjon). Differensialdiagnoser inkluderer preeklampsi, HELLP, DIC, TTP og HUS (Haram K, 2003).
Oppfølging under og etter svangerskap. Gravide med SLE bør følges i spesialisthelsetjenesten gjennom hele svangerskapet og gjerne vurderes av revmatolog før konsepsjon. Kontroller ved revmatolog og fødepoliklinikk tilpasses sykdomsaktivitet og trimester. Nevro-, nyre-, hjerte- eller hematologiske manifestasjoner krever målrettet spesialistoppfølging (Skorpen AC, 2021). Ved hver kontroll bør det vurderes:
- Ledd, hud og organmanifestasjoner
- Blodtrykk og ødemer
- Blodprøver (Hb, leukocytter, trombocytter, kreatinin/eGFR)
- Urin (protein og hematuri)
Hver trimester suppleres med komplement (C3, C4) og anti-dsDNA.
Revmatologisk kontroll anbefales 6–8 uker postpartum, da risikoen for residiv er økt første året etter fødsel (Götestam Skorpen, C, 2017).
Assistert befruktning
Hormonell ovulasjonsstimulering kan gi økt risiko for sykdomsresidiv (Orquevaux P, 2017). Assistert befruktning kan gjennomføres etter individuell vurdering, men frarådes ved aktiv sykdom, alvorlig nyresvikt, ukontrollert hypertensjon, alvorlig kardiovaskulær sykdom, tidligere tromboser eller APS (Andreoli L, 2017). ASA ± LMWH vurderes ved antifosfolipidantistoffer.
Antikonsepsjon
Tidligere ble østrogenholdige p-piller frarådet generelt, men studier viser at de ikke øker SLE-aktivitet eller tromboser ved stabil sykdom og fravær av antifosfolipidantistoffer (Petri M, 2005); Sánchez-Guerrero J, 2005).
Ved APS eller høy tromboserisiko anbefales progesteron-basert prevensjon. Intrauterin hormonspiral er et godt alternativ (Andreoli L, 2017).
Medikamentbruk under graviditet
Detaljert gjennomgang finnes i kapittelet «Svangerskap ved revmatisk sykdom (REV 078)» og hos NKSR. Medikamenter under graviditet er også beskrevet i kapittelet om svangerskap ved revmatisk sykdom (REV 078).
14. Behandling
Generelle, non-medikamentelle tiltak:
Sykdomsforløpet ved SLE er individuelt og behandlingen tilpasses den enkeltes sykdomsmanifestasjoner, sykdomsforløp, komorbiditet, toleranse og preferanser. Det er likevel vanskelig å forutse hvordan den enkelte vil respondere på behandlingen. De fleste pasientene behandles gjennom flere år med basisbehandling for å redusere frekvensen av residiv og eksaserbasjoner. Supplerende medikasjon i perioder kan likevel være nødvendig.
-Sol-eksponering og spesielt solbrenthet bør unngås fordi sykdomsaktiviteten kan øke, et residiv kan oppstå eller medikamentene bidrar til hudskader. Solfaktor 70 anbefales, faktor 30 er for lav. Mange vil trenge oral vitamin- D substitusjon.
-Røykeslutt: Røyking kan forverre sykdomsaktiviteten og redusere effekten av visse medisiner, som hydroksyklorokin.
-Fysisk aktivitet: Tilpasset og regelmessig fysisk aktivitet kan forbedre kondisjon, redusere fatigue og opprettholde muskelstyrke og bevegelighet.
-God søvnhygiene: God søvn er essensielt for å håndtere fatigue.
-Sunt kosthold: Et sunt og variert kosthold er viktig for å opprettholde en god helse, spesielt for å forebygge hjerte- og karsykdommer.
-Pasientopplæring og egenmestring: Å lære om sykdommen og hvordan man kan håndtere symptomer er viktig for å mestre en kronisk tilstand som SLE.
–Infeksjoner øker risikoen for sykdomsaktivitet og bør forebygges så langt som mulig. Det omfatter “døde” vaksiner (influensa, pneumokokker, papillomavirus, meningokokker, hepatitt, zoster), og hygienetiltak, men også å unngå eksponering (backpacker i Asia, Afrika etc.). Kortikosteroider, særlig høye doser (> 15 mg/dag) øker infeksjonsrisikoen og anvendes på strenge indikasjoner. Vurder nøye gevinsten av å behandle de mildeste sykdoms-manifestasjonene.
Derom T-celler er lave med CD4 <200 μL (referanseområde 500–1400 celler/µL) bør en vurdere forebyggende antibiotika med cotrimazol (Bactrim) mot opportunistiske mikrober. Ved alvorlig neutropeni (<0,4-0,5/ml) (referanseområde 1,8–6,9 x 109/L) kan forebyggende mykose-behandling være aktuelt. I tillegg bør alltid infeksjoner behandles raskt med antibiotikum. Supplerende immunglobulin-substitusjon kan gis ved behov, f. eks hvis IgG er < 4g/L.
–Aterosklerose. På lengre sikt foreligger økt risiko for aterosklerose. Utenom røkestans bør høyt kolesterol behandles. Statiner er første-valget. En bør tilstrebe å holde kolesterol i blodet godt under 5 mmol/l og/eller et LDL-nivå under 3 mmol/L. Hydroksyklorokin kan også ha en gunstig effekt.
-Utmattelse/fatigue: Pasientinformasjon, rehabilitering og tilpasset fysisk trening er aktuelt.
Treat to target/behandlingsmål
Før behandlingen begynner bør en sette mål som skal nås (“treat to target”), noe de fleste pasientene også ønsker (Mucke J, 2024). Realistiske behandlingsmål kan være fravær av klinisk sykdomsaktivitet (remisjon) og prednisolon-doser på ≤ 5mg/dag. Man kan ta utgangspunkt i individuelle manifestasjoner eller sykdomsaktivitet målt f. eks. ved kompositt-score som BILAG (British Isles Lupus Assessment Group) eller SLEDAI (Systemic Lupus Erythematosus Disease Activity Index).
Ved lupusnefritt er behandlingsmålet å oppnå komplett renal respons. Fordi nyresykdommen kan vedvare til tross for klinisk remisjon, anbefaler noen en ny nyrebiopsi og histologisk/immunopatologisk behandlingsmål etter 1-2 års behandling (Parodis I, 2020).
Ved å nå behandlingsmålene vil en også hindre organskade, redusere kardiovaskulær komorbiditet, bedre pasientens livskvalitet og bedre mortalitetsraten (Yang Z, 2022).
Medikamenter
Pasienten har rett på informasjon og skal være innforstått med behandlingsmålet. I tillegg er det viktig å informere om hensikten med behandlingen, slik at de kan ta informerte valg. Informasjonen kan suppleres med skriftlig medikament-informasjon fra Norsk revmatologisk forening/Legeforeningen. Ved god informasjon oppnås at medikamentene i større grad tas etter hensikten. Vennligst les om behandlingssvikt i eget kapittel. Vær oppmerksom på at flere av medikamentene som brukes ikke har SLE som formelt godkjent indikasjon og kan derfor betraktes som utprøvende behandling. Dette krever ekstra grundig vurdering og oppfølging.
Tabell. Behandlingsprinsipper for medikamenter ved SLE
| Medikament | Bruk |
| Hydroksyklorokin (Plaquenil) | Gis til alle (utenom ved kontraindikasjoner). Dosering: så nær opp til 5 mg/kg/dag som mulig. Kan være kortikosteroid-sparende ((Fei Y, 2025). Ved bruk lenger enn 5 år, vurderes dosen redusert med tanke på retinopati-risiko. |
| Kortikosteroider (prednisolon, metylprednisolon) | Brukes ved akutt sykdomsaktivitet. Kortvarig i høye doser (f. eks. puls iv. med metylprednisolon). Deretter reduseres dosen så raskt som mulig til et vedlikeholdsnivå tilsvarende ≤ 5mg/dag prednisolon eller helst avsluttes. |
| DMARDs | Hvis hydroksyklorokin og kortikosteroider ikke er tilstrekkelig eller for raskere kortikosteroid-nedtrapping, suppleres med DMARDs som azathioprin (Imurel), mykofenolat eller metotreksat. |
| Biologiske legemidler | Belimumab og anifrolumab er alternativer eller tillegg (“add on”) til DMARDs ved vedvarende sykdomsaktivitet, spesielt ekstrarenale manifestasjoner. Rituximab brukes i enkelte tilfeller. |
| Lupusnefritt eller annen alvorlig organmanifestasjon | Trippelbehandling med kortikosteroid + mykofenolat + enten belimumab eller en kalsineurinhemmer (voclosporin, takrolimus) kan være aktuelt. Ved effektiv behandling i tidlig stadium kan kortikosteroider trappes raskere ned (You Y, 2024). Cyklofosfamid (Sendoxan iv) brukes ved de mest alvorlige og livstruende tilfellene, f. eks. ved raskt progredierende nyresvikt eller alvorlige nevrologiske manifestasjoner. |
- Induksjonsbehandling. Behandlingsmålet bør nås i løpet av 3-12 måneder. Solu-Medrol, prednisolon, hydroksyklorokin, mykofenolat, belimumab og cyklofosfamid er blant medikamentene som benyttes.
- Vedlikeholdsbehandling begynner etter induksjonsbehandlingen og opprettholdes vanligvis 2-3 år eller lenger fra remisjon. Kortikosteroider (prednisolon) er vanligvis det første medikamentet som trappes ned og som seponeres pga. risikoen for langtidsbivikninger. Hydroksyklorokin (Plaquenil) er ofte det siste medikamentet som avsluttes.
Glukokortikoider: Medikamentet utgjør en sentral del av behandlingen ved SLE og er ofte nødvendige for å oppnå rask kontroll over sykdomsaktivitet, særlig tidlig i behandlingsforløpet. Valg av administrasjonsform og dose avhenger av alvorlighetsgrad og organmanifestasjoner.
-Peroral prednisolon er standard førstevalg ved mild til moderat sykdomsaktivitet.
-Intravenøs metylprednisolon (pulsbehandling) brukes ved alvorlige eller livstruende manifestasjoner, slik som lupusnefritt klasse III–IV, nevrologiske manifestasjoner, vaskulitt, hemolytisk anemi eller trombocytopeni med truende organsvikt. Hensikten er å raskt dempe inflammasjon og forhindre irreversibel vevsskade, samtidig som man begrenser total kumulativ steroidbelastning.
-Langvarig bruk av glukokortikoider bør unngås på grunn av velkjente dose- og tidsavhengige bivirkninger, inkludert: infeksjoner, diabetes, katarakt, osteoporose, gastrointestinal blødning og aterosklerose. Til tross for dette viser klinisk erfaring og flere studier at for rask dosereduksjon, eller vedlikeholdsdoser < 5 mg prednisolon daglig, er assosiert med økt risiko for sykdomsresidiv av SLE, særlig ved moderat til høy sykdomsaktivitet i utgangspunktet (Math A, 2020). Revmatologen må derfor balansere risikoen for glukokortikoidrelaterte bivirkninger mot faren for alvorlig sykdomsoppbluss, og redusere dosen gradvis basert på klinikk, biomarkører og organstatus.
-Ved milde og ikke-organtruende manifestasjoner, som lett redusert allmenntilstand, milde kutane utslett eller artralgi/lett artritt, kan følgende strategi være tilstrekkelig: Hydroksyklorokin (HCQ) som basisbehandling + lavdose prednisolon, ofte i størrelsesorden 2,5–7,5 mg/dag. Målet er som regel å oppnå og opprettholde lavest mulig prednisolondose, ideelt < 5 mg/dag, så snart sykdomskontrollen tillater det (Fei Y, 2025).
-For å minimere glukokortikoidbruk og redusere kumulativ steroidbelastning, kombineres behandlingen ofte også med steroidbesparende DMARDs, særlig ved vedvarende sykdomsaktivitet.
Hydroksyklorokin (Plaquenil). Alle pasienter med SLE bør starte med hydroksyklorokin (Plaquenil) så snart som mulig, forutsatt fravær av kontraindikasjoner (Fanouirakis A, 2024). Medikamentet har flere gunstige effekter ved SLE, inkludert reduksjon av kutane manifestasjoner, artritt, dyslipidemi, hyperglykemi, tromboemboliske hendelser, aterosklerose og risiko for infeksjoner. Bruk av hydroksyklorokin er også assosiert med økt overlevelse (Cairoli E, 2012; Petri M, 2011; Grimaldi L, 2024). Dosen av hydroksyklorokin bør titreres opp mot 5 mg/kg/d, forutsatt at en tar hensyn til risiko for kontraindikasjoner og bivirkninger. For majoriteten av pasientene tilsvarer dette Plaquenil 300 mg/d (Garg S, 2024).
-Bruk av hydroksyklorokin kan begrenses av risikoen for retinopati etter lang tids bruk (>5-10 år) (Melles RB, 2016), sjeldnere bivirkninger og kontraindinksajoner som sentralnervøse manifestasjoner, eksantem, psoriasis, syns- eller hørselstap.
Konvensjonelle syntetiske DMARDs (csDMARDs). csDMARDS utover hydroksyklorokin kan legges ved utilstrekkelig effekt. Valg av csDMARD vurderes individuelt, basert på sykdomsmanifestasjon, komorbiditet, potensielle bivirkninger og pasientens preferanser. Medikamentene som kan være aktuelle inkluderer: azathioprin (Imurel), metotreksat (Winzer M, 2010), mykofenolat (Ordi-Ros, 2017), takrolimus, ciclosporin A og cyklofosfamid.
-Voklosporin er en nyere kalsineurinhemmer som har en bedre farmakokinetikk enn ciklosporin A og er et aktuelt behandlingsalternativ for lupusnefritt (Rovin BH, 2021). Kostnad begrenser imidelertid bruken.
Biologisk behandling ( bDMARDs) brukes ved utilstrekkelig effekt av csDMARDs og kan i noen tilfeller gis som tilleggsbehandling.
-Belimumab (Benlysta) er et monoklonalt antistoff som hemmer B-celleaktivitet ved å blokkere B-celleaktiverende faktor (BAFF)/B-lymfocyttstimulerende faktor (BLyS). Ved å blokkere dette proteinet reduseres antall sykdomsfremkallende B-celler og autoantistoffer. Belimumab kan brukes som tilleggsmedikament (“add-on”) ved suboptimal respons på annen behandling.
-Anifrolumab (Saphnelo) virker ved å hemme T-celler via type 1 interferonreseptoren og er et annet alternativ ved alvorlig SLE. Indikasjonen er tilleggsbehandling for voksne med moderat til alvorlig aktiv, autoantistoff-positiv SLE. Målet er å redusere sykdomsaktiviteten og behovet for kortikosteroider. (Murphy G, 2019; Morand EF, 2020; Marinho A, 2023).
Selv om både belimumab eller anifrolumab har effekt (Touma Z, 2025), indikerer studie-data også at færre enn 20% av pasientene oppnår sykdomsremisjon etter ett år (Parodis I, 2024; Morand EF, 2025).
-Rituksimab, en B-celle-hemmer som reduserer sirkulerende B-celler betydelig, men suboptimal vevsdistribusjon kan forklare begrenset effekt ved SLE (Kamburova EG, 2013). Ritiksimab brukes “off-label” ved alvorlige tilfeller der annen behandling ikke har hatt tilstrekkelig effekt. Risiko for hypogammaglobulinemi og infeksjoner foreligger ved langvarig bruk. Rituksimab vurderes ved refraktære tilfeller med lupusnefritt, ved CNS- eller hematologiske manifestasjoner (Merill JT, 2010).
Valg av medikament styres generelt av de/den dominerende organmanifestasjonen og av behandlingsmål (Fanouirakis A, 2024; Thomas Dörner, Richard Furie, 2019). Kombinasjonsbehandling som cyklofosfamid + belimumab, mykofenolatmofetil + belimumab eller mykofenolatmofetil + kalsineurinhemmer (takrolimus eller voklosporin) kan vurderes i visse tilfeller. Uansett, både studier og klinisk praksis viser et klart behov for mer potente medikamenter.
CAR T-celleterapi er et nytt behandlingsprinsipp under klinisk utprøving i revmatologi. Ved hjelp av genteknologi omprogrammeres T-celler til å angripe spesifikke overflatestrukturer på B-celler. Anti-CD19 CAR-T-celleterapi har vist bemerkelsesverdig effekt i innledende studier av alvorlig SLE (Zhou J, 2024). Flere studier er imidlertid nødvendig for å evaluere langtidseffekt og sikkerhetsprofil (Jin X, 2021; Mitra A, 2023; Müller F, 2024). De høye kostnadene ved CAR T-celleterapi og potensielle sikkerhetsutfordringer som cytokinfrigjøringssyndrom (MAS) og mulig langvarig infeksjonsrisiko er hindringer. Fremover kan forbedrede CAR T-celle-metoder som antigen-spesifikke kimære autoantistoffreseptorer eller kimære autoantigen T-celle-reseptorer (BiTES) forbedre behandlingstilbudet ytterligere (Lungova K, 2025).
For supplerende informasjon om SLE-behandling vises til prosedyrer for SLE utarbeidet av Norsk Revmatologisk Forening (metodebok) og tabellene nedenfor:
Tabell. Medikamenter, indikasjon og referanser. 🟢 Førstevalg, 🟡 Andrevalg / supplement, 🔴 Tredjevalg / utprøvende.
| Medikament / gruppe | Indikasjon / Bruksområde | Behandlingslinje | Referanser |
|---|---|---|---|
| Hydroksyklorokin (Plaquenil) | Alle SLE-pasienter uten kontraindikasjoner. Reduserer hud- og leddsmerter, tromboser, kardiovaskulær risiko, lipid- og glukoseprofil. | 🟢 Førstevalg | Fanouirakis A, 2024; Cairoli E, 2012; Petri M, 2011; Grimaldi L, 2024; Melles RB, 2016 |
| Kortikosteroider (prednisolon, metylprednisolon) | Akutt sykdomsaktivitet, induksjon av remisjon, CNS-manifestasjoner, lupusnefritt, kardiovaskulære og pulmonale komplikasjoner. Reduseres så raskt som mulig til ≤5 mg/d prednisolon. | 🟢 Førstevalg | Math A, 2020; Arnaud L, 2025; Figueroa-Parra G, 2024 |
| Azatioprin (Imurel) | Vedlikeholdsbehandling, steroid-sparing, moderat sykdom, hematologiske manifestasjoner, mild lupusnefritt. | 🟡 Andrevalg | Winzer M, 2010; Santacruz, JC, 2022 |
| Metotreksat (MTX) | Moderat til alvorlig ikke-renalt SLE, artritt, kutane manifestasjoner, steroid-sparing. | 🟡 Andrevalg | Winzer M, 2010; Arnaud L, 2025 |
| Mykofenolat mofetil (MMF, CellCept) | Lupusnefritt (klasse III-V), vedlikeholdsbehandling, CNS-manifestasjoner, alvorlige hudmanifestasjoner, hematologiske manifestasjoner. | 🟢 Førstevalg ved lupusnefritt | Ordi-Ros, 2017); (Sammaritano LR, 2025 |
| Cyklofosfamid (Sendoxan) | Alvorlig, livstruende SLE-manifestasjoner (CNS-lupus, raskt progredierende lupusnefritt, myokarditt), pulsbehandling, induksjon ved alvorlig lupusnefritt. | 🔴 Tredjevalg / reservert | Fanouirakis A, 2024; Arnaud L, 2025; Sammaritano LR, 2025 |
| Belimumab (Benlysta) | Vedvarende sykdomsaktivitet, spesielt ekstrarenale manifestasjoner, add-on til DMARDs, trippelbehandling ved lupusnefritt. | 🟡 Andrevalg | Sakai H, 2025; |
| Anifrolumab (Saphnelo) | Alvorlig/moderat aktiv SLE, add-on ved suboptimal respons, hud- og ekstrarenale manifestasjoner. | 🟡 Andrevalg | Murphy G, 2019;; Morand EF, 2020; Marinho A, 2023; Touma Z, 2025 |
| Rituksimab | Refraktære tilfeller, lupusnefritt, CNS- eller hematologiske manifestasjoner, hematologisk SLE. | 🔴 Tredjevalg | Merill JT, 2010; Kamburova EG, 2013; Santacruz, JC, 2022 |
| Calcineurinhemmere (Takrolimus, Ciclosporin, Voclosporin) | Lupusnefritt, add-on ved MMF eller CYC, trippelbehandling, steroid-sparing. | 🟡 Andrevalg | Rovin BH, 2021; Sammaritano LR, 2025 |
| ACE-hemmere / ARB (Captopril, Enalapril, Losartan) | Lupusnefritt, hypertensjon, nyrebeskyttelse, kardiovaskulær risikoreduksjon. | 🟢 Førstevalg | Fanouriakis A, 2020 |
| Betablokkere / Spironolakton / Kalsiumantagonister | SLE-assosiert hjertesykdom, hypertensjon, perikarditt, myokarditt. | 🟡 Andrevalg | Arnaud L, 2025 |
| Statiner | Forebygging av aterosklerose og kardiovaskulære hendelser. | 🟢 Førstevalg | Grimaldi L, 2024 |
| Acetylsalisylsyre (ASA) | Profylakse mot arterielle tromboembolier, sekundær profylakse ved APS. | 🟢 Førstevalg | Pengo V, 2018; Dufrost V, 2016 |
| Warfarin (Marevan) | Venøse tromboembolier, antifosfolipidantistoff-syndrom, høy risiko. | 🟢 Førstevalg | Pengo V, 2018 |
| Intravenøse immunglobuliner (IVIg) | Refraktære hematologiske manifestasjoner (AIHA, ITP), perikarditt, lungesykdom ved intoleranse for steroider. | 🔴 Tredjevalg | Santacruz, JC, 2022; Piranavan P, 2020 |
| CAR T-celleterapi (anti-CD19) | Klinisk utprøving ved alvorlig refraktær SLE | 🔴 Utprøvende | Zhou J, 2024; Mitra A, 2023; Lungova K, 2025 |
Tabell. Indikasjoner for medikamenter ut i fra ulike organmanifestasjoner
✅ (grønn) = førstevalg, 🟡 (gul) = annetvalg, 🔴 (rød) = tredjevalg/refraktær.
| Organ / manifestasjon | Førstevalg | Annetvalg | Tredjevalg / refraktær | Kommentar / referanser |
|---|---|---|---|---|
| Hud (kutane lesjoner) | ✅ Hydroksyklorokin | 🟡 Kortikosteroider (topikal/systemisk), Metotreksat | 🔴 Belimumab (refraktær) | Fanouirakis A, 2024; Petri M, 2011 |
| Ledd / artritt | ✅ Hydroksyklorokin | 🟡 Metotreksat | 🔴 Belimumab | Fanouirakis A, 2024; Arnaud L, 2025 |
| Nyre (lupusnefritt) | ✅ Mykofenolat (induksjon), kortikosteroider | 🟡 Cyklofosfamid (Eurolupus), kalsineurinhemmere | 🔴 Rituksimab, CAR T-celleterapi, voclosporin (trippelbehandling) | Ordi-Ros, 2017; Rovin BH, 2021 |
| CNS-lupus | ✅ Kortikosteroider | 🟡 Mykofenolat, Cyklofosfamid | 🔴 Rituksimab, CAR T-celleterapi | Fanouirakis A, 2024; Merill JT, 2010 |
| Hematologiske manifestasjoner | ✅ Kortikosteroider | 🟡 Azathioprin, Mykofenolat, IVIG | 🔴 Rituksimab, CAR T-celleterapi | Santacruz, JC, 2022; Piranavan P, 2020 |
| Lunge / pleura / pulmonale | ✅ Kortikosteroider | 🟡 Azathioprin, Mykofenolat, IVIG | 🔴 Cyklofosfamid | Arnaud L, 2025 |
| Hjerte / myokarditt | ✅ Kortikosteroider | 🟡 IVIG | 🔴 Cyklofosfamid | Fanouirakis A, 2024 |
| Perikarditt | ✅ NSAIDs / Kortikosteroider | 🟡 Kolkisin | 🔴 Anakinra | Piranavan P, 2020 |
| Vedvarende aktiv SLE / ekstrarenalt | ✅ Hydroksyklorokin | 🟡 Belimumab, Anifrolumab | 🔴 Rituksimab (refraktær) | Murphy G, 2019; Morand EF, 2020 |
| Trombose / APS | ✅ Antikoagulasjon (ASA, Warfarin) | Dufrost V, 2016; Pengo V, 2018 | ||
| Kardiovaskulær profylakse / dyslipidemi | ✅ Statiner | Grimaldi L, 2024 | ||
| Hypertensjon / nyrebeskyttelse | ✅ ACE-hemmere / ARB | Fanouriakis A, 2020 |
Tabell. Valg av systemisk medikasjon hos voksne basert EULAR-anbefalinger (modifisert etter Fanouirakis A, 2024 og Mucke J, 2020).
| Mild | Moderat | Alvorlig | |||
| Første valg | Refraktær | Første valg | Refraktær | Første valg | Refraktær |
| Hydroksyklorokin (Plaquenil tabl.) 200-400mg/d (≤5 mg/kg/d på sikt). Til alle, dersom ikke kontraindikasjoner. | |||||
| Kortikosteroider p.o (i.m); f. eks. prednisolon ≤5mg/d | Kortikosteroider p.o./ i.v; f. eks. initialt prednisolon 5,0-60 mg/d p.o eller metylprednisolon (SoluMedrol) 250-500 mg/d iv. Trappes ned så raskt som mulig til ≤ 5mg/d | ||||
| Metotreksat f. eks 10-25 mg s.c. eller p.o. per UKE eller Azathioprin (Imurel tabl). f. eks. 2 mg/kg/d eller mykofenolat (MMF) | |||||
| Belimumab (Benlysta), anifrolumab (Saphnelo) | |||||
| calcineurinhemmer (ciclosporin, takrolimus, voclosporin tabl.) | |||||
| Mykofenolat (MMF, CellCept tabl.) f. eks. 1-2 g/d fordelt på to doser. Maksimalt 3 g/d. | |||||
| Cyklofosfamid i.v. f. eks. iv 500 mg hver 2. uke i 6 infusjoner (totalt 12 uker.) | |||||
| Rituksimab | Rituksimab | ||||
Kirurgi
Pasienter med systemisk lupus (SLE) er utsatt for osteonekrose med påfølgende behov for protesekirurgi. Imidlertid medfører bedret medikamentell behandling og oppfølgning at stadig flere med SLE utvikler artrose av aldersgrunner eller forårsaket av tidligere leddskade (Mukherjee S, 2015). Splenektomi på grunn av behandlingsresistent autoimmun trombocytopeni eller hemolytisk anemi er blitt sjelden etter innføring av rituximab som behandlingsalternativ.
Kirurgi ved SLE innebærer økt risiko for komplikasjoner (blødning, infeksjon, sepsis). Preoperativ optimering av SLE-aktivitet, hemoglobin og trombocytt-tall er viktig.
Profylakse mot infeksjoner og tromboser. Sammenlignet med non-lupus pasienter er postoperativ sepsis funnet å være fire ganger økt (Gholson JJ, 2018).
15. Oppfølging ved SLE
Oppfølging av pasienter med SLE er langvarig og må tilpasses sykdomsaktivitet, organaffeksjon og behandlingsregime. Målet er å oppnå og vedlikeholde remisjon eller lav sykdomsaktivitet, samtidig som organskade, residiv og behandlingsrelaterte bivirkninger forebygges (Mok CC, 2018).
Overordnede mål i oppfølgingen. Oppfølgingen bør systematisk vurdere tre hovedaspekter:
- Utelukke tegn på alvorlige eller livstruende manifestasjoner
– spesielt nefritt, CNS-manifestasjoner, hematologiske kriser, myokarditt/perikarditt og alvorlig vaskulitt. - Identifisere og skille infeksjon fra sykdomsaktivitet
– infeksjon er en ledende årsak til morbiditet og mortalitet ved SLE, og kliniske tegn kan overlappe med flare. - Vurdere sykdomsaktivitet klinisk og laboratoriemessig
– sikre at pasienten er i remisjon eller har lav sykdomsaktivitet, og oppdage tidlige tegn på oppbluss.
I tillegg bør revmatologen alltid vurdere:
- Etterlevelse av behandling (adherens), inkludert hydroksyklorokin.
- Bivirkninger av legemidler, spesielt glukokortikoider, immunsuppressiva og antimalariamidler.
- Risiko for organskade, kardiovaskulær sykdom og osteoporose.
Kontrollintervaller. Oppfølgingen skjer vanligvis i samarbeid mellom fastlege og revmatolog:
- Ved aktiv sykdom: hver 1–3 måned
- Ved stabil tilstand/lav aktivitet: hver 3–6 måned
- Ved organtruende manifestasjoner: oftere og i spesialisthelsetjenesten
Hyppigheten øker ved endringer i behandling, oppståtte bivirkninger eller mistanke om flare.
Aktuelle undersøkelser ved kontroll
1. Klinisk vurdering
- Allmenntilstand, feber, infeksjonstegn
- Leddstatus
- Hudmanifestasjoner
- Tegn på perikarditt, pleuritt eller nevrologiske symptomer
- BT-måling og vurdering av volumstatus (relevant ved nefritt)
- Vurdering av bivirkninger (infeksjoner, steroidkomplikasjoner, GI-plager m.m.)
2. Rutinemessige laboratorieprøver
- Hemoglobin, leukocytter med diff., trombocytter
- Kreatinin, eGFR, elektrolytter
- Leverfunksjonsprøver
- CRP og SR
- Urin stiks (proteinuri, hematuri)
- Urin-albumin/kreatinin-ratio eller døgnurin ved mistanke om nefritt
3. Sykdomsaktivitetsmarkører
Tas noe sjeldnere, typisk 1–2 ganger årlig, men hyppigere ved aktiv sykdom eller behandlingsendringer:
- Anti-dsDNA
- Komplementfaktorer C3 og C4
Fall i C3/C4 og stigende anti-dsDNA kan indikere kommende oppbluss, særlig ved lupusnefritt.
4. Risikoprofiler og behandlingsrelaterte prøver
- Lipidprofil og glukose, spesielt ved glukokortikoidbruk
- Vitamin D og DEXA ved risiko for osteoporose
- Retinaundersøkelse ved langtidsbehandling med hydroksyklorokin (årlig fra 5 års behandling, tidligere ved risikofaktorer)
16. Prognose
Prognosen ved SLE har bedret seg betydelig i løpet av de siste tiårene som følge av tidligere diagnostikk, mer målrettet behandling og bedre kontroll av komorbiditeter. Likevel er SLE fortsatt en potensielt alvorlig sykdom som kan gi betydelig organskade og økt dødelighet. Enkelte kliniske trekk er forbundet med dårligere prognose, blant annet alvorlig nefritt, hypertensjon, trombocytopeni, pulmonal og sentralnervøs affeksjon samt høy debutalder, selv om sistnevnte er mindre vanlig.
Nyreaffeksjon er en av de viktigste prognostiske faktorene ved SLE. Ved lupusnefritt oppnås komplett klinisk og histologisk remisjon hos bare 20–30 % etter 6–12 måneders behandling, og tilbakefall forekommer hos om lag en firedel av pasientene innen 3–5 år (Anders H-J, 2020). Rundt 5–10 % utvikler alvorlig, irreversibel nyresvikt i løpet av ti år. Noen pasienter blir dialysekrevende og må vurderes for nyretransplantasjon, og resultatene etter transplantasjon er sammenlignbare med ikke-diabetiske kontrollgrupper, selv om subklinisk sykdomsresidiv i transplantatet forekommer hos mer enn halvparten av pasientene (Norby GE, 2009).
Totalmortaliteten ved SLE har gjennomgått en markant reduksjon. I før-steroid-epoken på 1940-tallet døde om lag halvparten av pasientene innen fem år, mens 15-års overlevelse i dag er 85–95 % (Tektonidou MG, 2017). En norsk kohort viste en 5-års overlevelse på 98 % og 10-års overlevelse på 95 %, med en standard mortalitetsrate på 1,5 (Garen T, 2018). Mortaliteten har et bifasisk mønster. I tidlig fase dominerer sykdomsrelaterte dødsårsaker som aktiv nefritt, CNS-manifestasjoner, alvorlige infeksjoner og tidlige kardiovaskulære hendelser. I senere faser er det komorbid kardiovaskulær sykdom og cerebrovaskulære hendelser som dominerer. Hyppige sykdomsoppbluss forverrer langtidsprognosen betydelig, og jo flere eksaserbasjoner en pasient har, desto høyere er risikoen for SLE-relatert dødsfall.
Dødsårsaker direkte relatert til SLE utgjør omtrent 21 % av alle dødsfall hos pasienter med sykdommen, fordelt mellom infeksjoner, hjerte-karsykdommer og maligne sykdommer (Garen T, 2018). Den totale kreftforekomsten hos SLE-pasienter synes ikke å være vesentlig økt, men enkelte kreftformer, særlig cervixcancer og Hodgkins lymfom, forekommer hyppigere enn i normalbefolkningen.
17. Retningslinjer, anbefalinger og prosedyrer
ACR: Sammaritano LR, 2025 (lupus nefritt)
EULAR: Fanouirakis A, 2024 (Management 2023)
EULAR: Fanouriakis A, 2020 (management lupus-nefritt)
ACR (svangerskap): Samaritano LR, 2020
EULAR/ACR Aringer M, 2019: Klassifikasjonskriterier for SLE
Britisk: Gordon C, 2018 (Management)
EULAR: Andreoli L, 2017 (assistert befruktning)
EULAR: Götestam Skorpen, 2015 (medikamenter ved svangerskap og amming)
ACR: Hahn BH, 2012 (Lupus nefritt)
Norsk revmatologisk forening/legeforeningen (prosedyrer)
18. Litteratur
- Dai X, 2025 (patogenese, diagnose, behandling)
- Müller F, 2024 (CAR-T behandling)
- Hoi A, 2024
- Fanouirakis A, 2024 (behandlingsanbefalinger)
- Zhou J, 2024 (CAR-T behandling)
- Accapezzato O, 2023 (patogenes og behandling)
- Lazar S, 2023
- Thomas Dörner, Richard Furie, Lancet 2019
- Mok CC, 2018
- Arnud L, 2018 (medikamentutløst SLE)
- Skorpen AC, 2021 (Svangerskap)
- Hanly G, 2018 (CNS-lupus)
- Norby GE, 2010 (Lupus nefritt)
- Skomsvoll JF, 2007 (Svangerskap)
Teksten er basert på aktuell faglitteratur. Den er skrevet og gjennomgått av forfatterne. I redigeringen er kunstig intelligens brukt i noen avsnitt.
